Содержание
- 2. Цикл Кребса (ЦТК) (Цикл ди- и трикарбоновых кислот)
- 3. Понятие о ЦТК Цикл Кребса представляет собой этап катаболизма углеводов, жиров и белков в аэробных условиях.
- 4. Реакция 1. Синтез цитрата. Фермент - цитратсинтаза,(АЦ = активный центр) субстраты - ацетил-КоА, оксалоацетат,вода продукт -
- 5. Реакция 2.Изомеризация цитрата в изоцитрат. Фермент - аконитаза (АЦ = активный центр). Субстрат - цитрат. Продукт
- 6. Реакция 3. Дегидрирование изоцитрата Фермент - изоцитратдегидрогеназа (АЦ = активный центр). Субстрат - изоцитрат Продукт -
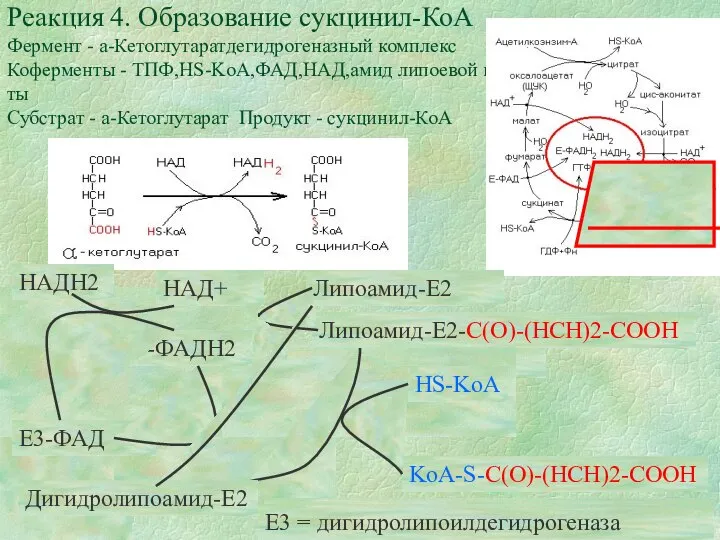
- 7. Реакция 4. Образование сукцинил-КоА Фермент - а-Кетоглутаратдегидрогеназный комплекс Коферменты - ТПФ,НS-KoA,ФАД,НАД,амид липоевой к-ты Субстрат - а-Кетоглутарат
- 8. После ориентации сукцинил-КоА в АЦ фермента к молекуле в области двойной связи подходит протон и образуется
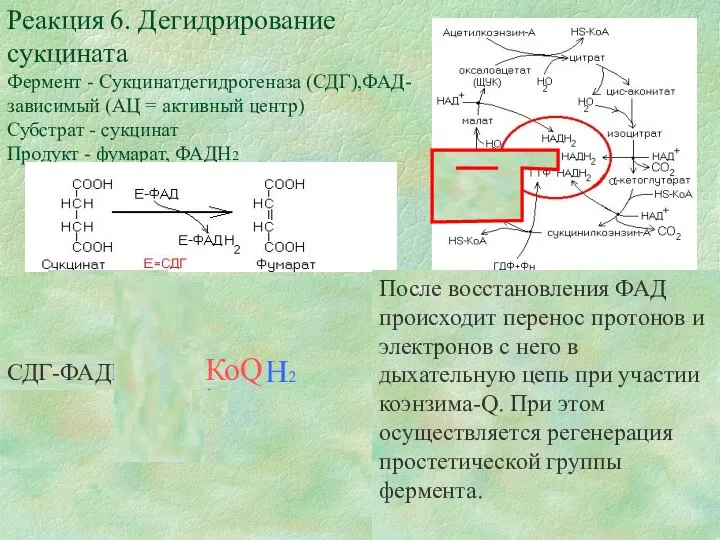
- 9. Реакция 6. Дегидрирование сукцината Фермент - Сукцинатдегидрогеназа (СДГ),ФАД-зависимый (АЦ = активный центр) Субстрат - сукцинат Продукт
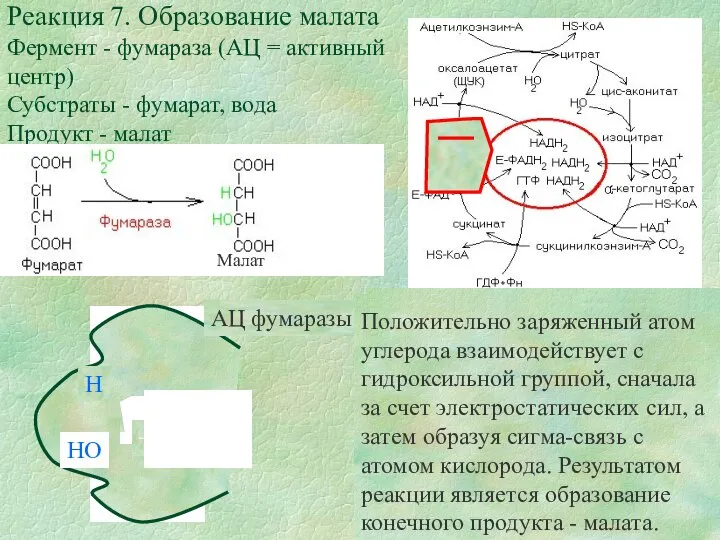
- 10. АЦ фумаразы обладает сродством к концевым кислым группам молекула фумарата, что обеспечивает правильную ориентацию ее и
- 12. Скачать презентацию
Цикл Кребса (ЦТК)
(Цикл ди- и трикарбоновых кислот)
Цикл Кребса (ЦТК)
(Цикл ди- и трикарбоновых кислот)
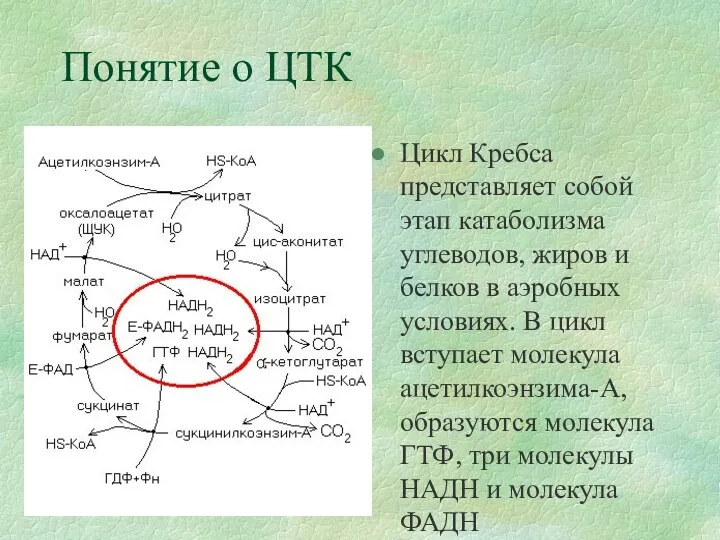
Понятие о ЦТК
Цикл Кребса представляет собой этап катаболизма углеводов, жиров и
Понятие о ЦТК
Цикл Кребса представляет собой этап катаболизма углеводов, жиров и
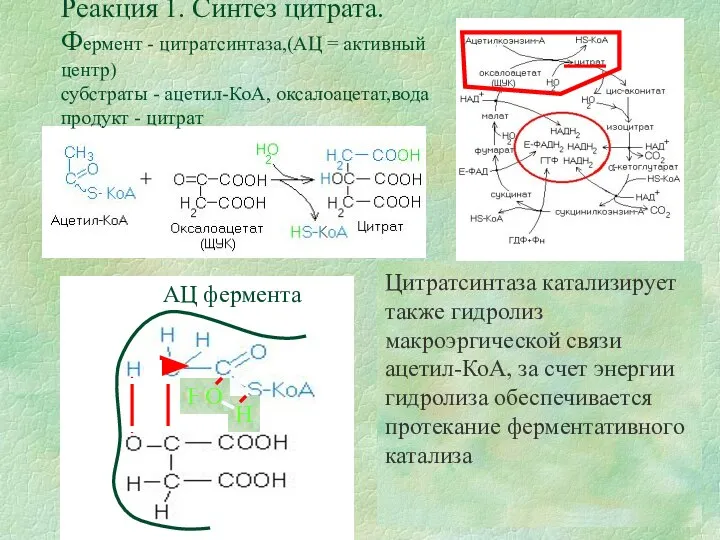
Реакция 1. Синтез цитрата.
Фермент - цитратсинтаза,(АЦ = активный центр)
субстраты - ацетил-КоА,
Реакция 1. Синтез цитрата. Фермент - цитратсинтаза,(АЦ = активный центр) субстраты - ацетил-КоА,
Активный центр фермента обладает сродством к молекулам оксалоацетата и ацетил-КоА и обеспечивает их определенную пространственную ориентацию
Между отрицательно заряженным атомом кислорода кетогруппы оксалоацетата и водородным атомом ацетил-КоА возникает водородная связь
В результате образования водородной связи происходит гиперполяризация пи-связи кетогруппы в направлении атома кислорода и сигма-связи метильной группы в направлении атома углерода
Происходит перегруппировка связей в результате чего вместо кетогруппы образуется гидроксильная, а атомы углерода оксалоацетата и ацетил-КоА соединяются сигма-связью
Цитратсинтаза катализирует также гидролиз макроэргической связи ацетил-КоА, за счет энергии гидролиза обеспечивается протекание ферментативного катализа
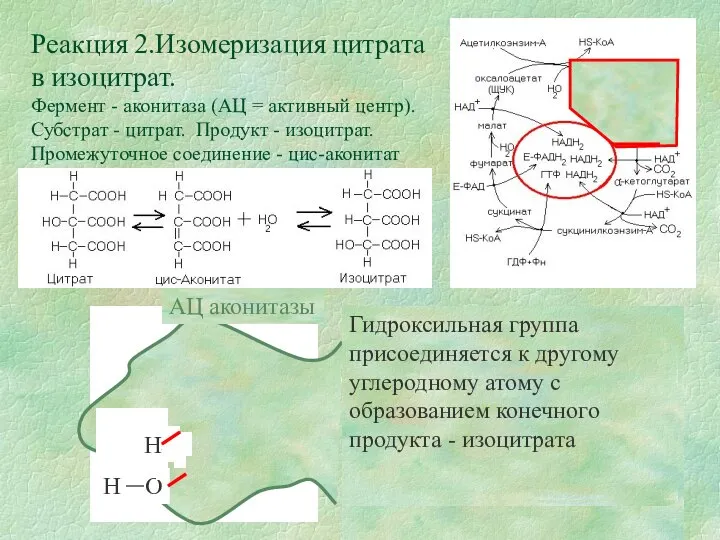
Реакция 2.Изомеризация цитрата в изоцитрат.
Фермент - аконитаза (АЦ = активный центр).
Реакция 2.Изомеризация цитрата в изоцитрат. Фермент - аконитаза (АЦ = активный центр).
Активный центр аконитазы, обладающий сродством к молекуле цитрата обеспечивает определенную ориентацию субстрата
Под действием активного центра фермента происходит поляризация связей в гидроксильной и одной из метильных групп субстрата
Между кислородным атомом гидроксильной групы и водородом метильной возникает водородная связь
При возникновении водородной связи образуется молекула воды и цис-аконитата за счет перегруппировки связей
Молекула воды способна изменять свое местоположение в активном центре фермента, при этом происходит сближение атома водорода в ее составе с перекрывающимися р-электронными облаками пи-связи
При такой ориентации молекул возможно образование сначала пи- , а затем и сигма-комплекса и присоединение атома водорода к одному из углеродных атомов
Присоединение водородного атома идет против правила Марковникова из-за ориентирующего влияния фермента
Гидроксильная группа присоединяется к другому углеродному атому с образованием конечного продукта - изоцитрата
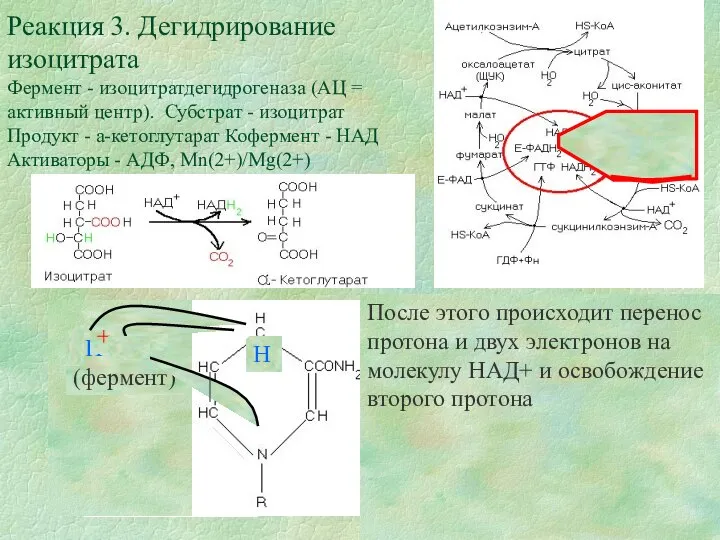
Реакция 3. Дегидрирование изоцитрата
Фермент - изоцитратдегидрогеназа (АЦ = активный центр). Субстрат
Реакция 3. Дегидрирование изоцитрата Фермент - изоцитратдегидрогеназа (АЦ = активный центр). Субстрат
СОО
Происходит ориентирование молекулы изоцитрата, обладающей стереоизомерией в АЦ фермента
Фермент катализирует декарбоксилирование СООН группы, находящейся в АЦ изоцитрат-ДГ
Далее происходит отщепление водородных атомов гидроксильной группы и 2-го С-атома с замыканием Пи-связи С-О. Промежуточным акцептором протонов и электронов служат функциональные группы фермента
После этого происходит перенос протона и двух электронов на молекулу НАД+ и освобождение второго протона
Реакция 4. Образование сукцинил-КоА
Фермент - а-Кетоглутаратдегидрогеназный комплекс
Коферменты - ТПФ,НS-KoA,ФАД,НАД,амид липоевой к-ты
Субстрат
Реакция 4. Образование сукцинил-КоА Фермент - а-Кетоглутаратдегидрогеназный комплекс Коферменты - ТПФ,НS-KoA,ФАД,НАД,амид липоевой к-ты Субстрат
Е1-ТПФ
Липоамид-Е2
HS-KoA
Е3-ФАД
НАД+
Е1 = а-кетоглутаратдегидрогеназа
Е2 = дигидролипоилсукцинилтрансфераза
Е3 = дигидролипоилдегидрогеназа
После ориентации сукцинил-КоА в АЦ фермента к молекуле в области двойной
После ориентации сукцинил-КоА в АЦ фермента к молекуле в области двойной
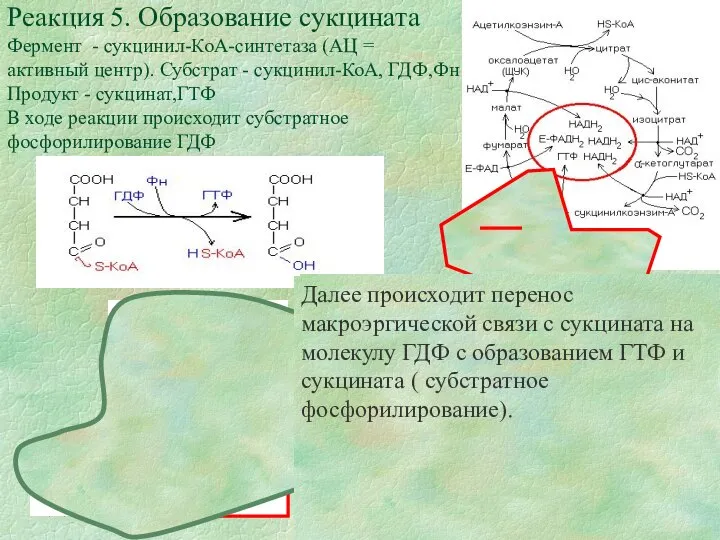
Реакция 5. Образование сукцината
Фермент - сукцинил-КоА-синтетаза (АЦ = активный центр). Субстрат - сукцинил-КоА, ГДФ,Фн Продукт - сукцинат,ГТФ
В ходе реакции происходит субстратное фосфорилирование ГДФ
ГДФ - ОН
Вследствие гиперполяризации С-О связей одна из них разрывается, положительный заряд с протона переходит на атом углерода, образуется гидроксильная группа
К положительно заряженному углеродному атому подходит ион ортофосфата, ориентируемый конфигурацией АЦ фермента. Между С-атомом сукцината и кислородным атомом фосфата образуется эфирная связь
Так как электронная конфигурация группы, содержащей у одного углеродного атома две эфирных связи неустойчива, происходит отщепление молекулы НS-KoA с переходом водородного атома на кофермент и восстановлением двойной С-О связи, эфирная связь при этом становится макроэргической
Далее происходит перенос макроэргической связи с сукцината на молекулу ГДФ с образованием ГТФ и сукцината ( субстратное фосфорилирование).
Реакция 6. Дегидрирование сукцината
Фермент - Сукцинатдегидрогеназа (СДГ),ФАД-зависимый (АЦ = активный центр)
Субстрат
Реакция 6. Дегидрирование сукцината Фермент - Сукцинатдегидрогеназа (СДГ),ФАД-зависимый (АЦ = активный центр) Субстрат
Группа ФАД, в отличие от других акцепторов водорода, ковалентно связана с апоферментом и является не кофактором, а простетической группой,и непосредственно участвует в образовании АЦ фермента
После ориентирования молекулы сукцината в АЦ фермент осуществляет перенос водородных атомов на простетическую группус образованием фумарата
КоQ
После восстановления ФАД происходит перенос протонов и электронов с него в дыхательную цепь при участии коэнзима-Q. При этом осуществляется регенерация простетической группы фермента.
АЦ фумаразы обладает сродством к концевым кислым группам молекула фумарата, что
АЦ фумаразы обладает сродством к концевым кислым группам молекула фумарата, что
Реакция 7. Образование малата
Фермент - фумараза (АЦ = активный центр)
Субстраты - фумарат, вода
Продукт - малат
К молекуле фумарата в области двойной связи подходит молеула воды, ориентируемая электростатическими силами
Действие АЦ фермента обеспечивает повышение поляризации связи О-Н в молекуле воды и облегчает образование пи-комплекса с вовлечением пи-связи молекулы фумарата
Далее пи-комплекс спонтанно превращается в сигма-комплекс, молекула воды распадается на протон и гидроксильную группу, положительный заряд протона распределяется на него и два углеродных атома, пи-связь между которыми разрушается
В ходе реакции сигма-комплекс также разрушается, атом водорода образует сигма-связь с одним из углеродных, а другой получает положительный заряд
Положительно заряженный атом углерода взаимодействует с гидроксильной группой, сначала за счет электростатических сил, а затем образуя сигма-связь с атомом кислорода. Результатом реакции является образование конечного продукта - малата.

 POST-карта. Плата расширения или тестер
POST-карта. Плата расширения или тестер Культура скифов
Культура скифов Видимая среда вокруг нас
Видимая среда вокруг нас Презентация по профессиональной стратификации
Презентация по профессиональной стратификации Команда энактес. Годовой отчет 2017-2018 год
Команда энактес. Годовой отчет 2017-2018 год Виды оружия
Виды оружия Регуляция соматических функций
Регуляция соматических функций Основные понятия в тестировании. Тестовые артефакты
Основные понятия в тестировании. Тестовые артефакты Корпоративное бизнес обучение активным продажам на по методике бизнес тренера Иосифа Хусенского
Корпоративное бизнес обучение активным продажам на по методике бизнес тренера Иосифа Хусенского История развития педагогики
История развития педагогики Проблема
Проблема Структура общения
Структура общения Топони́мика
Топони́мика Основные методы научных исследований Выполнил студент группы Т-111с Бобырь Алексей
Основные методы научных исследований Выполнил студент группы Т-111с Бобырь Алексей Генерація та виведення масиву дійсних чисел. Програма для впорядкування масиву рядків
Генерація та виведення масиву дійсних чисел. Програма для впорядкування масиву рядків Презентация Политика как социальная сфера
Презентация Политика как социальная сфера Приборы для диагностики заболеваний органов зрения
Приборы для диагностики заболеваний органов зрения  Применение дистанционных технологий обучения для учащихся – детей с ограниченными физическими возможностями
Применение дистанционных технологий обучения для учащихся – детей с ограниченными физическими возможностями Способы преобразования проекций (Лекция 3)
Способы преобразования проекций (Лекция 3) Учебное пособие по сборке компьютера
Учебное пособие по сборке компьютера Судебные споры, банкротство и субсидиарная ответственность в финансовом секторе
Судебные споры, банкротство и субсидиарная ответственность в финансовом секторе Multithreading. User Group’s Web Site
Multithreading. User Group’s Web Site Wartość
Wartość Решение прикладных задач и разработка приложений на языке Python
Решение прикладных задач и разработка приложений на языке Python ФУНКЦИОНАЛЬНЫЙ ГЕНЕРАТОР
ФУНКЦИОНАЛЬНЫЙ ГЕНЕРАТОР Выполнили: ученики 11 класса
Выполнили: ученики 11 класса ссс
ссс Философия как социокультурный феномен
Философия как социокультурный феномен