Содержание
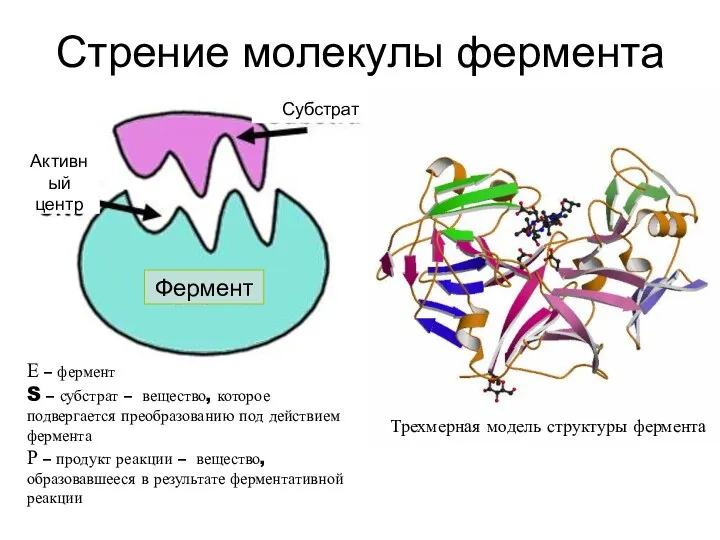
- 2. Стрение молекулы фермента The main part of the enzyme molecule is called the active site, which
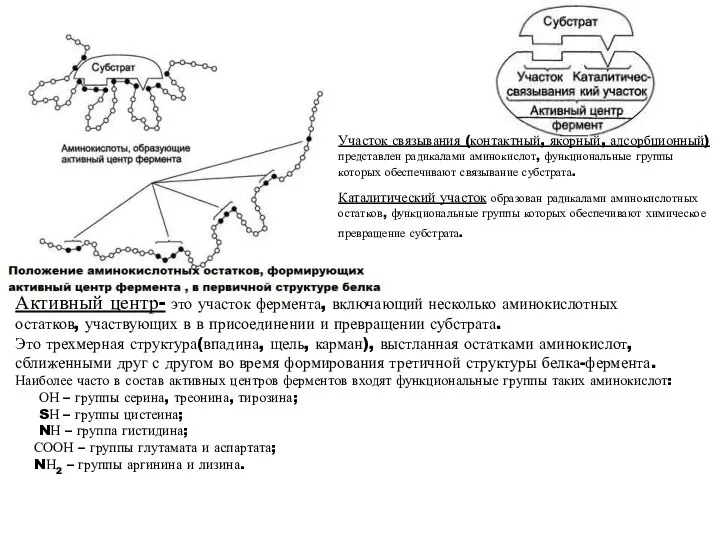
- 3. Активный центр- это участок фермента, включающий несколько аминокислотных остатков, участвующих в в присоединении и превращении субстрата.
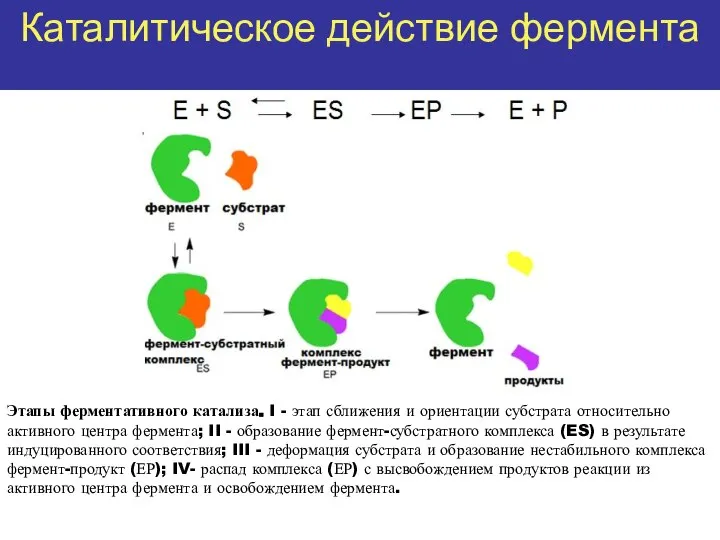
- 4. Каталитическое действие фермента Этапы ферментативного катализа. I - этап сближения и ориентации субстрата относительно активного центра
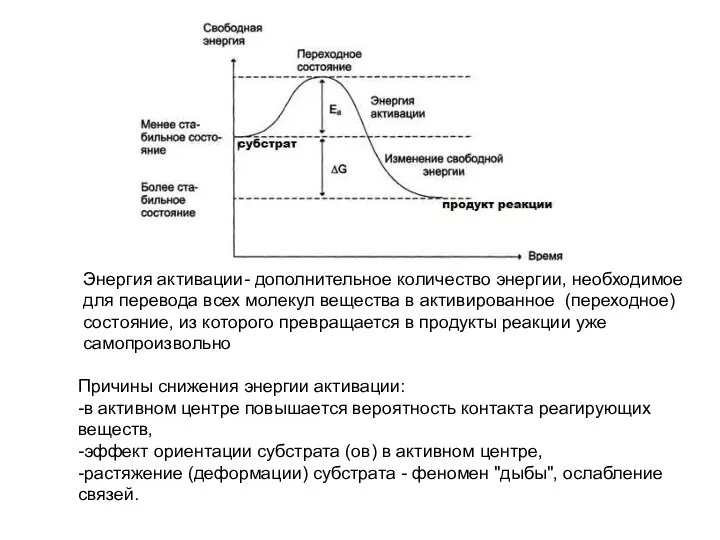
- 5. Энергия активации- дополнительное количество энергии, необходимое для перевода всех молекул вещества в активированное (переходное) состояние, из
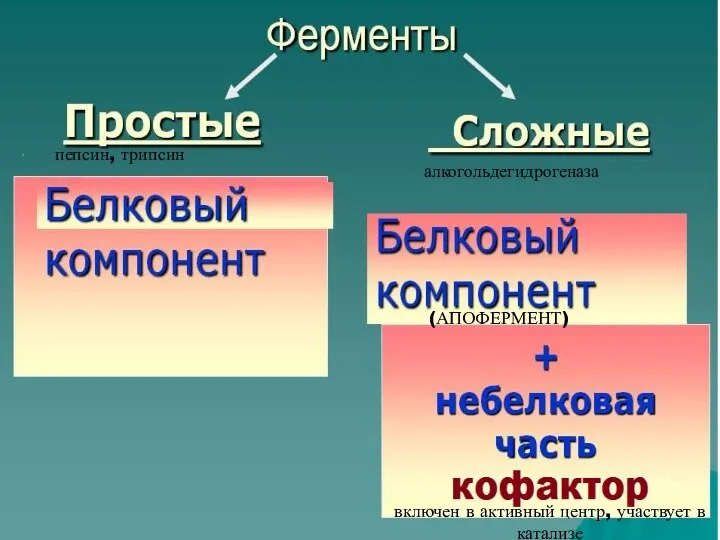
- 6. пепсин, трипсин алкогольдегидрогеназа (АПОФЕРМЕНТ) включен в активный центр, участвует в катализе
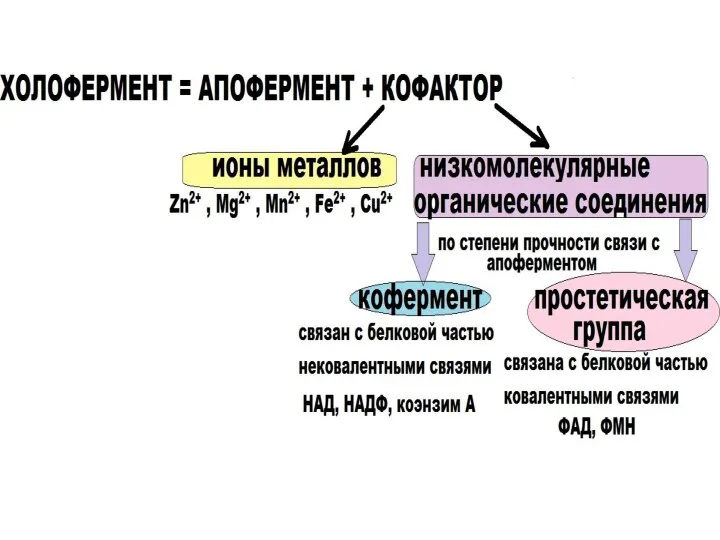
- 8. РОЛЬ АПОФЕРМЕНТА определяет специфичность фермента отвечает за выбор типа химического превращения субстрата РОЛЬ КОФАКТОРА : 1)
- 9. Структура ферментов Ферменты,как белки, могут быть простыми и сложными. Сложные ферменты помимо белковой части (апофермента) содержат
- 10. ОБЩИЕ СВОЙСТВА ферментов и неорганических катализаторов: не расходуются в ходе химических реакций катализируют энергетически возможные реакции
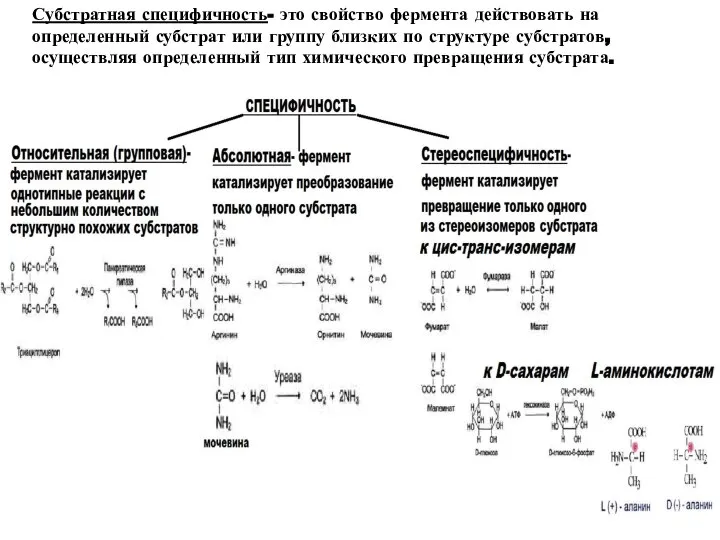
- 11. Субстратная специфичность- это свойство фермента действовать на определенный субстрат или группу близких по структуре субстратов, осуществляя
- 12. Enzyme kinetics. “lock-and-Key” theory. Эмиль Фишер Механизм действия ферментов. Теория ключа и замка
- 13. Механизм действия ферментов. Теория индуцированного соответствия Даниэл Кошланд
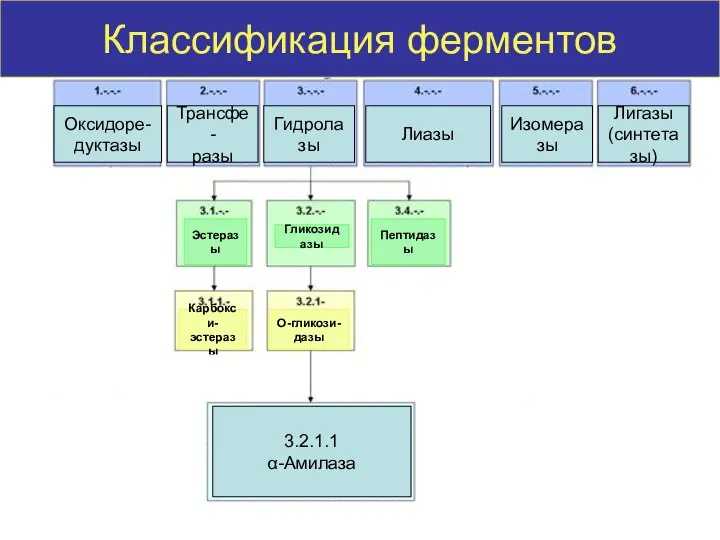
- 14. Классификация ферментов Оксидоре- дуктазы Трансфе- разы Гидролазы Лиазы Изомеразы Лигазы (синтетазы) Эстеразы Гликозидазы Пептидазы Карбокси- эстеразы
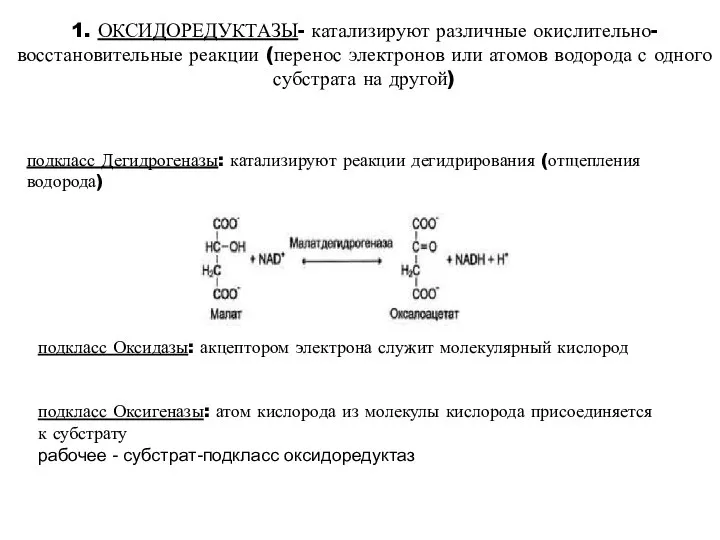
- 15. 1. ОКСИДОРЕДУКТАЗЫ- катализируют различные окислительно-восстановительные реакции (перенос электронов или атомов водорода с одного субстрата на другой)
- 16. 2. ТРАНСФЕРАЗЫ- катализируют реакции переноса функциональных групп от одного соединения к другому Подразделяют в зависимости от
- 17. 3. ГИДРОЛАЗЫ- катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). В
- 18. 4. ЛИАЗЫ- катализируют отщепление от субстратов негидролитическим путём определённую группу (при этом могут отщепляться СО2, Н2О,
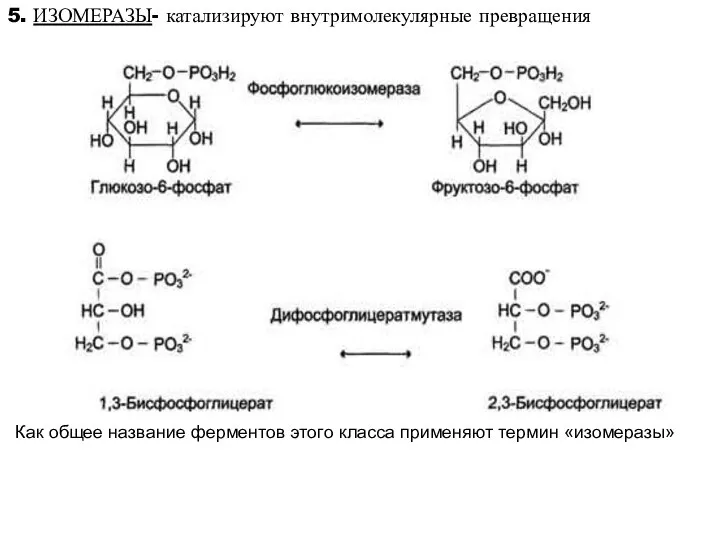
- 19. 5. ИЗОМЕРАЗЫ- катализируют внутримолекулярные превращения Как общее название ферментов этого класса применяют термин «изомеразы»
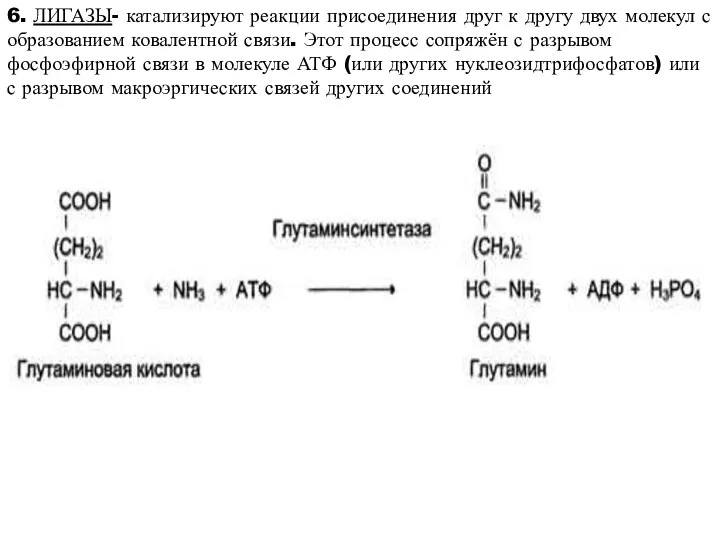
- 20. 6. ЛИГАЗЫ- катализируют реакции присоединения друг к другу двух молекул с образованием ковалентной связи. Этот процесс
- 21. 1. Рутинная (напр. птиалин) 2. Тривиальная (напр. амилаза) 3. Рациональная (напр. 1,4-альфа-D- глюканогидролаза) 4. Номерная (напр.
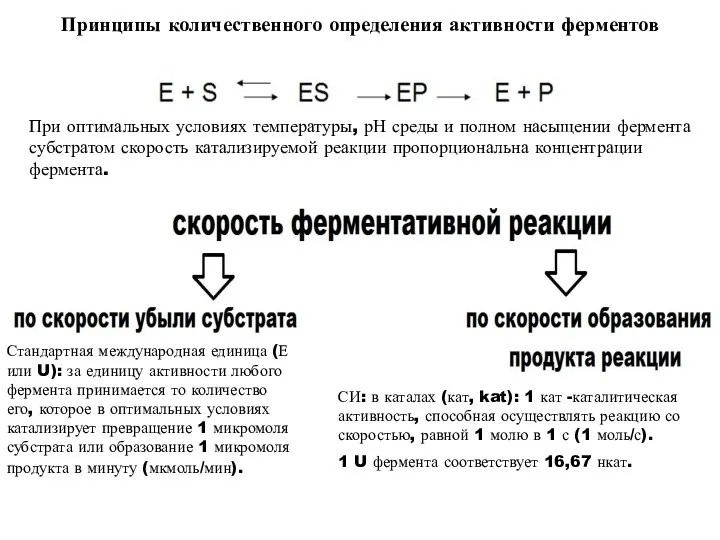
- 22. Принципы количественного определения активности ферментов При оптимальных условиях температуры, рН среды и полном насыщении фермента субстратом
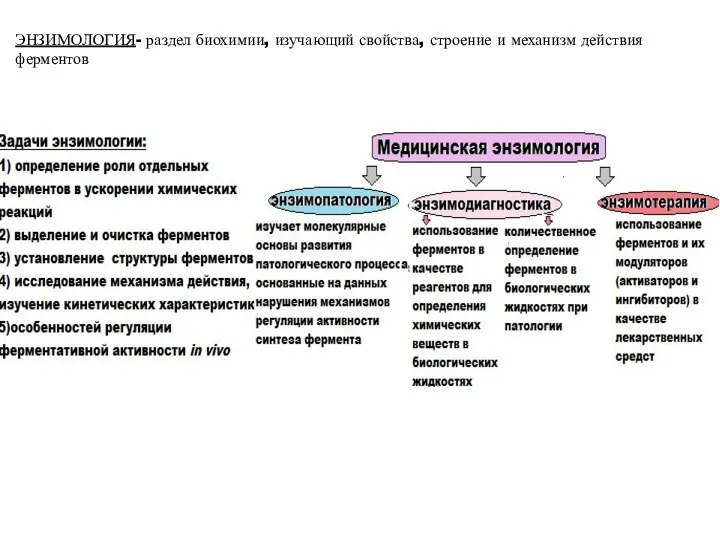
- 23. ЭНЗИМОЛОГИЯ- раздел биохимии, изучающий свойства, строение и механизм действия ферментов
- 26. Скачать презентацию










 Язык программирования Python
Язык программирования Python Дессиминатор образовательной сферы
Дессиминатор образовательной сферы Программирование на языках высокого уровня. Apache Maven
Программирование на языках высокого уровня. Apache Maven Дидактика как раздел педагогического знания
Дидактика как раздел педагогического знания Проблема человека и его сознания в философии и науке
Проблема человека и его сознания в философии и науке Знакомство с БПЛА. История развития, области применения
Знакомство с БПЛА. История развития, области применения Преступность современной молодежи
Преступность современной молодежи Презентацию выполнила Музыкальный руководитель ГДОУ №7 Пушкинского района СПб Медведчикова Адель Михайловна По книг
Презентацию выполнила Музыкальный руководитель ГДОУ №7 Пушкинского района СПб Медведчикова Адель Михайловна По книг Национальности мира. Русские (Россия)
Национальности мира. Русские (Россия) Полипредикативные конструкции
Полипредикативные конструкции  Организация работы с подрядчиками с целью уменьшения травматизма на объектах строительной компании АО «ЮИТ ДОН»
Организация работы с подрядчиками с целью уменьшения травматизма на объектах строительной компании АО «ЮИТ ДОН» Федеральные государственные требования к структуре основной общеобразовательной программы дошкольного образования (утвержден
Федеральные государственные требования к структуре основной общеобразовательной программы дошкольного образования (утвержден Презентация "Банк Финансы и кредит" - скачать презентации по Экономике
Презентация "Банк Финансы и кредит" - скачать презентации по Экономике Комиссия по трудовым спорам Выполнила: студентка 3-го курса ФТД группы Т-083 Восколович Юля
Комиссия по трудовым спорам Выполнила: студентка 3-го курса ФТД группы Т-083 Восколович Юля  Арома масла в спорте
Арома масла в спорте Основы цифровой обработки сигналов (DSP)
Основы цифровой обработки сигналов (DSP) Скульптура презентация_
Скульптура презентация_ Эйлеров граф (Эйлеров цикл, Эйлеров путь)
Эйлеров граф (Эйлеров цикл, Эйлеров путь) Реклама Развитие, задачи, виды
Реклама Развитие, задачи, виды Столовые приборы
Столовые приборы Алгебраическая дробь. Сокращение дробей.
Алгебраическая дробь. Сокращение дробей.  Виды подготовки спортсменов
Виды подготовки спортсменов Эквайринг
Эквайринг Клетка живого организма
Клетка живого организма  Презентация ГОСУДАРСТВО
Презентация ГОСУДАРСТВО Урок обобщения и систематизации знаний в 2 классе Тема: «Музыкальный портрет. В каждой инт
Урок обобщения и систематизации знаний в 2 классе Тема: «Музыкальный портрет. В каждой инт Схема подъема токоприеимника
Схема подъема токоприеимника Презентация на тему: «Институциональная школа»
Презентация на тему: «Институциональная школа»