Содержание
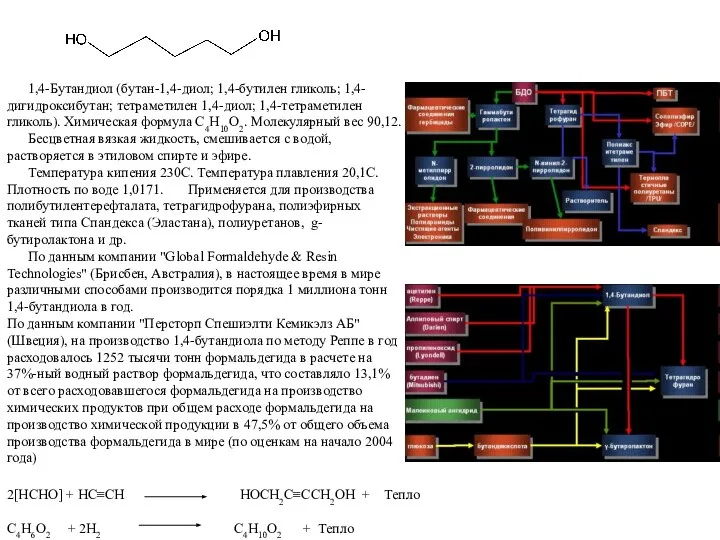
- 5. 1,4-Бутандиол (бутан-1,4-диол; 1,4-бутилен гликоль; 1,4-дигидроксибутан; тетраметилен 1,4-диол; 1,4-тетраметилен гликоль). Химическая формула C4H10O2. Молекулярный вес 90,12. Бесцветная
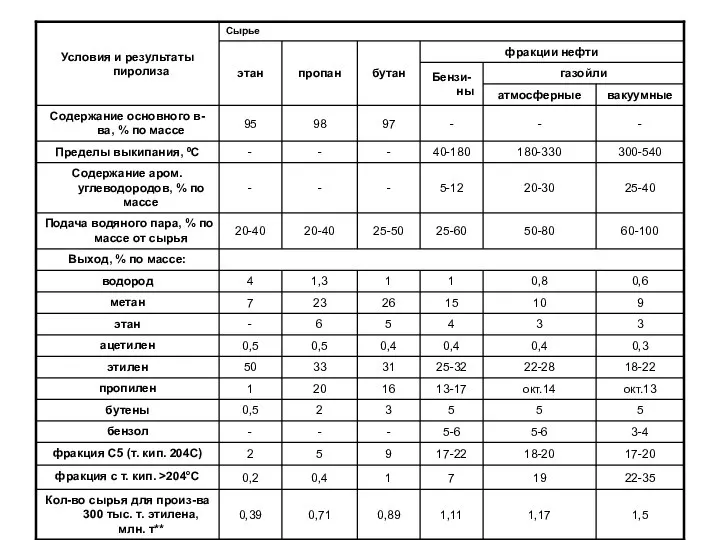
- 6. Для производства одного и того же количества олефинов печи крекинга газойля должны перерабатывать в пять раз
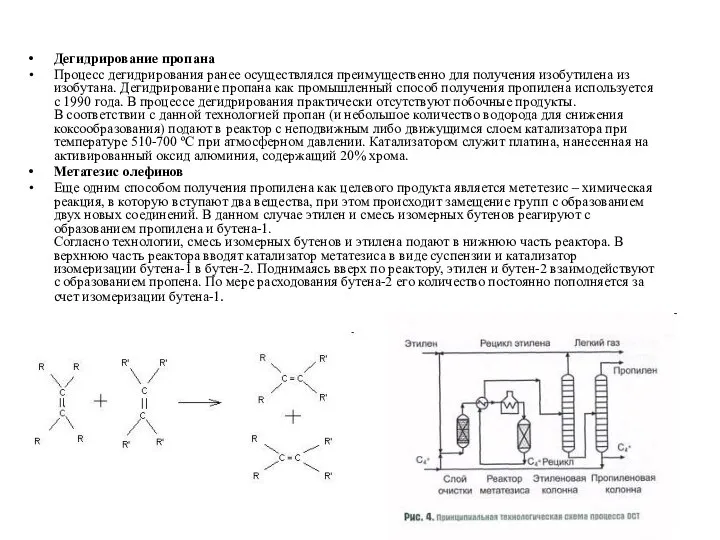
- 8. Дегидрирование пропана Процесс дегидрирования ранее осуществлялся преимущественно для получения изобутилена из изобутана. Дегидрирование пропана как промышленный
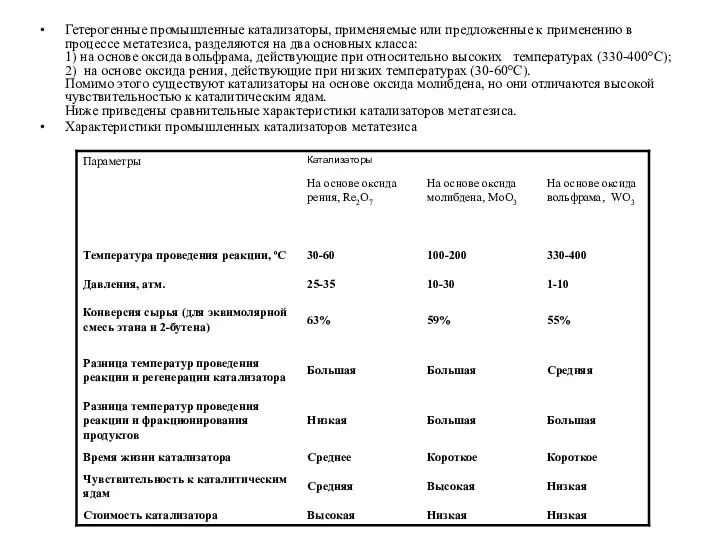
- 9. Гетерогенные промышленные катализаторы, применяемые или предложенные к применению в процессе метатезиса, разделяются на два основных класса:
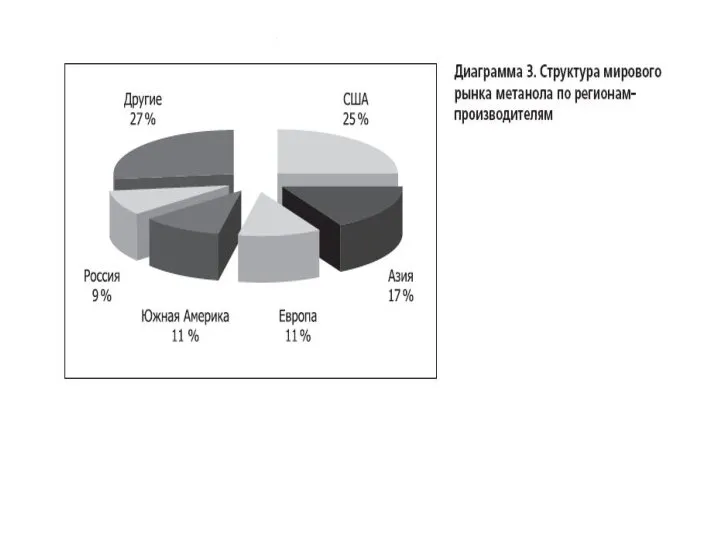
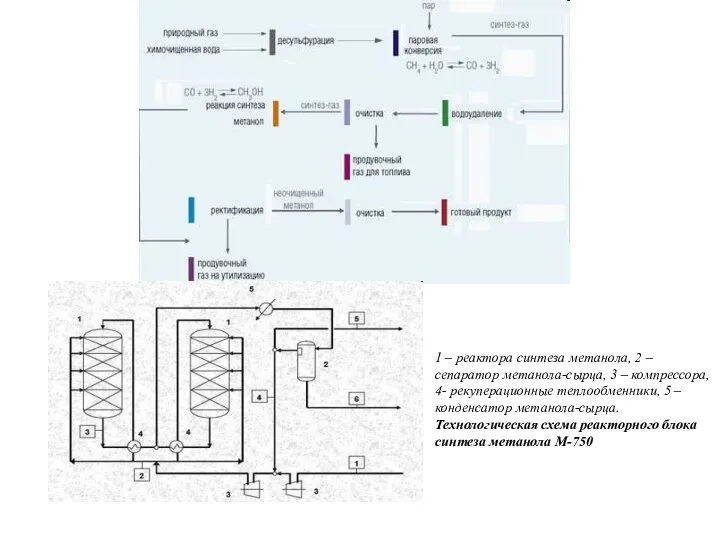
- 12. Получение метанола из синтез-газа в промышленности впервые было осуществлено в Германии в 1923 году. Тогда процесс
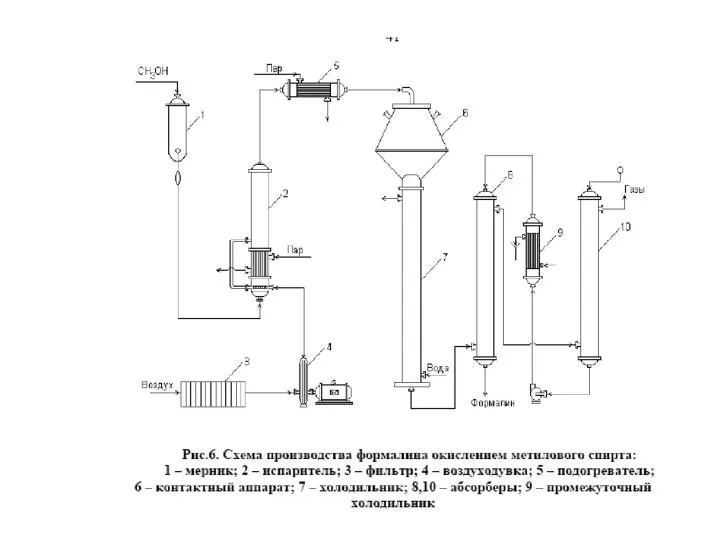
- 13. 1 – реактора синтеза метанола, 2 – сепаратор метанола-сырца, 3 – компрессора, 4- рекуперационные теплообменники, 5
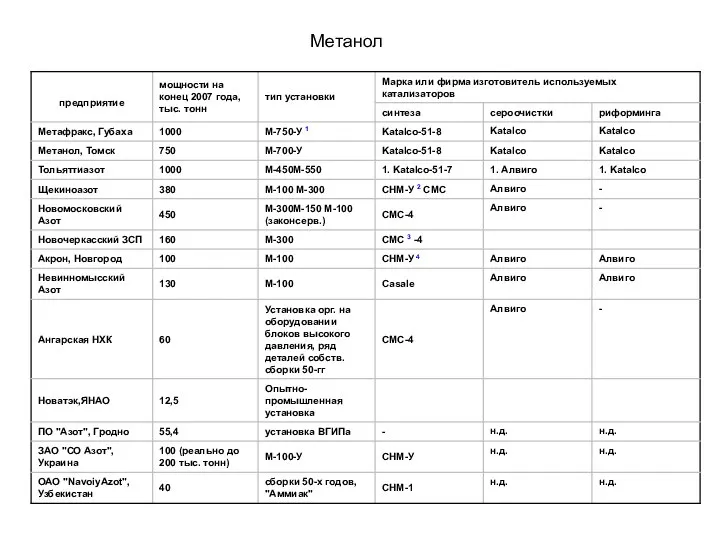
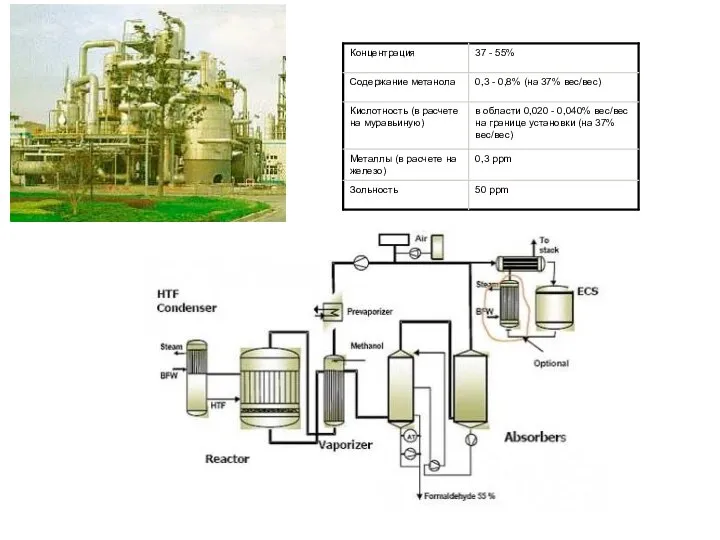
- 14. Краткая характеристика производств метанола России и стран СНГ 1 «У» - усовершенствованная 2 «СНМ» - Северодонецкий
- 23. Производство пентаэритрита в России и странах СНГ Впервые в Советском Союзе технология промышленного производства пентаэритрита была
- 24. "Формиатная" технология В настоящее время на территории СНГ находятся в эксплуатации три производства пентаэритрита, в том
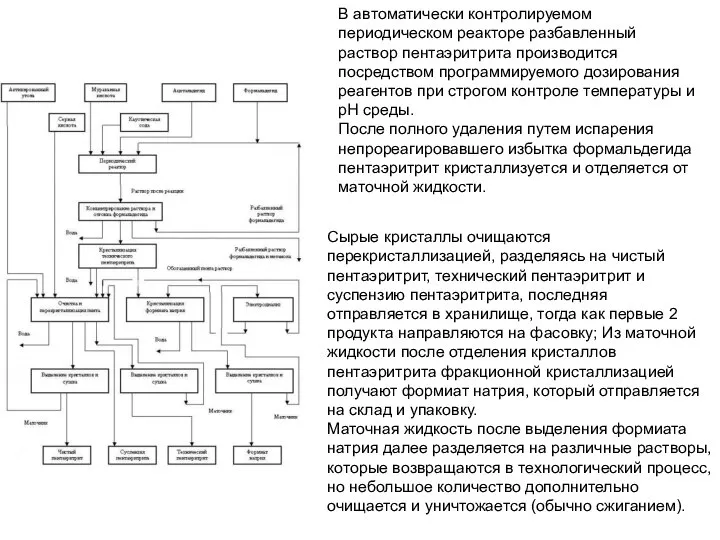
- 25. В автоматически контролируемом периодическом реакторе разбавленный раствор пентаэритрита производится посредством программируемого дозирования реагентов при строгом контроле
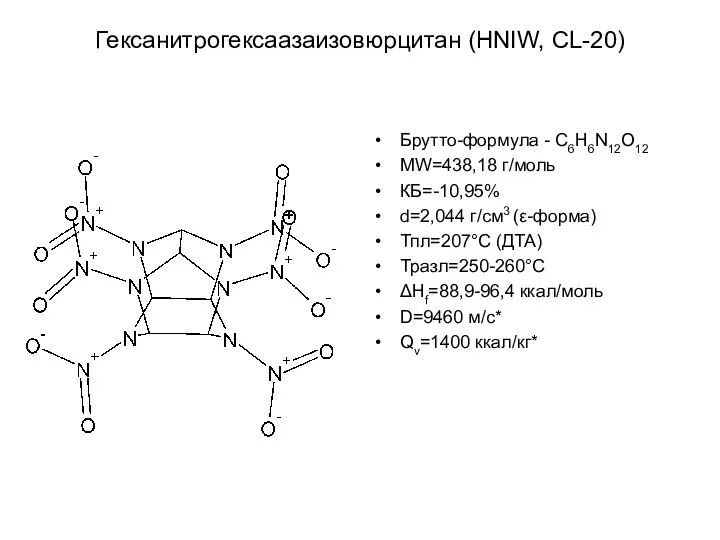
- 26. Гексанитрогексаазаизовюрцитан (HNIW, CL-20) Брутто-формула - С6Н6N12O12 MW=438,18 г/моль КБ=-10,95% d=2,044 г/см3 (ε-форма) Тпл=207°С (ДТА) Тразл=250-260°С ΔHf=88,9-96,4
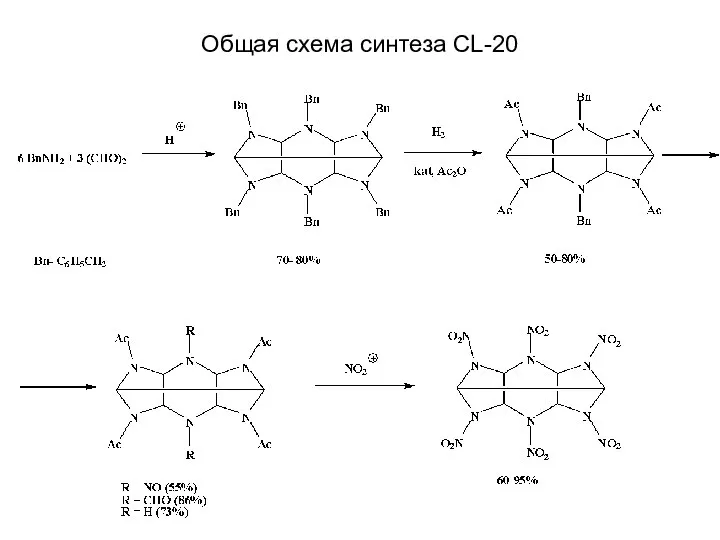
- 27. Общая схема синтеза CL-20
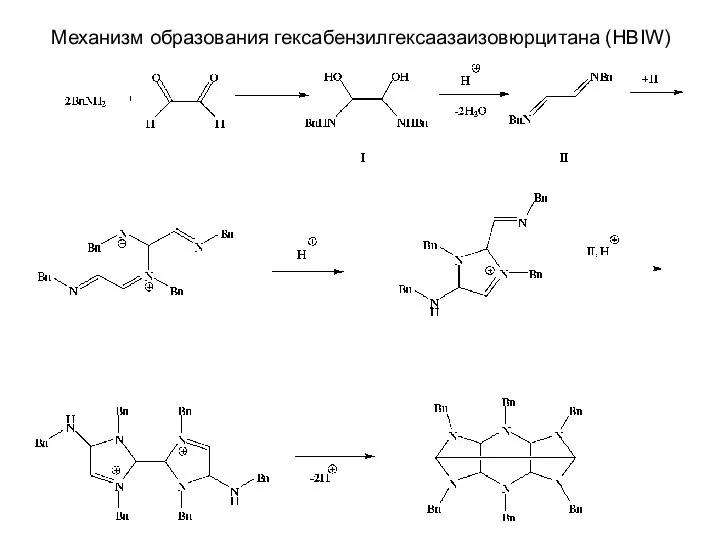
- 28. Механизм образования гексабензилгексаазаизовюрцитана (HBIW)
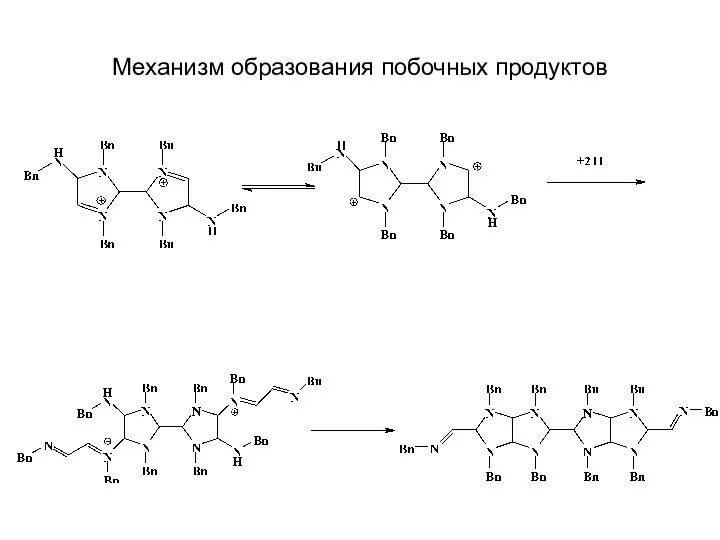
- 29. Механизм образования побочных продуктов
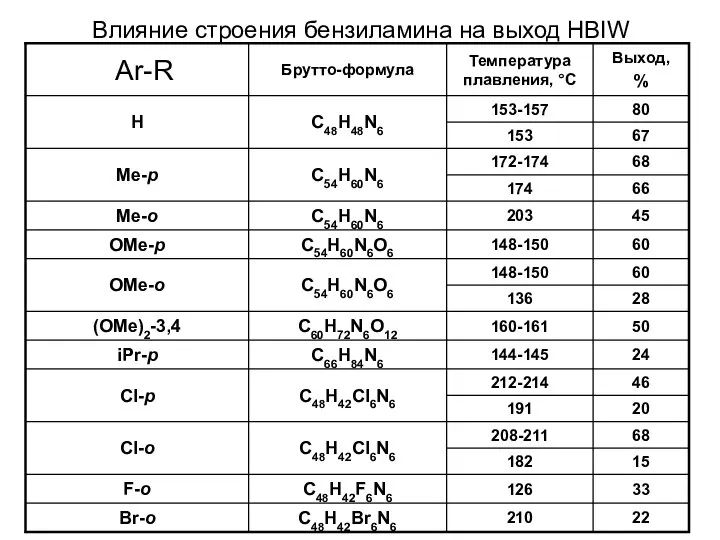
- 30. Влияние строения бензиламина на выход HBIW
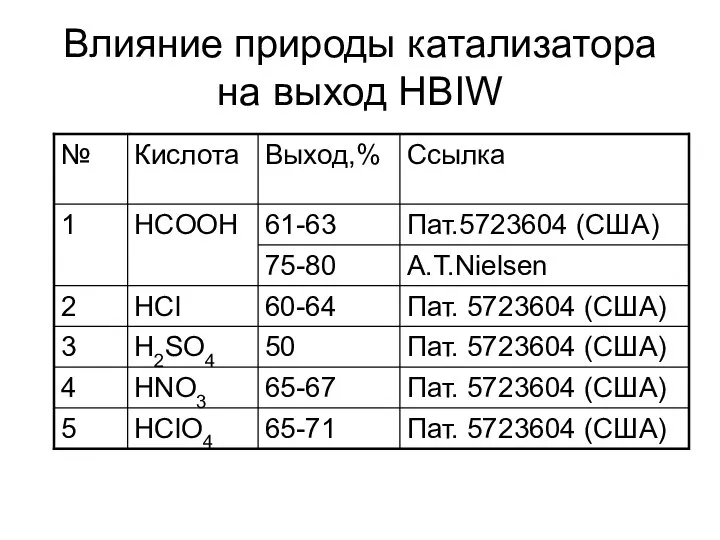
- 31. Влияние природы катализатора на выход HBIW
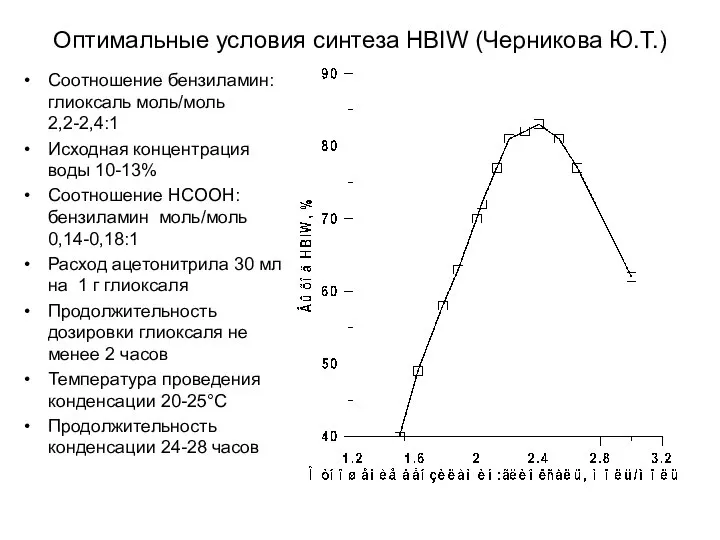
- 32. Оптимальные условия синтеза HBIW (Черникова Ю.Т.) Соотношение бензиламин:глиоксаль моль/моль 2,2-2,4:1 Исходная концентрация воды 10-13% Соотношение НСООН:бензиламин
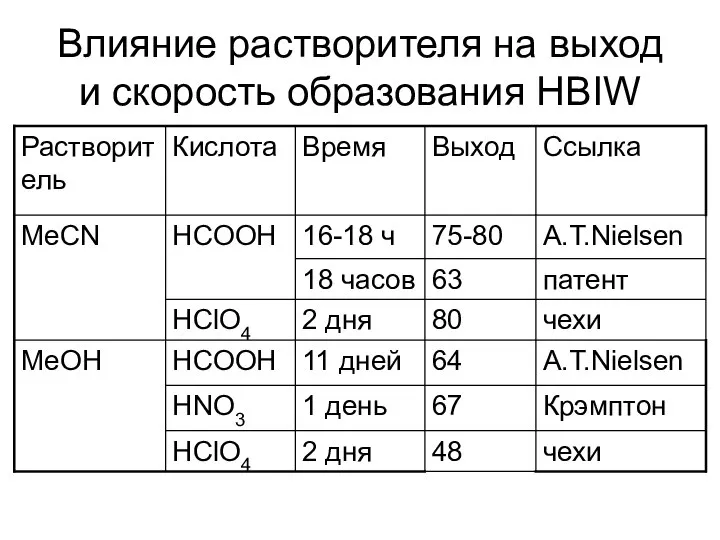
- 33. Влияние растворителя на выход и скорость образования HBIW
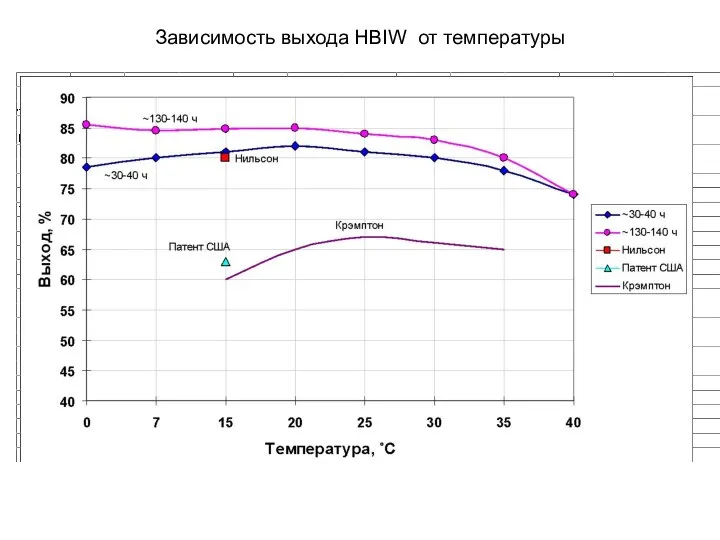
- 34. Зависимость выхода HBIW от температуры
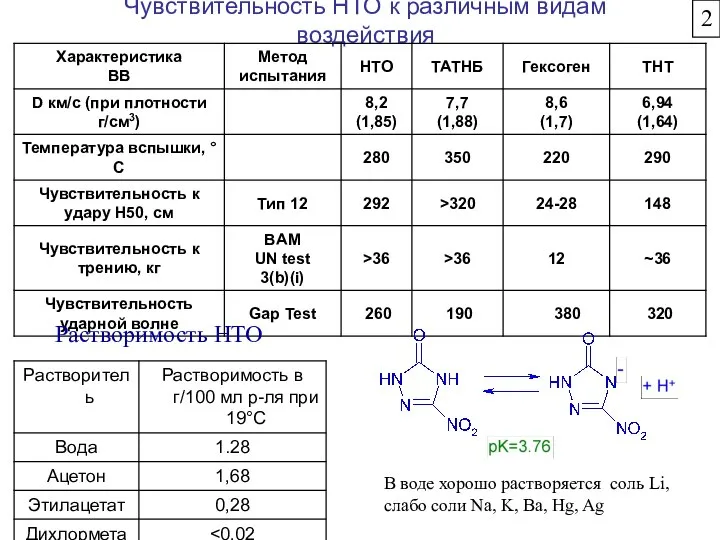
- 35. Основные свойства НТО 5-нитро-1.4-дигидро-3Н-1.2.4-триазол-3-он (НТО, оксинитротриазол, NTO, ONTA) - белое кристаллическое вещество с температурой плавления выше
- 36. Чувствительность НТО к различным видам воздействия Растворимость НТО В воде хорошо растворяется соль Li, слабо соли
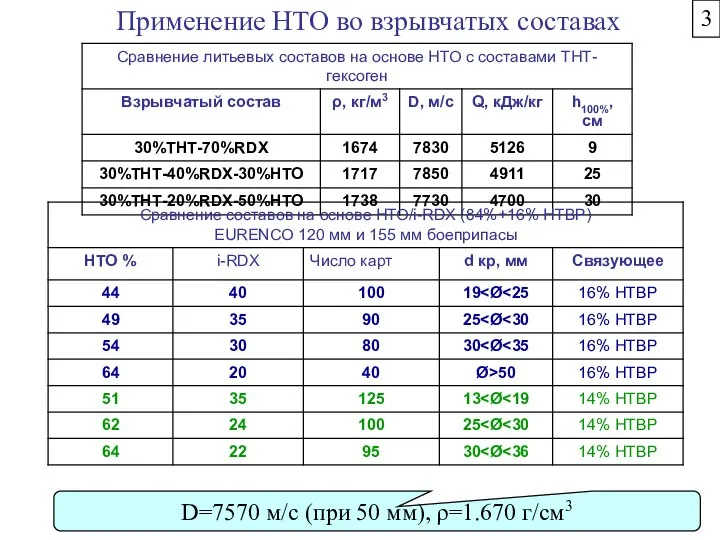
- 37. Применение НТО во взрывчатых составах D=7570 м/c (при 50 мм), ρ=1.670 г/см3 3
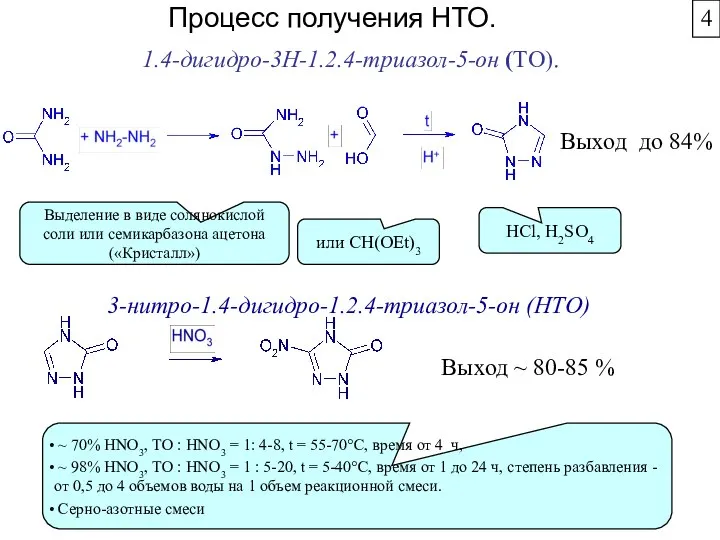
- 38. Процесс получения НТО. Выход до 84% Выход ~ 80-85 % 3-нитро-1.4-дигидро-1.2.4-триазол-5-он (НТО) 1.4-дигидро-3Н-1.2.4-триазол-5-он (ТО). HCl, H2SO4
- 40. Скачать презентацию









 наш адрес в мире - презентация для начальной школы
наш адрес в мире - презентация для начальной школы Лизинг ИМ корп.мен 5-1 Чистовой Анастасии
Лизинг ИМ корп.мен 5-1 Чистовой Анастасии Ядерный автомобильный двигатель
Ядерный автомобильный двигатель Либералы, консерваторы, социалисты: какими должно быть общество и государство
Либералы, консерваторы, социалисты: какими должно быть общество и государство ЧЕМ БОЛЕЛ ВЕЛИКИЙ ВАН ГОГ? La tristesse durera toujours («Печаль будет длиться вечно»)
ЧЕМ БОЛЕЛ ВЕЛИКИЙ ВАН ГОГ? La tristesse durera toujours («Печаль будет длиться вечно»)  Народные промыслы
Народные промыслы  Трансформатор – основний пристрій для перетворення електричної енергії
Трансформатор – основний пристрій для перетворення електричної енергії Воздухораспределитель 292 - 001 пассажирский
Воздухораспределитель 292 - 001 пассажирский Обработка исключений
Обработка исключений Культура Древней Руси
Культура Древней Руси Let’s learn Korean
Let’s learn Korean Тормозная система ВАЗ 2114
Тормозная система ВАЗ 2114 Губкин спортивный
Губкин спортивный Презентация "Поведение фирмы в условиях монополии" - скачать презентации по Экономике
Презентация "Поведение фирмы в условиях монополии" - скачать презентации по Экономике Презентация Культура России в 19 веке
Презентация Культура России в 19 веке  Кинематика вращательного движения
Кинематика вращательного движения Формирование государства на Руси. Русь Феодальная IX- начала XVII вв.
Формирование государства на Руси. Русь Феодальная IX- начала XVII вв. Machen sie sich mit neuen buchstaben und kombinationen vertraut
Machen sie sich mit neuen buchstaben und kombinationen vertraut Китай. Шаолинь (буддизм)
Китай. Шаолинь (буддизм) Самые необычные природные явления
Самые необычные природные явления Трансформация сопротивлений в линиях передачи
Трансформация сопротивлений в линиях передачи Теория сетевого планирования (пример)
Теория сетевого планирования (пример) Презентация "Томас Шон Коннери (Thomas Sean Connery)" - скачать презентации по МХК
Презентация "Томас Шон Коннери (Thomas Sean Connery)" - скачать презентации по МХК иерсинии
иерсинии Урок по предпринимательству
Урок по предпринимательству  Организация производства и продаж прибора для неинвазивного мониторинга содержания сахара в крови
Организация производства и продаж прибора для неинвазивного мониторинга содержания сахара в крови Франкфуртська школа
Франкфуртська школа Анализ архитектуры исторического и современного города
Анализ архитектуры исторического и современного города