Содержание
- 2. «О ферментах как и о людях судят по их поведению» Академик В.А.Энгельгарт Фермент (от лат. fermentatio
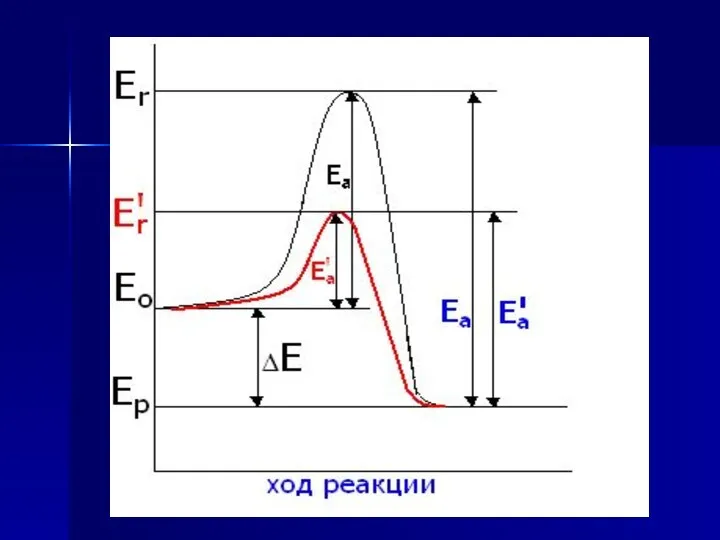
- 3. Скорость химической реакции зависит от концентрации реагентов от энергии активации
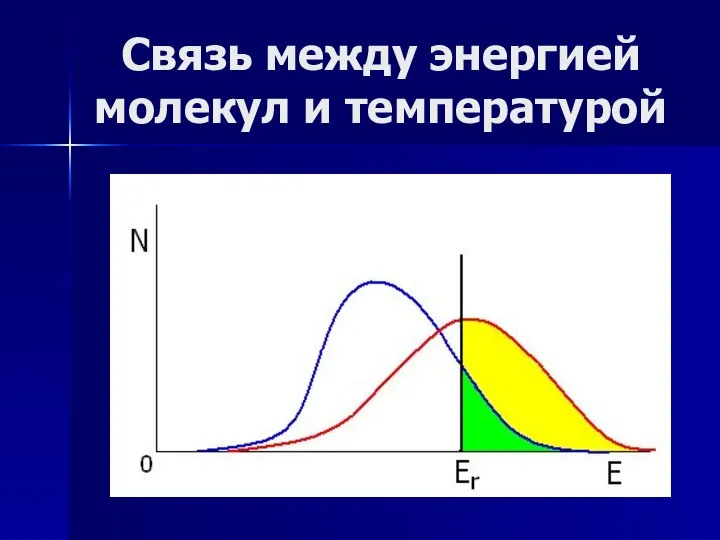
- 4. Связь между энергией молекул и температурой
- 6. Свойства катализаторов Катализатор не вызывает, а лишь УСКОРЯЕТ химическую реакцию Катализатор не влияет на величину энергетического
- 7. Свойства ферментов как биокатализаторов Высокая эффективность Специфичность действия Субстратная специфичность Зависимость от температуры Зависимость от рН
- 8. Эффективность биокатализа H2O2 H2O + O2 Спонтанно k = 10-6 c-1 Катализатор FeCl2 (k = 6x10-2
- 9. Специфичность действия ферментов Способность ферментов катализировать превращение субстрата в химической реакции определенного типа называется специфичностью действия.
- 10. Классификация ферментов 1 класс – Оксидоредуктазы 2 класс – Трансферазы 3 класс – Гидролазы 4 класс
- 11. Субстратная специфичность ферментов Относительная (групповая) субстратная специфичность – это способность фермента катализировать превращение похожих по строению
- 12. Активный центр фермента состоит из двух функционально различных участков: 1) Адсорбционный участок (центр) – для ориентированной
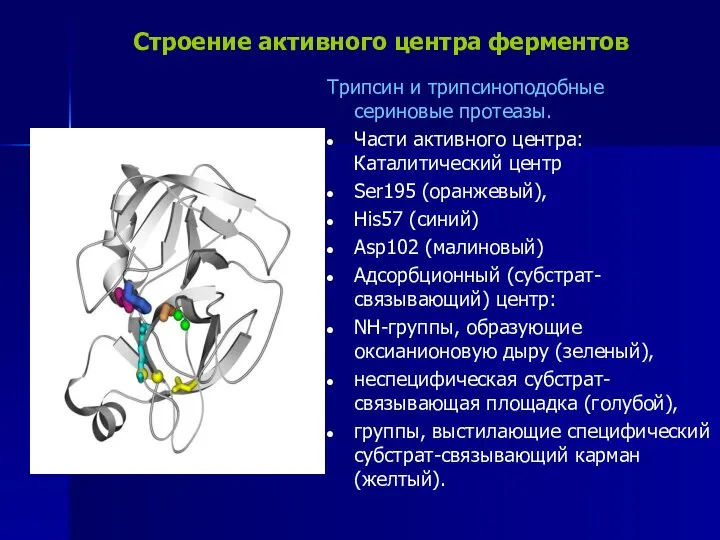
- 13. Строение активного центра ферментов Трипсин и трипсиноподобные сериновые протеазы. Части активного центра: Каталитический центр Ser195 (оранжевый),
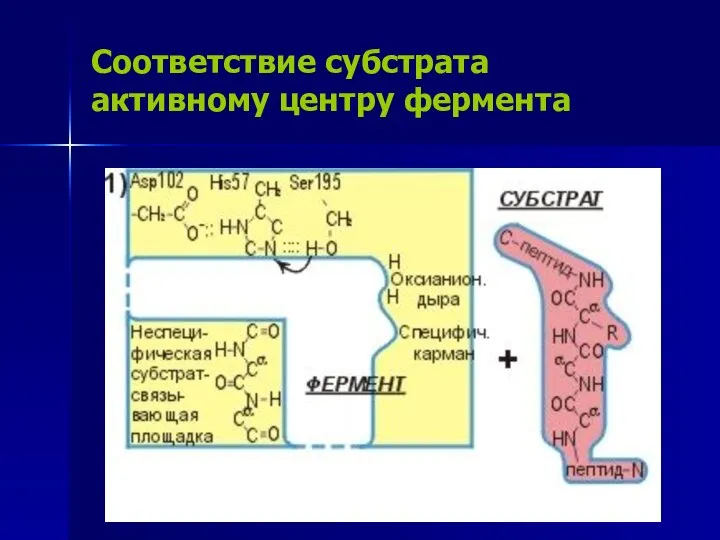
- 14. Соответствие субстрата активному центру фермента
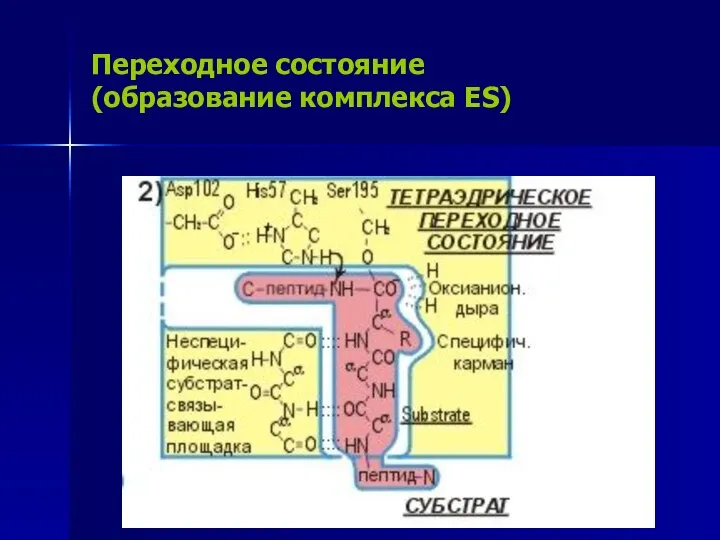
- 15. Переходное состояние (образование комплекса ES)
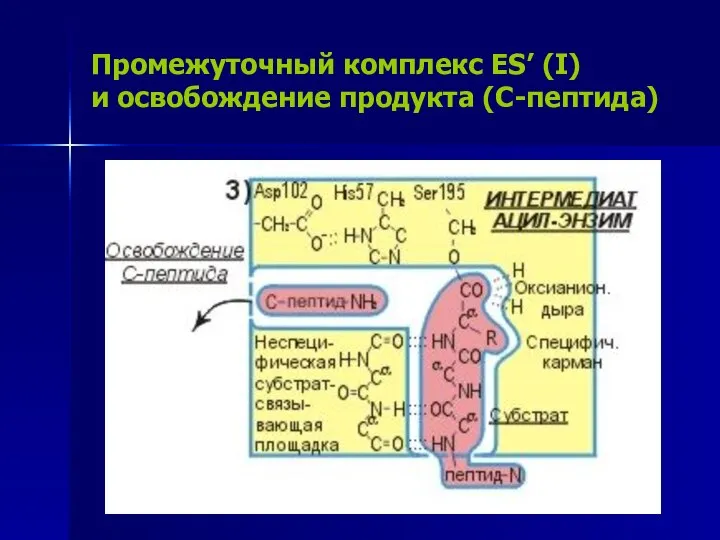
- 16. Промежуточный комплекс ES’ (I) и освобождение продукта (C-пептида)
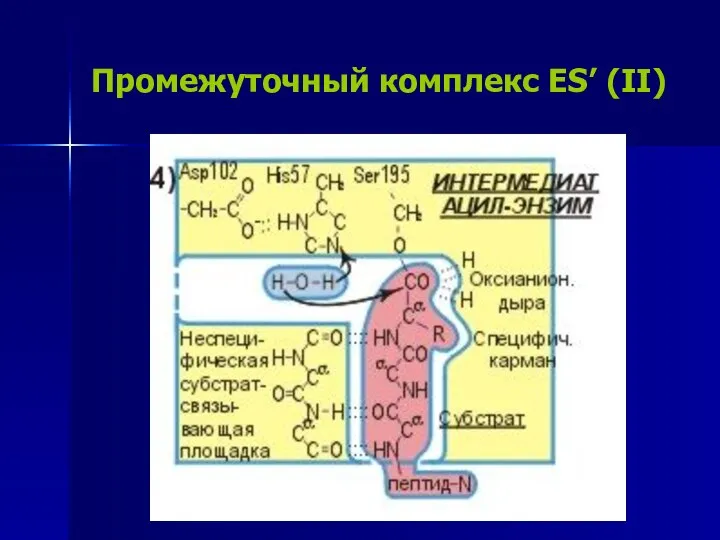
- 17. Промежуточный комплекс ES’ (II)
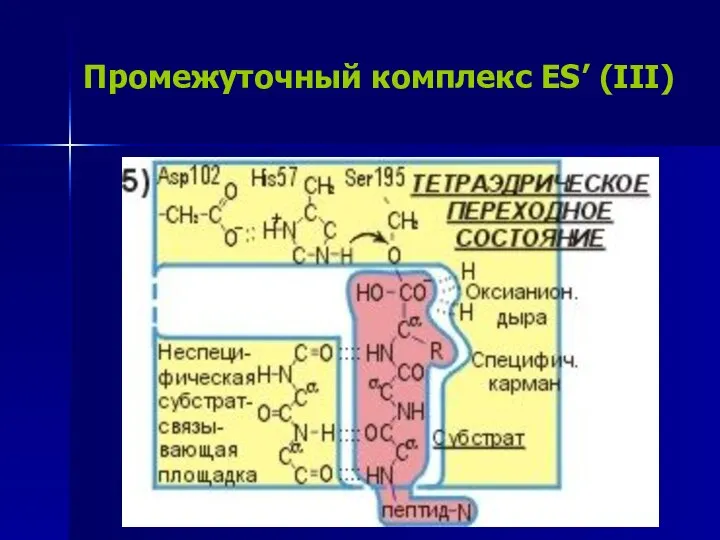
- 18. Промежуточный комплекс ES’ (III)
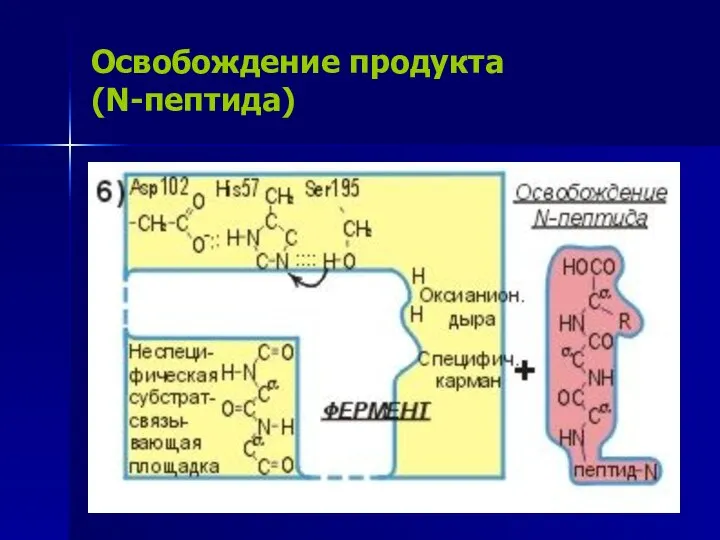
- 19. Освобождение продукта (N-пептида)
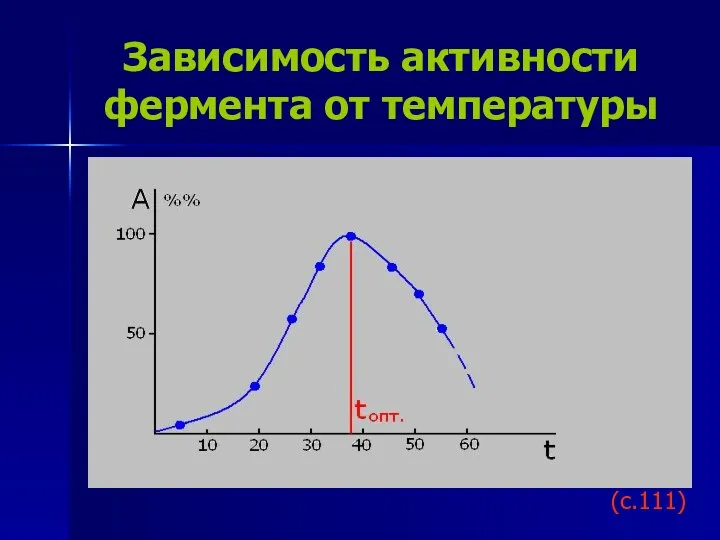
- 20. Зависимость активности фермента от температуры (с.111)
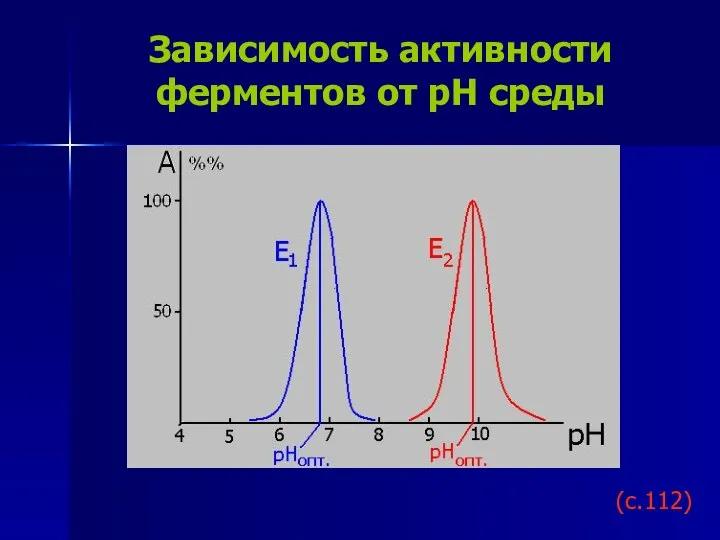
- 21. Зависимость активности ферментов от рН среды (с.112)
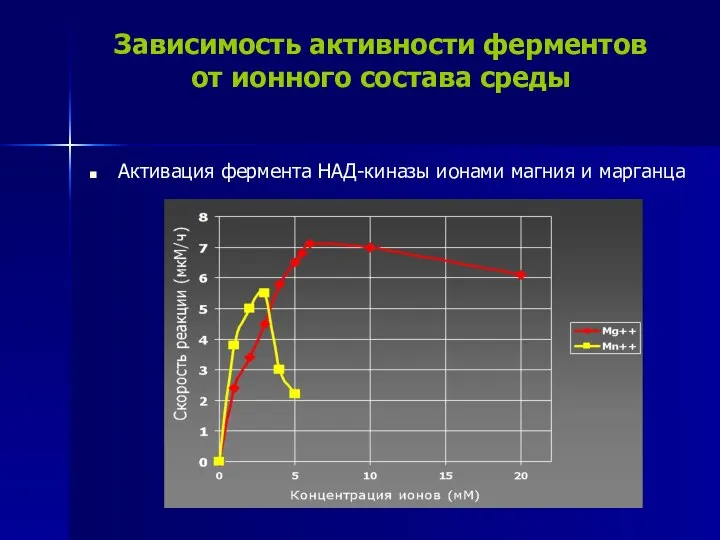
- 22. Зависимость активности ферментов от ионного состава среды Влияние растворенных в среде электролитов на активность ферментов –
- 23. Зависимость активности ферментов от ионного состава среды Активация фермента НАД-киназы ионами магния и марганца
- 24. Кофакторы ферментов Кофакторами ферментов принято называть неорганические ионы, необходимые для выполнения ферментами своей функции (например, ионы
- 25. Коферменты Низкомолекулярные небелковые органические соединения, необходимые для выполнения ферментами своих функций Коферменты участвуют в реакциях: переноса
- 26. Многие коферменты образуются из витаминов НАД и НАДФ – из витамина РР ТГФК – из фолиевой
- 27. Простетические группы Это небелковые органические соединения, прочно связанные с молекулой сложного белка. Некоторые простетические группы сложных
- 28. Активность ферментов Активностью фермента называют его способность превращать определенное количество субстрата в единицу времени Молекулярная активность
- 29. Способы выражения активности ферментов В системе СИ единица измерения активности (количества) фермента: 1 Катал=1моль*с-1 1 катал
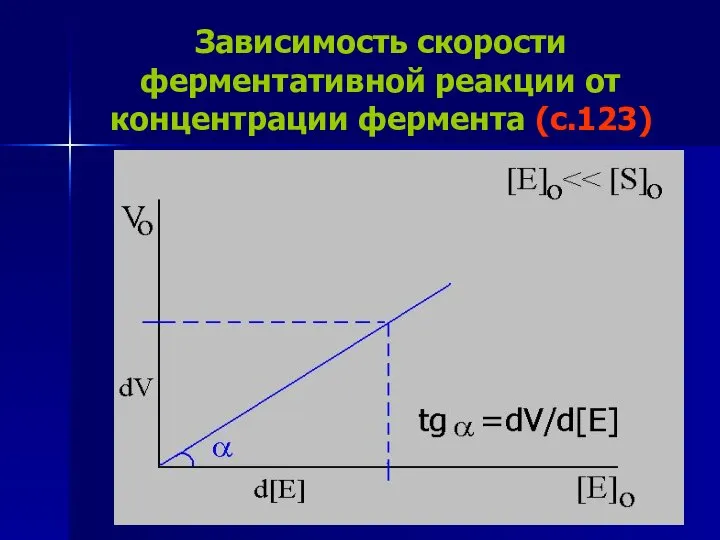
- 30. Зависимость скорости ферментативной реакции от концентрации фермента (с.123)
- 31. Причины изменения активности ферментов Изменение скорости синтеза фермента (ускорение или замедление) Ингибирование ферментов Активация ферментов -
- 32. Ингибирование ферментов Неспецифическое Специфическое 2.1. Специфическое необратимое 2.2. Специфическое обратимое 2.2.1. Конкурентное 2.2.2. Неконкурентное
- 33. Образование активных форм ферментов из неактивных Ограниченный протеолиз – гидролиз пептидной связи и переход зимогена в
- 34. ИЗОФЕРМЕНТЫ Изоферментами называют ферменты, катализирующие одну и ту же реакцию, но отличающиеся по физико-химическим свойствам (pI,
- 35. Примеры использования ферментов в медицине Обработка нагноившихся раневых поверхностей и полостей, заполненных гнойным содержимым (протеазы) Амилаза,
- 36. Примеры использования ферментов Производство сыра, вина, пива, уксуса, патоки, хлебопечение Изготовление моющих средств с биодобавками Обработка
- 37. Кинетика ферментативного катализа Этапы ферментативного катализа (с.121) k+1 k+2 E+S ES ES’ E+P k-1
- 38. Зависимость V от [S] (c.125)
- 40. Скачать презентацию























![Зависимость V от [S] (c.125)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1300657/slide-37.jpg)
 Образование СССР Подготовила: Порошина Л.В., студентка группы Ю-102
Образование СССР Подготовила: Порошина Л.В., студентка группы Ю-102 Скоростемер 3СЛ-2м. Функции скоростемера 3СЛ-2м
Скоростемер 3СЛ-2м. Функции скоростемера 3СЛ-2м Комплексный подход к обучению детей со сложной структурой дефекта Подготовлена зам. директора по УВР Пузаткиной Н.В.
Комплексный подход к обучению детей со сложной структурой дефекта Подготовлена зам. директора по УВР Пузаткиной Н.В. Портрет. Изучение нового материала
Портрет. Изучение нового материала Устройство трансформатора
Устройство трансформатора Презентация Изменение сроков уплаты в соответствии с налоговым законодательством
Презентация Изменение сроков уплаты в соответствии с налоговым законодательством  Успех каждого ребенка
Успех каждого ребенка Презентация по МХК Искусство Древней Греции Афинский Акрополь
Презентация по МХК Искусство Древней Греции Афинский Акрополь  Т Е М А «ОБЩИЕ ПОЛОЖЕНИЯ ОБ АРЕНДЕ»
Т Е М А «ОБЩИЕ ПОЛОЖЕНИЯ ОБ АРЕНДЕ» М.V. Cargo. Zhengbang ukraine
М.V. Cargo. Zhengbang ukraine Фестиваль активного отдыха «Напролом»
Фестиваль активного отдыха «Напролом» Антифизика в супергеройских фильмах
Антифизика в супергеройских фильмах Муниципальный округ Коломяги
Муниципальный округ Коломяги Ферменты-5
Ферменты-5 Основы избирательного права
Основы избирательного права Безопасность и надежность
Безопасность и надежность материнство
материнство Thanksgiving day. День благодарения
Thanksgiving day. День благодарения Техника использования знаний
Техника использования знаний  "Cud krwi" św. Januarego
"Cud krwi" św. Januarego Зародження великого тенісу
Зародження великого тенісу Основные стадии уголовного процесса
Основные стадии уголовного процесса  Lab view run time installation
Lab view run time installation Финансовая среда предпринимательства и предпринимательские риски
Финансовая среда предпринимательства и предпринимательские риски Блиц-опрос на тему «Маркетинговые исследования»
Блиц-опрос на тему «Маркетинговые исследования» Философия бытия
Философия бытия Технологии регистрации заряженных частиц, сбор и анализ данных детекторов в ФВЭ. VMM. (Лекция 5)
Технологии регистрации заряженных частиц, сбор и анализ данных детекторов в ФВЭ. VMM. (Лекция 5) Презентация "Доходный подход к оценке недвижимости" - скачать презентации по Экономике
Презентация "Доходный подход к оценке недвижимости" - скачать презентации по Экономике