Содержание
- 2. Раствор заряжается положительно. Металл заряжается отрицательно. Ппластина металла притягивает из раствора положительно заряженные ионы металла и
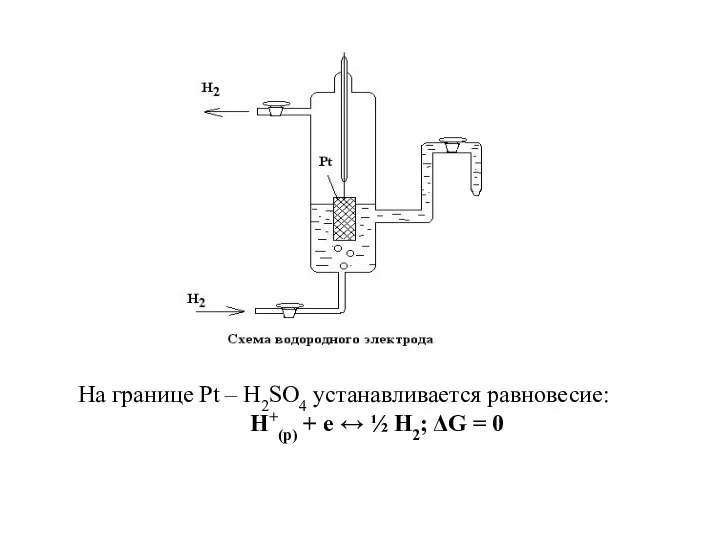
- 3. На границе Рt – Н2SО4 устанавливается равновесие: Н+(р) + е ↔ ½ Н2; ΔG = 0
- 4. Величина потенциала водородного электрода зависит от давления и рН среды. ЕН+/Н = -0,0295 lg рН2 –
- 5. Н2,Рt│Н+║Меn+│Ме аН+=1 Токообразующая реакция: Меn+ + 1/2 Н2 ↔ Ме + nН+
- 6. Электродный потенциал рассчитывается: Условия: Т≠250С, СМеn+≠1 моль/л: 2) Условия: Т=250С, СМеn+ ≠ 1 моль/л: 3) Условия:
- 7. Выводы из электро-химического ряда напряжений металла 1) Чем левее в ряду стоит металл, тем он активнее,
- 8. Устройства, которые превращают химическую энергию ОВР в электрическую называются гальваническим элементом. Е0Zn2+/Zn Цинк-анод, медь-катод А(-) Zn0
- 9. При работе этого элемента протекают процессы: Реакция окисления. Процессы окисления в электрохимии называются анодными, а электроды,
- 10. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента называется электродвижущей силой (ЭДС)
- 11. Равновесные потенциалы электродов могут быть определены в условиях отсутствия в цепи тока. При прохождении электрического тока
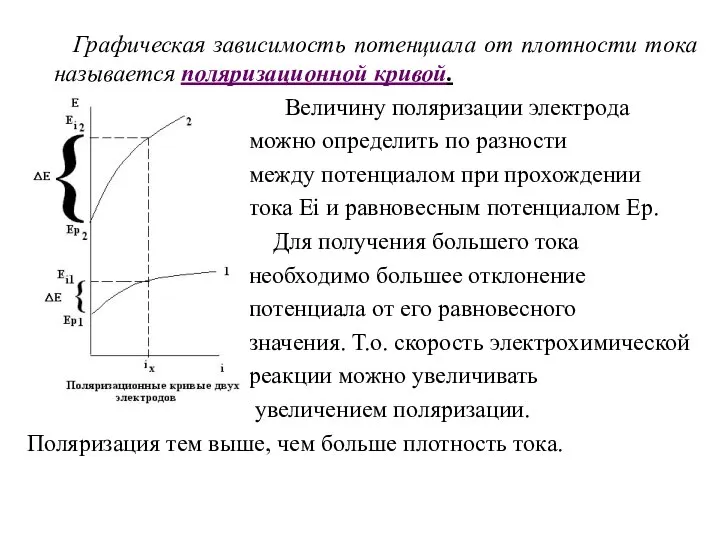
- 12. Графическая зависимость потенциала от плотности тока называется поляризационной кривой. Величину поляризации электрода можно определить по разности
- 13. Электрохимические реакции протекают в три стадии: а) подвод реагентов к электроду; б) электрохимическая реакция; в) отвод
- 14. Изменение потенциала, обусловленное замедленностью электрохимической стадии называется электрохимической поляризацией или перенапряжением. Скорость электрохимической реакции увеличивается с
- 15. а и b определяют из графиков зависимости поляризации от логарифма плотности тока. Снижается перенапряжение применением электродов–катализаторов,
- 16. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ Гальванический первичный элемент - устройство для прямого преобразования химической энергии заключенных
- 17. Пример гальванического элемента Сухой марганцево-цинкового элемент: (+) MnО2, С│ NН4С1│Zn (+). На аноде: анодное окисление цинка
- 18. Топливные элементы Топливный элемент - окислитель и восстановитель хранятся вне элемента и в процессе работы подаются
- 19. Свойства топливных элементов Топливные элементы имеют ЭДС=1,0 – 1,5 В. Напряжение меньше ЭДС. Снижение поляризации топливного
- 20. Аккумуляторы Аккумуляторы - устройства, в которых электрическая энергия превращается в химическую, а химическая – снова в
- 21. Схема работы свинцового аккумулятора: На аноде: На катоде: Суммарная реакция: Достоинства: высокий КПД, высокую ЭДС и
- 23. Скачать презентацию


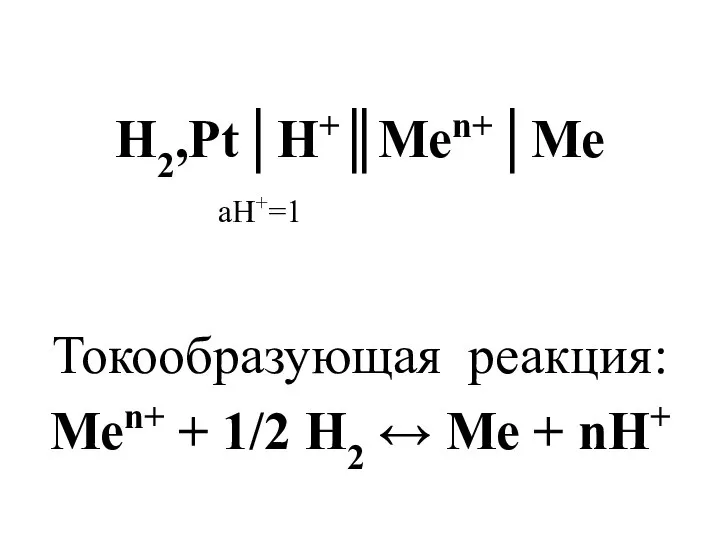















 «Проектирование образовательной программы дошкольной организации в условиях внедрения «Проектирование образовательной прогр
«Проектирование образовательной программы дошкольной организации в условиях внедрения «Проектирование образовательной прогр Замена электродвигателей СТД 8000 на электродвигатели марки Нидек на ЛПДС Чепурского АК Транснефть
Замена электродвигателей СТД 8000 на электродвигатели марки Нидек на ЛПДС Чепурского АК Транснефть Презентация Платон Обоснование идеализма
Презентация Платон Обоснование идеализма Транзисторы и их применение
Транзисторы и их применение How It Works - the global leader in innovative lifting solutions
How It Works - the global leader in innovative lifting solutions Инфографика SWOT(продолжение)
Инфографика SWOT(продолжение) Уменьшение шума
Уменьшение шума Военизированная спортивно-экстремальная игра «Зарница»
Военизированная спортивно-экстремальная игра «Зарница» Презентация Культурные ценности, нормы, традиции и инновации
Презентация Культурные ценности, нормы, традиции и инновации  Партии, партийные системы, избирательные системы
Партии, партийные системы, избирательные системы Городские соревнования по фрироупу
Городские соревнования по фрироупу Охрана западной границы России регулярными войсками Выполнила студентка 2-го курса группы Э101 Овсянникова Надежда
Охрана западной границы России регулярными войсками Выполнила студентка 2-го курса группы Э101 Овсянникова Надежда "Золотой век" русской культуры
"Золотой век" русской культуры Классификация уровней менеджеров. Функции, выполняемые менеджерами
Классификация уровней менеджеров. Функции, выполняемые менеджерами Динамический метод
Динамический метод Качество и точность импульсных САУ
Качество и точность импульсных САУ МОДЕЛИРОВАНИЕ ИНФОРМАЦИОННЫХ СИСТЕМ
МОДЕЛИРОВАНИЕ ИНФОРМАЦИОННЫХ СИСТЕМ Волейбол. Правила игры
Волейбол. Правила игры Презентация Обеспечение финансовой безопасности в РФ
Презентация Обеспечение финансовой безопасности в РФ Язык HTML
Язык HTML Конституция в иерархии нормативно-правовых актов
Конституция в иерархии нормативно-правовых актов Предварительный проект освещения лыжной трассы в парке г. Оса
Предварительный проект освещения лыжной трассы в парке г. Оса Презентация "Людвиг ван Бетховен соната №14 «Лунная»" - скачать презентации по МХК
Презентация "Людвиг ван Бетховен соната №14 «Лунная»" - скачать презентации по МХК Отношение между означающим и означаемым. Аналитические и синтетические формы
Отношение между означающим и означаемым. Аналитические и синтетические формы Презентация Понятие и классификация оборотных средств, источники формирования
Презентация Понятие и классификация оборотных средств, источники формирования Касты
Касты Поняття та історія розвитку технології програмування на основі Microsoft Solutions Framework. (Лекція 1)
Поняття та історія розвитку технології програмування на основі Microsoft Solutions Framework. (Лекція 1) Управление качеством проекта. Лекция 8
Управление качеством проекта. Лекция 8