Содержание
- 2. При изучении формирования химического состава природных вод необходимо рассматривать три составные части этого глобального явления: 1)
- 3. 2) факторы формирования химического состава природных вод – условия, способствующие или противостоящие протеканию процессов и водной
- 4. Особенности взаимодействия в системе вода –порода Взаимодействие подземных вод с горными породами имеет весьма сложный многоступенчатый
- 5. физические процессы, происходящие на границе раздела твердой и жидкой фаз Интенсивность определяется гл. образом величиной поверхностной
- 6. Растворение – кристаллизация При взаимодействии твердого вещества с водой наблюдаются два одновременно протекающих процесса: переход ионов
- 7. Конгруэнтное растворение Важнейший тип химического взаимодействия воды н горной породы — процесс конгруэнтного (согласованного, гармоничного) растворения,
- 8. Д. И. Менделеев (1887) показал, что при растворении получаются близкие к химическим соединениям системы, состоящие из
- 9. В основе равновесия между твердым веществом и раствором лежит закон равновесия Гиббса, согласно которому равновесие наступает,
- 10. В неравновесной системе компонент из фазы, в которой его химический потенциал больше, будет самопроизвольно переходить в
- 11. Некоторые минералы медленно растворяются в воде в естественных условиях; к их числу относятся прежде всего кальцит
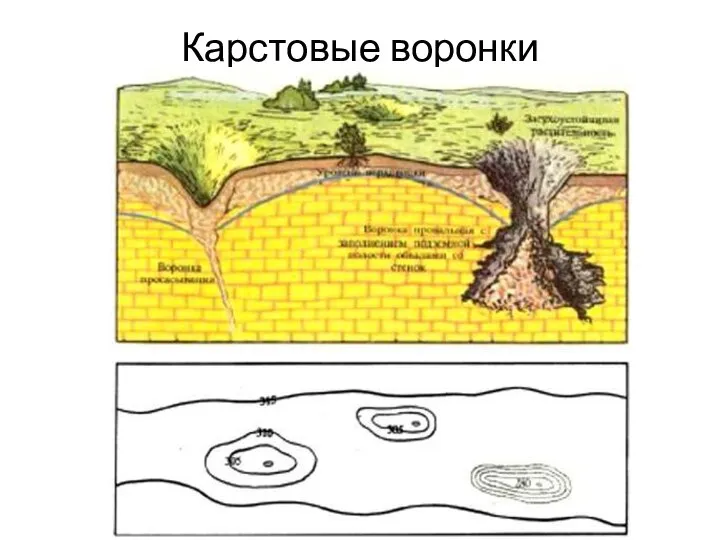
- 12. Карстовые воронки
- 13. Карстовая воронка Балаа (Ливан)
- 14. Глубина 250 м. Возраст 150000 лет.
- 15. выщелачивание Химическое растворение отличается от выщелачивания кинетически. При растворении взаимодействие с растворяемым веществом, например в забоях
- 16. фториды виллиомит NaF и криолит Na3AlF6 довольно быстро полностью или частично выщелачиваются дождями и талыми водами
- 17. Отпечатки полностью растворённого пластинчатого кальцита ("папир-шпата") на находившихся с ним в срастании кристаллах кварца и датолита.
- 18. Кристаллизация Процесс, в результате которого растворенное вещество переходит из жидкой фазы в структуру минерала. Состоит из
- 19. В насыщенном равновесном растворе кристаллизация прекращается. Кристаллизация минеральных веществ из подземных вод имеет огромное геологическое значение,
- 20. Многие водорастворимые минералы (в основном хлориды, сульфаты, карбонаты), осаждаются из воды соляных озер и лагун
- 21. Мертвое море
- 22. Эти же минералы, а также нитраты образуют на суше, в районах с аридным климатом, различные эфемерные
- 23. Влияние других солей: а) одноименные ионы снижают растворимость; б) изменение растворимости в растворах: Повышается растворимость гипса
- 24. Влияние газового состава: Это уже не простое растворение, а реакции: с СО2 – переход в р-р
- 25. Гидролиз (инконгруэнтное растворение) более сложно, чем конгруэнтное растворение, протекает процесс инконгруэнтного растворения широко распространенных в природе
- 26. Обладая электростатическим зарядом, ионы гидроксила, и, особенно водорода, активно взаимодействуют с поверхностными зонами частиц горных пород.
- 27. Атомы металлов, вследствие разности химических потенциалов в жидкой и твердой фазах переходят с поверхности кристаллической решетки
- 28. Образуются обогащенные Al вторичные минералы. 4Na AlSi3O8 (альбит) + 22H2O ––––> Al4Si4O10(OH)8 (каолинит)+4Na+ + 4OH -
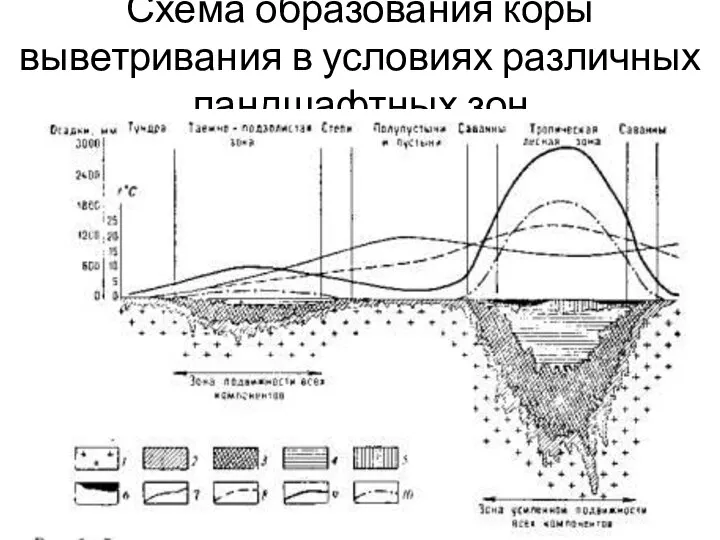
- 29. Схема образования коры выветривания в условиях различных ландшафтных зон
- 30. Условные обозначения 1 — материнская порода; 2 — зона дресвы химически малоизмененной; 3 — гидрослюдисто-монтмориллонитово-бейделлитовая зона;
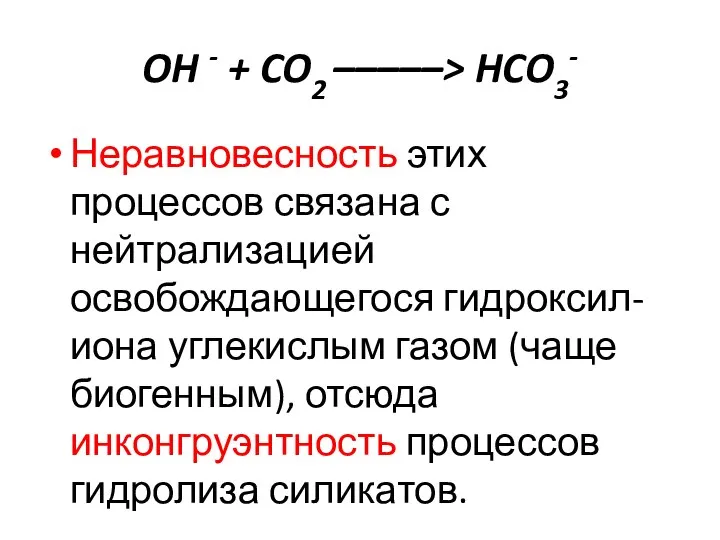
- 31. OH - + CO2 –––––> HCO3- Неравновесность этих процессов связана с нейтрализацией освобождающегося гидроксил-иона углекислым газом
- 33. Скачать презентацию



























 Базовые принципы и понятия технологии моделирования на основе UML
Базовые принципы и понятия технологии моделирования на основе UML ВАСИЛИЙ СУРИКОВ «Боярыня Морозова» «Степан Разин» «Утро стрелецкой казни» «Меньшиков в Березове» «Покорение Сибири Ермако
ВАСИЛИЙ СУРИКОВ «Боярыня Морозова» «Степан Разин» «Утро стрелецкой казни» «Меньшиков в Березове» «Покорение Сибири Ермако МОУ СОШ № 256 г.Фокино Каратанова Марина Николаевна.
МОУ СОШ № 256 г.Фокино Каратанова Марина Николаевна.  Организация международных перевозок Выполнили: Корнев Галибина
Организация международных перевозок Выполнили: Корнев Галибина  Sun SPARC station (SunOS и Solaris)
Sun SPARC station (SunOS и Solaris) Терроризм - угроза обществу
Терроризм - угроза обществу Berlin ist die Hauptstadt Deutschlands
Berlin ist die Hauptstadt Deutschlands урок 7
урок 7 КАСКО в десятку
КАСКО в десятку Презентация "Культура" - скачать презентации по МХК
Презентация "Культура" - скачать презентации по МХК Презентация Экономическое взаимодействие Российской Федерации в интеграционных процессах и международное сотрудничество тамож
Презентация Экономическое взаимодействие Российской Федерации в интеграционных процессах и международное сотрудничество тамож Построение фасада
Построение фасада Веб-форум Иванишкин Кирилл 191(1)
Веб-форум Иванишкин Кирилл 191(1) Функциональная анатомия сердца и пороки его развития
Функциональная анатомия сердца и пороки его развития Музейно-выставочный центр "На Спасской"
Музейно-выставочный центр "На Спасской" Raspisanie_16092019_prodlenka_final (1)
Raspisanie_16092019_prodlenka_final (1) Искусство Новгородских земель XI-XIII вв. Пригороды Великого Новгорода. Юрьев Монастырь
Искусство Новгородских земель XI-XIII вв. Пригороды Великого Новгорода. Юрьев Монастырь Г р а ф и к ф у н к ц и и Тип урока: урок применения знаний и умений Класс: 8 Учитель: Сафронова Н.Ю.
Г р а ф и к ф у н к ц и и Тип урока: урок применения знаний и умений Класс: 8 Учитель: Сафронова Н.Ю. Симптоматология синдромов артериальной гипертензии, коронарной недостаточности. Диагностические признаки гипертоническо
Симптоматология синдромов артериальной гипертензии, коронарной недостаточности. Диагностические признаки гипертоническо Моделирование динамических отношений на UML
Моделирование динамических отношений на UML Всемирный банк
Всемирный банк Политические партии и движения
Политические партии и движения Цифровая схемотехника. Базовые элементы цифровых интегральных схем
Цифровая схемотехника. Базовые элементы цифровых интегральных схем Формирование учетной политики в бухгалтерском учете Доцент, к.э.н. Зайцева Татьяна Львовна
Формирование учетной политики в бухгалтерском учете Доцент, к.э.н. Зайцева Татьяна Львовна Авиценна Народная медицина
Авиценна Народная медицина  Искусство оригами
Искусство оригами Время и числовая информация
Время и числовая информация Прессовые формовочные машины
Прессовые формовочные машины