Содержание
- 2. Гидратация-дегидратация Процесс гидратации заключается во вхождении молекул воды в структуру минералов в виде координационно связанных молекул
- 3. Одной из наиболее простых гидратирующих систем является пара гипс—ангидрит. CaSO4 + H2O CaSO4. 2H2O; ангидрит гипс
- 4. Аналогичные равновесия – мирабилит-тенардит, содовые минералы Гидрогели: SiO2 + nH2O SiO2.nH2O (опал) Агаты. Интересные свойства кремней
- 5. Поглощение воды цеолитами связано со свойствами кристаллической решетки. Алюминиевые и кремниевые тетраэдры образуют рыхлый каркас с
- 6. Вхождение воды в состав цеолитных минералов в первую очередь связано с увеличением гидростатического давления, вывод ее
- 7. Особо следует остановиться на глинистых минералах, ряд которых содержит межслоевую воду (смектиты, вермикулиты, галлуазиты). Ее удаление,
- 8. Таким образом, процессы, возникающие на границе раздела горных пород и подземных вод, приводят во многих случаях
- 9. Сорбция, ионный обмен Сорбция – избирательное поглощение твердых веществ и газов. Мера: удельная поверхность – м2/г.
- 10. Поэтому значительна и поверхностная энергия природных коллоидов Неполярная сорбция состоит в поглощении из раствора целых молекул,
- 11. Полярная сорбция - ионный обмен Истолкование ионного обмена было дано выдающимся русским ученым К.К. Гедройцем (1872
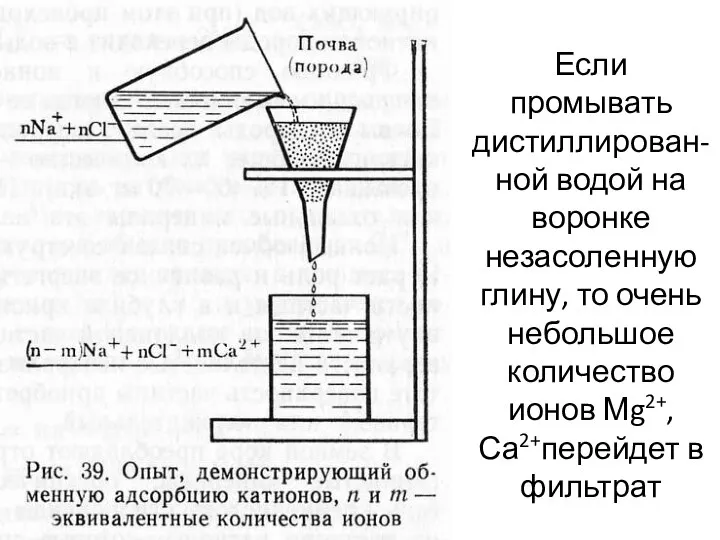
- 12. Если промывать дистиллирован-ной водой на воронке незасоленную глину, то очень небольшое количество ионов Мg2+, Са2+перейдет в
- 13. Если вместо воды применить раствор соли, например NаСl, то количество Сl- в фильтрате почти не изменится,
- 14. Катионы породы, способные обмениваться на катионы раствора, Гедройц назвал обменными катионами. Наиболее энергично поглощаются многовалентные катионы
- 15. Обменная сорбция подчиняется закону действия масс, она тем интенсивнее, чем выше концентрация катионов в водах Ряды:
- 16. SО4 - Са (или SО4 - Мg) подземные воды мигрируют среди глинистых пород морского происхождения, обычно
- 17. Постепенно весь обменный натрий глин переходит в раствор, воды из сульфатных кальциевых (магниевых) превращаются в сульфатные
- 18. Возможны и обратные реакции: сульфатные-натриевые воды, мигрируя среди горных пород, поглощающий комплекс которых насыщен Са2+, обменивают
- 19. Менее распространены положительно заряженные коллоиды, к которым относятся гидроксиды Fе, Аl, Тi, Sr и др. Они
- 20. Емкость поглощения (обменная емкость) – мг-экв/ 100 г породы Почвы и породы всегда содержат некоторое количество
- 21. Некоторые показатели Обменная емкость глинистых минералов (мг-экв/100 г): > 80 монтморилонит, нонтронит, бейделлит (трехслойная решетка) 15-80
- 22. Ионный обмен характерен не только для коллоидов он известен и у макрокристаллических силикатов. Еще в ХIХ
- 23. в гидротермальных и надкритических условиях к ионному обмену способны полевые шпаты, фельдшпатоиды, слюды, некоторые титано- и
- 24. Ионный обмен K+, Nа+, Li+, Rb+, Cs+ экспериментально установлен у поллуцита, сподумена, слюды. Возможность ионного обмена
- 26. Скачать презентацию






















 Исторические личности 1900-1924 годов
Исторические личности 1900-1924 годов Правила игры в баскетбол
Правила игры в баскетбол Транспортная безопасность США
Транспортная безопасность США Приборостроительный завод ОАО «Завод «Фиолент»
Приборостроительный завод ОАО «Завод «Фиолент» Сегментация
Сегментация  БОРИС МИХАЙЛОВИЧ КУСТОДИЕВ (1878-1927)
БОРИС МИХАЙЛОВИЧ КУСТОДИЕВ (1878-1927)  Презентация на тему "Клинические испытания новых лекарственных препаратов" - скачать презентации по Медицине
Презентация на тему "Клинические испытания новых лекарственных препаратов" - скачать презентации по Медицине О контрактной системе в сфере закупок товаров, работ, услуг для обеспечения государственных и муниципальных нужд
О контрактной системе в сфере закупок товаров, работ, услуг для обеспечения государственных и муниципальных нужд Хронология моды. 20 годы 20 века – 10 годы 21 века
Хронология моды. 20 годы 20 века – 10 годы 21 века Значення якості від Джозефа Джурана
Значення якості від Джозефа Джурана Детские зубные пасты
Детские зубные пасты Православное Богословие
Православное Богословие Ялтинско-потсдамская система международных отношений
Ялтинско-потсдамская система международных отношений Негативні явища економічних криз
Негативні явища економічних криз Презентация Сливочное масло и маргарин
Презентация Сливочное масло и маргарин Презентация на тему "Анатомия половой системы человека" - скачать презентации по Медицине
Презентация на тему "Анатомия половой системы человека" - скачать презентации по Медицине Уголовная ответственность медицинских работников
Уголовная ответственность медицинских работников Законы развития теории судебной экспертизы
Законы развития теории судебной экспертизы структура ферментов
структура ферментов Диаграмма
Диаграмма Тест каков Ваш потенциал лидера
Тест каков Ваш потенциал лидера Природно-заповедные территории Крыма
Природно-заповедные территории Крыма Политические партии и движения
Политические партии и движения исследовательская работа «Щитовидная железа»
исследовательская работа «Щитовидная железа» Отказ от использования гермоконтейнера
Отказ от использования гермоконтейнера Интерстициальные заболевания легких =диффузные инфильтративные ЗЛ Общие признаки прогрессирующая одышка разнообразные нар
Интерстициальные заболевания легких =диффузные инфильтративные ЗЛ Общие признаки прогрессирующая одышка разнообразные нар Классификация деловой документации
Классификация деловой документации Автор шаблона: Костенко Наталья Владимировна, учитель начальных классов
Автор шаблона: Костенко Наталья Владимировна, учитель начальных классов