Содержание
- 2. Ингибирование ферментативной активности - снижение каталитической активности в присутствии определённых веществ - ингибиторов. К ингибиторам следует
- 3. Ингибиторы вызывают большой интерес для выяснения механизмов ферментативного катализа, помогают установить роль отдельных ферментов в метаболических
- 4. Обратимое ингибирование
- 5. Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента.
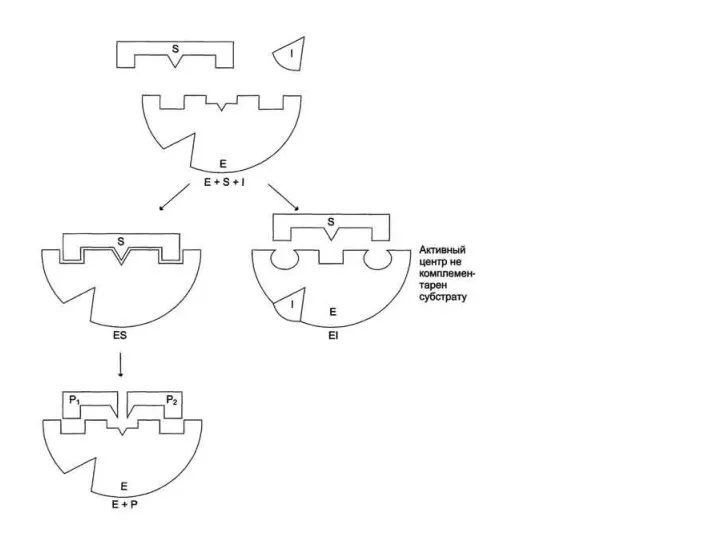
- 6. 1. Конкурентное ингибирование К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с
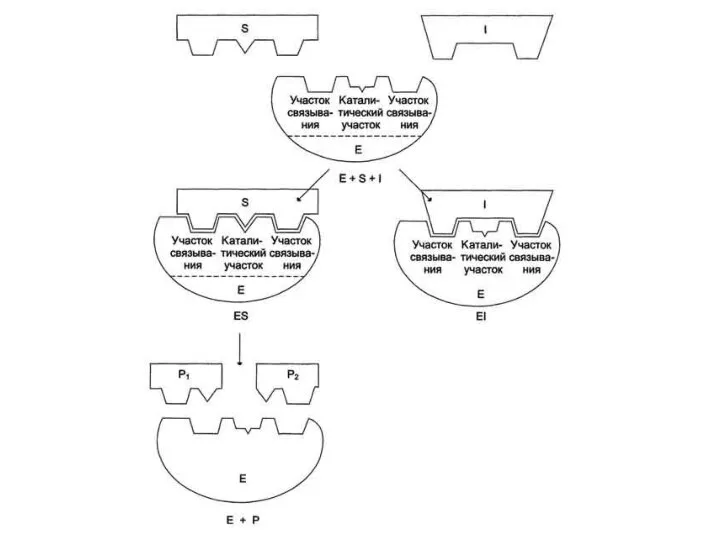
- 8. Для конкурентного типа ингибирования справедливы следующие уравнения: Е + S ⇔ ES → E + P,
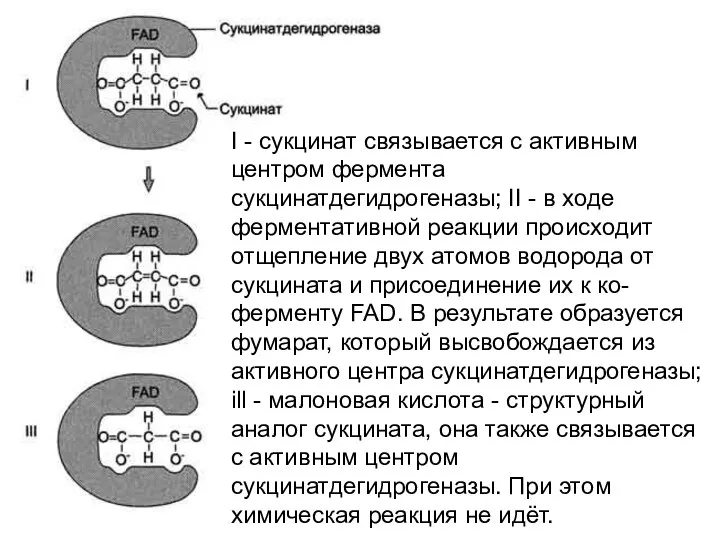
- 9. I - сукцинат связывается с активным центром фермента сукцинатдегидрогеназы; II - в ходе ферментативной реакции происходит
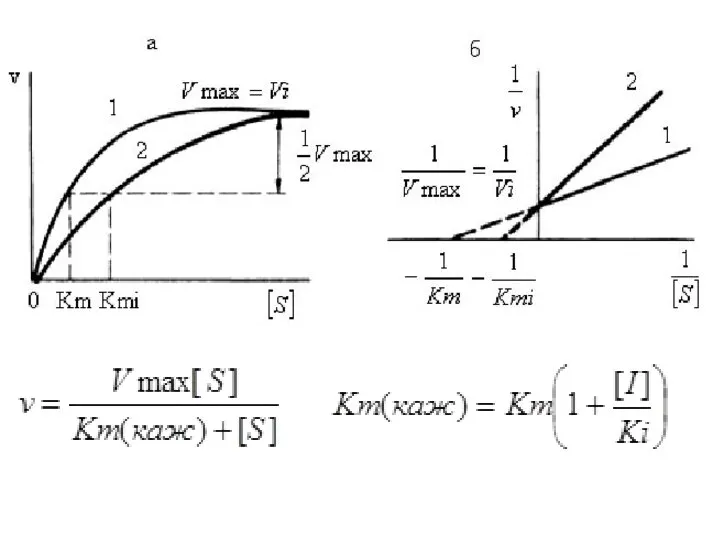
- 10. Кинетические зависимости Конкурентные ингибиторы уменьшают скорость химической реакции. Конкурентный ингибитор повышает Кm для данного субстрата (уменьшает
- 12. Лекарственные препараты как конкурентные ингибиторы Многие лекарственные препараты оказывают своё терапевтическое действие по механизму конкурентного ингибирования.
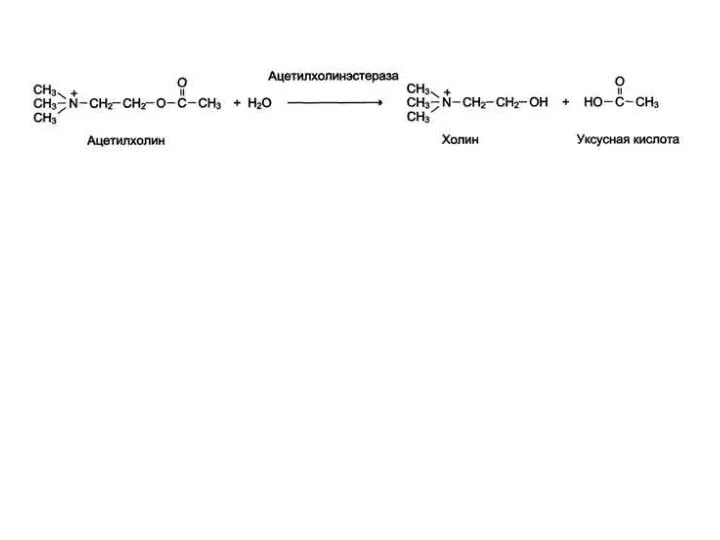
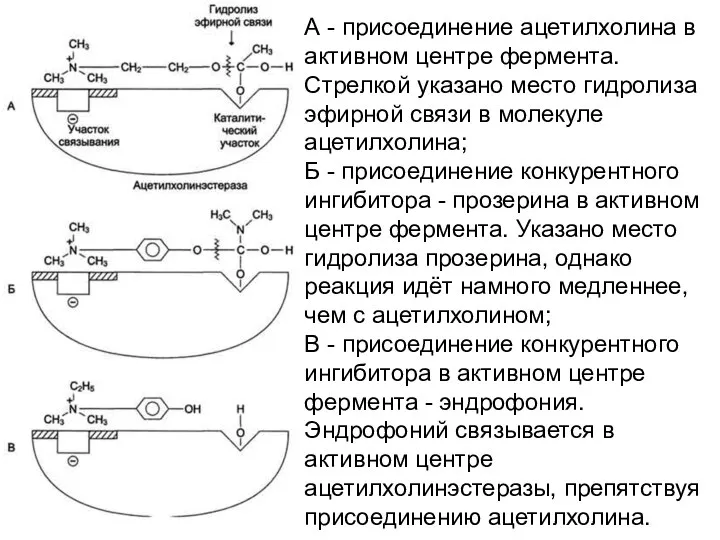
- 14. А - присоединение ацетилхолина в активном центре фермента. Стрелкой указано место гидролиза эфирной связи в молекуле
- 15. Антиметаболиты как лекарственные препараты В качестве ингибиторов ферментов по конкурентному механизму в медицинской практике используют вещества,
- 16. Неконкурентное ингибирование Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке,
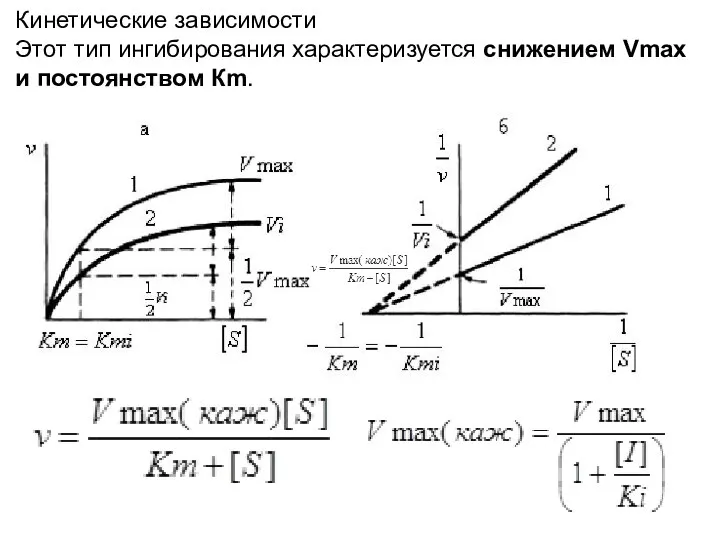
- 18. Кинетические зависимости Этот тип ингибирования характеризуется снижением Vmax и постоянством Кm.
- 19. Бесконкурентное ингибирование При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом.
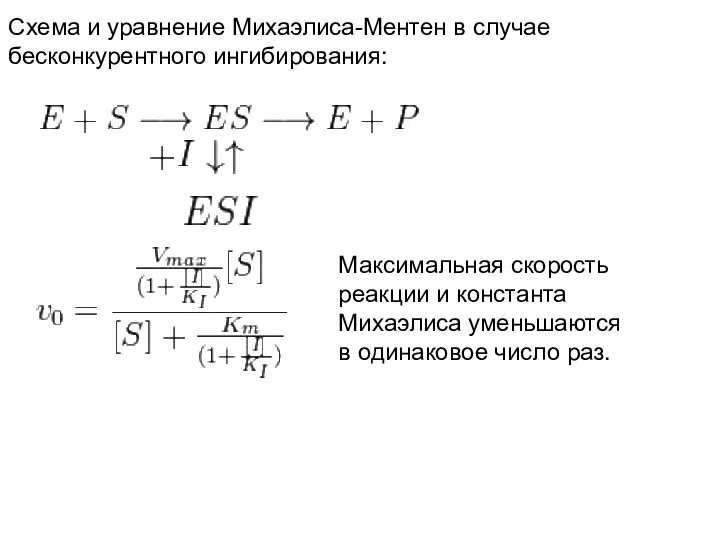
- 20. Схема и уравнение Михаэлиса-Ментен в случае бесконкурентного ингибирования: Максимальная скорость реакции и константа Михаэлиса уменьшаются в
- 21. Ингибирование субстратом частный случай бесконкурентного ингибирования, когда две молекулы субстрата связываются с ферментом, что препятствует образованию
- 22. Необратимое ингибирование
- 23. Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего
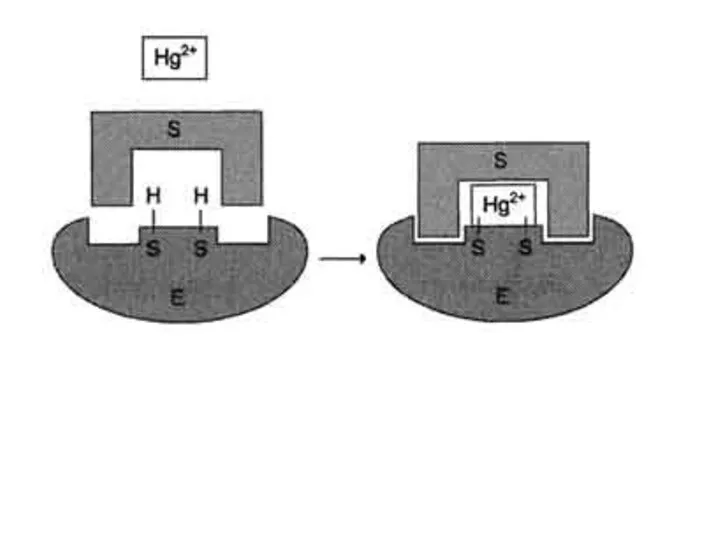
- 25. Специфические и неспецифические ингибиторы Использование необратимых ингибиторов представляет большой интерес для выяснения механизма действия ферментов. С
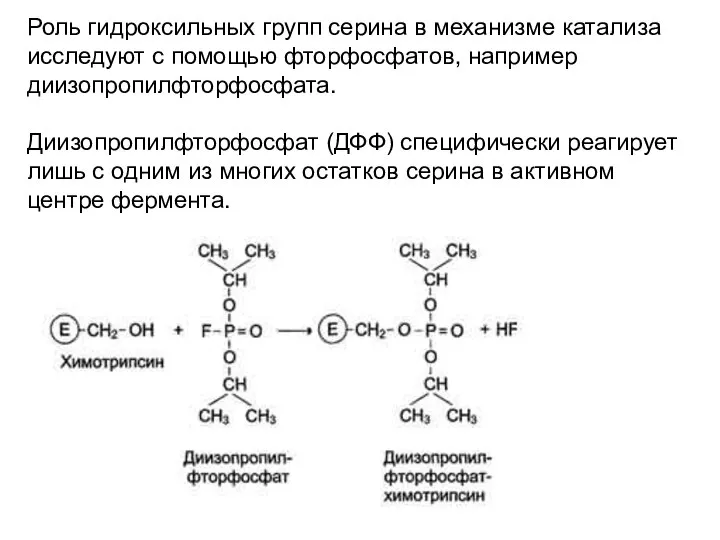
- 26. Роль гидроксильных групп серина в механизме катализа исследуют с помощью фторфосфатов, например диизопропилфторфосфата. Диизопропилфторфосфат (ДФФ) специфически
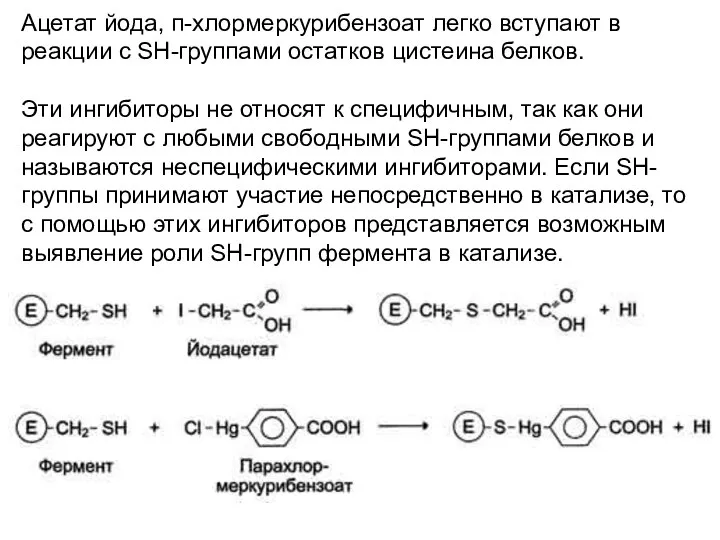
- 27. Ацетат йода, п-хлормеркурибензоат легко вступают в реакции с SH-группами остатков цистеина белков. Эти ингибиторы не относят
- 28. Необратимые ингибиторы ферментов как лекарственные препараты Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов,
- 30. Скачать презентацию
















 Линейные цепи постоянного тока
Линейные цепи постоянного тока Понятие и общие правила производства следственных действий Работу выполнили Пустовая Анастасия, Мятлик Елена, Ю-103
Понятие и общие правила производства следственных действий Работу выполнили Пустовая Анастасия, Мятлик Елена, Ю-103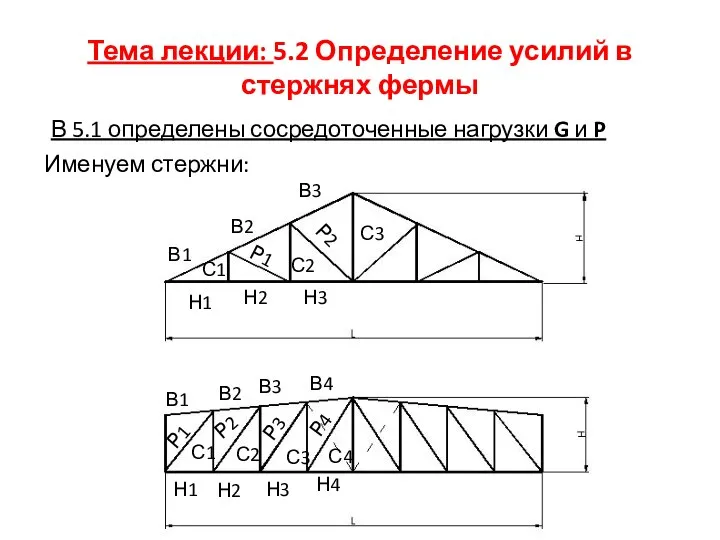 Определение усилий в стержнях фермы
Определение усилий в стержнях фермы Лидер и мир. Что предполагает Евангелие
Лидер и мир. Что предполагает Евангелие Культурное наследие Латвии
Культурное наследие Латвии ФЕРМЕНТЫ
ФЕРМЕНТЫ Министерства США
Министерства США Прерывания в микропроцессорах
Прерывания в микропроцессорах Системы жизнеобеспечения населенных мест и зданий
Системы жизнеобеспечения населенных мест и зданий МЕТОДИКА РАСКРЫТИЯ ПОЛОСТЕЙ РАЗЛИЧНЫХ ГРУПП ЗУБОВ
МЕТОДИКА РАСКРЫТИЯ ПОЛОСТЕЙ РАЗЛИЧНЫХ ГРУПП ЗУБОВ Технология ТО и ремонта. Ходовая часть
Технология ТО и ремонта. Ходовая часть Архитектура и искусство Великобритании XVIІІ в
Архитектура и искусство Великобритании XVIІІ в Цели и инструменты денежно-кредитной политики. Горовых.А.Е
Цели и инструменты денежно-кредитной политики. Горовых.А.Е Путешествие на планету Знаний
Путешествие на планету Знаний Фундаменты. Классификация
Фундаменты. Классификация Гостевой этикет
Гостевой этикет Интернет жұмыс
Интернет жұмыс Обучение атакующим действиям в футболе юношей 14-15 лет с использованием индивидуальной групповой тактики
Обучение атакующим действиям в футболе юношей 14-15 лет с использованием индивидуальной групповой тактики Развитие спортивно-оздоровительного туризма в России
Развитие спортивно-оздоровительного туризма в России Биологическая обратная связь (БОС) в спорте
Биологическая обратная связь (БОС) в спорте Отчет о практике по получению первичных профессиональных умений и навыков. Объект практики СИУ-филиал РАНХиГС
Отчет о практике по получению первичных профессиональных умений и навыков. Объект практики СИУ-филиал РАНХиГС Нормативная база ценообразования в строительстве
Нормативная база ценообразования в строительстве НЕ продавай себя Не делайтесь рабами людей
НЕ продавай себя Не делайтесь рабами людей Базовый гардероб
Базовый гардероб Общение в Интернете
Общение в Интернете Архитектура ПК. Устройство ПК
Архитектура ПК. Устройство ПК САВАЛА Автор: Данила Гришаев, 2 «Б» класс, СОШ № 2, г.Жердевка, Тамбовская область Руководи
САВАЛА Автор: Данила Гришаев, 2 «Б» класс, СОШ № 2, г.Жердевка, Тамбовская область Руководи Code Validation. CSS reset and validation
Code Validation. CSS reset and validation