Содержание
- 2. Энзимопатии
- 3. Энзимопатии – это группа заболеваний, которые вызваны различными дефектами ферментов. Энзимопатий делятся на: наследственные (первичные) приобретенные
- 4. Причиной наследственных энзимопатий является генетически обусловленная недостаточность или полное отсутствие синтеза ферментов. Дефектные ферменты наследуются, в
- 5. 1) В норме: 2) Дефекты регуляторных участков белков, которые контролируют синтез ферментов, вызывает полное или частичное
- 6. Особенностью течения наследственных энзимопатий является наличие скрытого периода, когда болезнь клинически не проявляется, но может быть
- 7. Классификация наследственных энзимопатий до конца не разработана, обычно их разделяют по типу нарушений метаболизма: 1. нарушения
- 8. Примеры: Синдром Лёша — Найхана — наследственное заболевание, характеризующееся увеличением синтеза мочевой кислоты (у детей) вызванное
- 9. Фенилпировиноградная олигофрения – наследственное заболевание, приводящее в раннем детстве к гибели ребенка или к развитию тяжелой
- 10. Фермент, катализирующий данную реакцию, не синтезируется в клетках печени, единственном органе, где он в норме открыт.
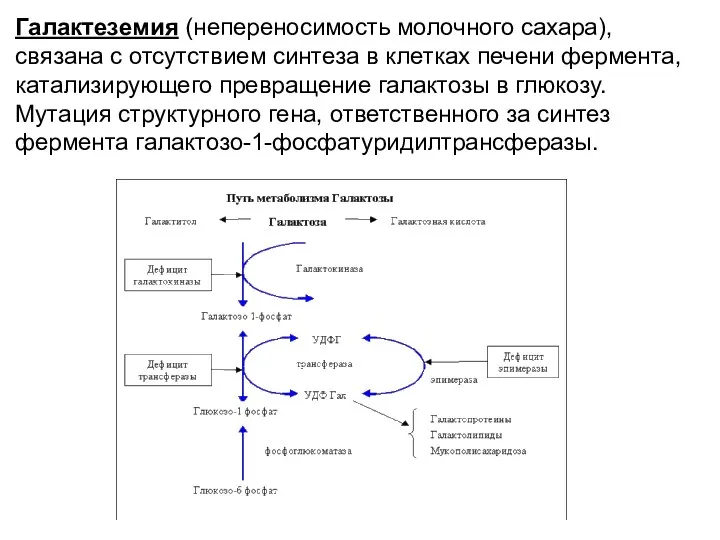
- 11. Галактеземия (непереносимость молочного сахара), связана с отсутствием синтеза в клетках печени фермента, катализирующего превращение галактозы в
- 12. Следствием подобной аномалии является накопление галактозы в тканях и развития катаракты в раннем возрасте, поражение тканей
- 13. Приобретенные Аллиментарные энзимопатии – это стойкие нарушения активности ферментов, связанные с характером питания: 1. отсутствием или
- 14. Токсические энзимопатии обусловлены избирательным угнетением активности или синтеза отдельных ферментов или неспецифическим угнетением биосинтеза белка в
- 15. Энзимодиагностика
- 16. Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях
- 17. 1. Причины, приводящие к увеличению количества ферментов в крови Ферменты плазмы крови можно разделить на 2
- 18. При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в
- 19. Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов. Например, появление в плазме крови ферментов,
- 20. Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при
- 21. 2. Изоферменты Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка,
- 22. По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует
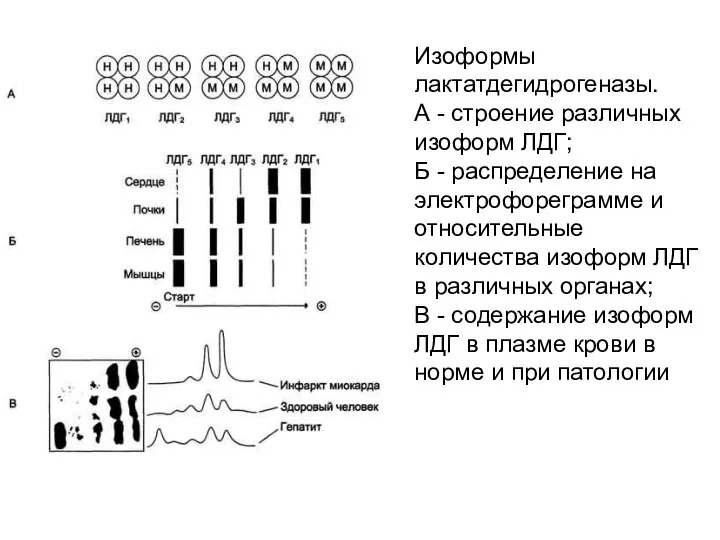
- 23. Изоформы лактатдегидрогеназы. Фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты)
- 24. Изоформы лактатдегидрогеназы. А - строение различных изоформ ЛДГ; Б - распределение на электрофореграмме и относительные количества
- 25. Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4 и ЛДГ5 (М-типы
- 26. Изоформы креатинкиназы. Креатинкиназа (КК) катализирует реакцию образования креатинфосфата: Молекула КК - димер, состоящий из субъединиц двух
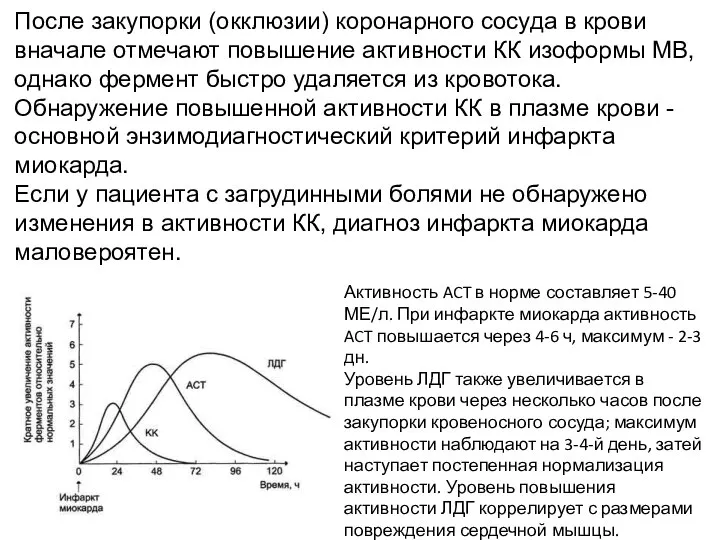
- 27. Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет
- 28. Аспартатаминотрансфераза (ACT) катализирует реакцию переаминирования (трансаминирования) между аспартатом и α-кетоглутаратом: α -Кетоглутарат + L-аспартат ↔ L-глутамат
- 29. 3. Энзимодиагностика при инфаркте миокарда Примерно 30% больных инфарктом миокарда имеют атипичную клиническую картину этого заболевания
- 30. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы MB, однако фермент
- 31. Аланинаминотрансфераза (АЛТ) Аланинаминотрансфераза (АЛТ) катализирует реакцию переаминирования между L-аланином и α-кетоглутаратом: L-аланин + α-кетоглутарат ↔ пируват
- 32. Клиническое значение определения концентрации аминотрансфераз. Повышение активности аминотрансфераз отмечено при ряде патологических процессов, в которые вовлечена
- 33. Активность ACT в крови возрастает при туберкулезе легких, септицемии, герпетической инфекции, вирусном гепатите, опухолях. Активность ACT
- 34. Исследование отношения мАСТ/общая активность ACT также было предложено в качестве диагностического теста. Отношение мАСТ/общая активность ACT
- 35. α-Амилаза -фермент, гидролизующий внутренние 1,4 α -гликозидные связи крахмала, гликогена и других полимеров глюкозы. Клиническое значение
- 36. Активность α -амилазы в сыворотке крови часто увеличена при почечной недостаточности, однако не совсем ясно, что
- 37. ʏ-Глутамилтранспептидаза ГГТ катализирует перенос у-глутамила на аминокислоту или пептид, на другую молекулу субстрата или воду. Биологическая
- 38. Клиническое значение определения концентрации ГГТ в сыворотке крови Наиболее частая причина повышения активности ГГТ в сыворотке
- 40. Энзимотерапия
- 41. Использование ферментов в качестве терапевтических средств имеет много ограничений вследствие их высокой иммуногенности. Тем не менее
- 42. Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков. Например, пепсин используют при
- 43. В качестве дополнительных терапевтических средств ферменты используют при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при
- 44. Ферментные препараты стали широко применять при тромбозах и тромбоэмболиях. С этой целью используют препараты фибринолизина, стрептолиазы,
- 46. Скачать презентацию







































 Рождественские узоры Поволжья. Порядок участия в Межрегиональной выставке-ярмарке
Рождественские узоры Поволжья. Порядок участия в Межрегиональной выставке-ярмарке Заболевания глотки
Заболевания глотки трехфазные цепи
трехфазные цепи АДМИНИСТРАТИВНО-ЮРИСДИКЦИОННЫЙ ПРОЦЕСС
АДМИНИСТРАТИВНО-ЮРИСДИКЦИОННЫЙ ПРОЦЕСС  Лекция 8 Марксизм как теория исторического процесса
Лекция 8 Марксизм как теория исторического процесса  Я і мая сям’я. Адзенне і абутак. (Тэма 10)
Я і мая сям’я. Адзенне і абутак. (Тэма 10) Спутниковые навигационные системы. (Тема 9)
Спутниковые навигационные системы. (Тема 9) Комплексна оцінка туристичного потенціалу обласного регіону Львів, України
Комплексна оцінка туристичного потенціалу обласного регіону Львів, України Анализ сертификата соответствия системы добровольной сертификации
Анализ сертификата соответствия системы добровольной сертификации Тестирование аэробной мощности у спортсменов
Тестирование аэробной мощности у спортсменов День инвестора Центральной и Восточной Европы (IDCEE) Интернет-технологии и инновации 25-26 октября, 2011 Киев, Украина
День инвестора Центральной и Восточной Европы (IDCEE) Интернет-технологии и инновации 25-26 октября, 2011 Киев, Украина  Физическая культура стран Древнего Востока
Физическая культура стран Древнего Востока Автоматическая система водоохлаждения на АЭС
Автоматическая система водоохлаждения на АЭС Презентация на тему "Творческая группа "Современный урок "" - скачать презентации по Педагогике
Презентация на тему "Творческая группа "Современный урок "" - скачать презентации по Педагогике Геодезические работы при строительстве мостов
Геодезические работы при строительстве мостов Растворы
Растворы  Презентация Методы очистки питьевой воды,
Презентация Методы очистки питьевой воды, Политические партии и общественные объединения
Политические партии и общественные объединения «Построение кривой Лоренца и расчет коэффициента Джини» Подготовила студентка Житкова Екатерина 1 курса экономического факуль
«Построение кривой Лоренца и расчет коэффициента Джини» Подготовила студентка Житкова Екатерина 1 курса экономического факуль У Казахстані на основі гібридизації тонкорунних овець з диким гірським бараном Архар створена нова порода тонкорунних
У Казахстані на основі гібридизації тонкорунних овець з диким гірським бараном Архар створена нова порода тонкорунних Настройка струи на принтере Citronix
Настройка струи на принтере Citronix Классификация стабилизаторов
Классификация стабилизаторов Презентация Основные положения Таможенного кодекса по соблюдению запретов и ограничений по перемещаемым товарам через таможенну
Презентация Основные положения Таможенного кодекса по соблюдению запретов и ограничений по перемещаемым товарам через таможенну Составление задач на сложение и вычитание по одному рисунку - презентация для начальной школы_
Составление задач на сложение и вычитание по одному рисунку - презентация для начальной школы_ Презентация "Дмитрий Григорьевич Левицкий. «Портрет М.А, Дьяковой» , 1778, ГТГ" - скачать презентации по МХК
Презентация "Дмитрий Григорьевич Левицкий. «Портрет М.А, Дьяковой» , 1778, ГТГ" - скачать презентации по МХК Федеральная служба по интеллектуальной собственности и патентам
Федеральная служба по интеллектуальной собственности и патентам Проект скловарної печі для виробництва склопрофіліту продуктивнiстю 160 т/добу
Проект скловарної печі для виробництва склопрофіліту продуктивнiстю 160 т/добу Основы организации аварийно-спасательных и других неотложных работ в ЧС
Основы организации аварийно-спасательных и других неотложных работ в ЧС