Содержание
- 2. Коэффициент чувствительности S: у = S ∙ X Δ у у2 – у1 у3 – у2
- 3. Электрохимические методы анализа (ЭХМА) Классификация ЭХМА По природе измеряемого параметра электрохимической ячейки Метод Измеряемый параметр Условия
- 4. Потенциометрия Уравнение Нернста: RT aOх Е = Е0 + ∙ ln ∙ aНР nF aRed Индикаторные
- 5. Активные металлические электроды I-го рода (Ag, Pb, Cu, Cd): E = E0Ag+/Ag + 0.059 ∙ lg
- 6. Электроды с твердыми кристаллическими мембранами: Электрод Раствор I Мембрана Раствор II Электрод cравнения I (анализируемый) (внутренний)
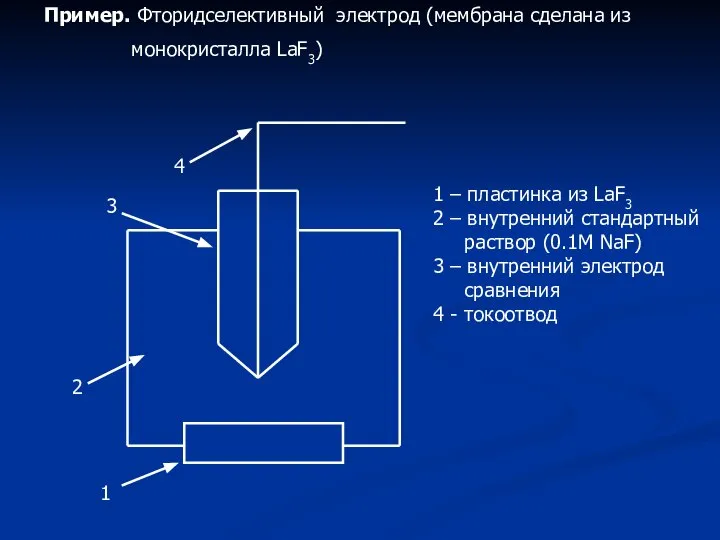
- 7. Пример. Фторидселективный электрод (мембрана сделана из монокристалла LaF3) 1 4 3 2 1 – пластинка из
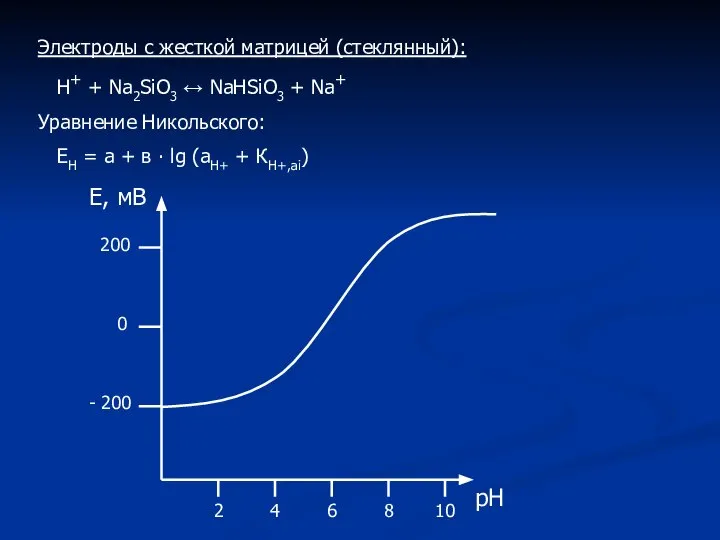
- 8. Электроды с жесткой матрицей (стеклянный): Н+ + Na2SiO3 ↔ NaНSiO3 + Na+ Уравнение Никольского: ЕН =
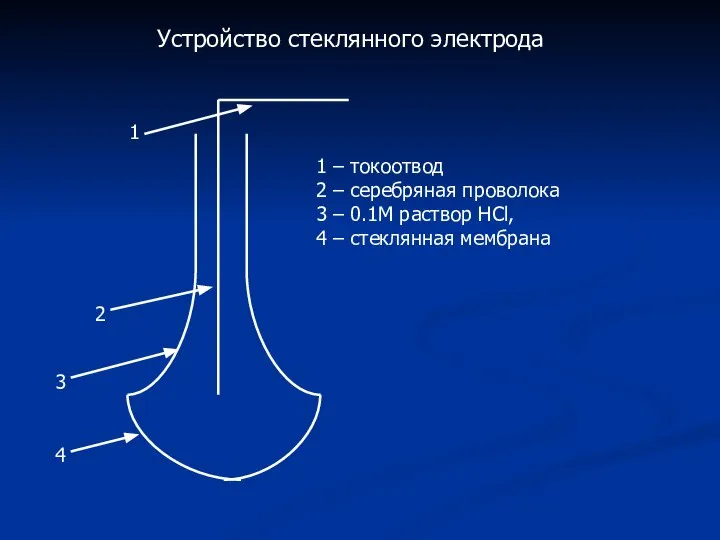
- 9. Устройство стеклянного электрода 1 2 3 4 1 – токоотвод 2 – серебряная проволока 3 –
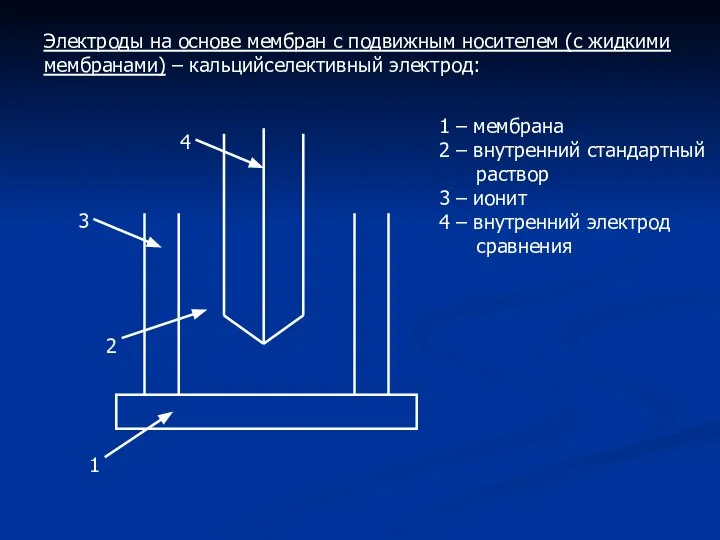
- 10. Электроды на основе мембран с подвижным носителем (с жидкими мембранами) – кальцийселективный электрод: 1 2 3
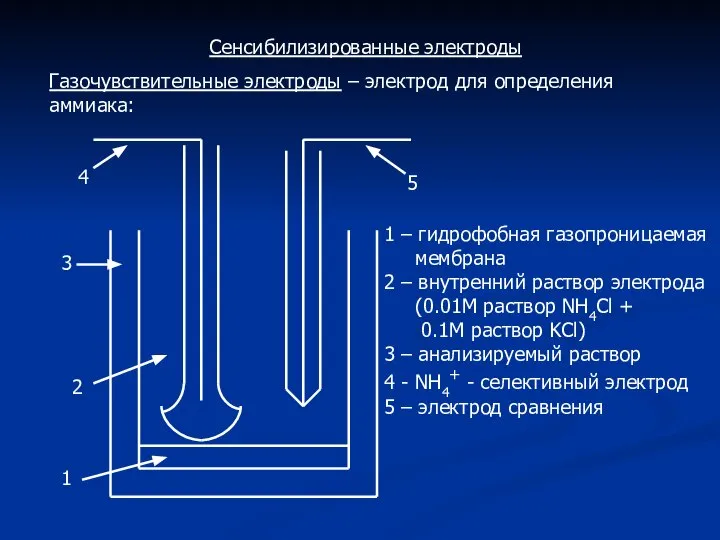
- 11. Сенсибилизированные электроды Газочувствительные электроды – электрод для определения аммиака: 1 2 3 4 5 1 –
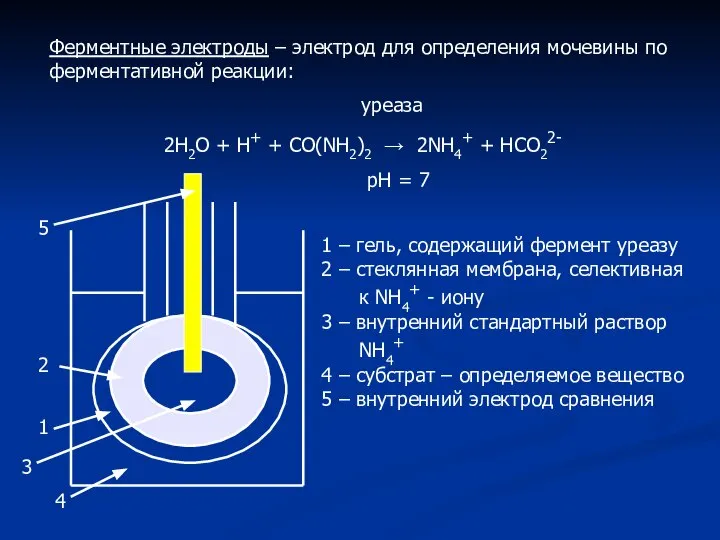
- 12. Ферментные электроды – электрод для определения мочевины по ферментативной реакции: уреаза 2Н2О + Н+ + СО(NH2)2
- 13. Практическое определение содержания ионов методом прямой потенциометрии Уравнение связи: RT ЕИСЭ = const + ∙ lg
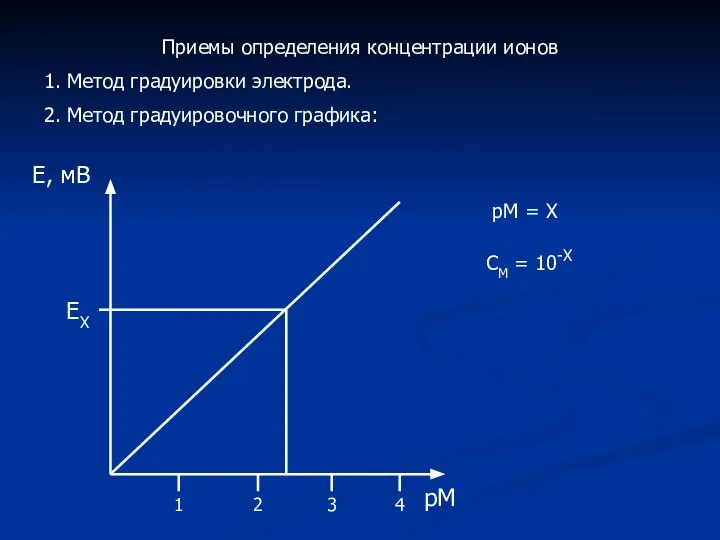
- 14. Приемы определения концентрации ионов 1. Метод градуировки электрода. 2. Метод градуировочного графика: Е, мВ рМ 1
- 15. 3. Метод добавок: n (E1 – K’) - lg CXjX = ; aX = CXjX 0.059
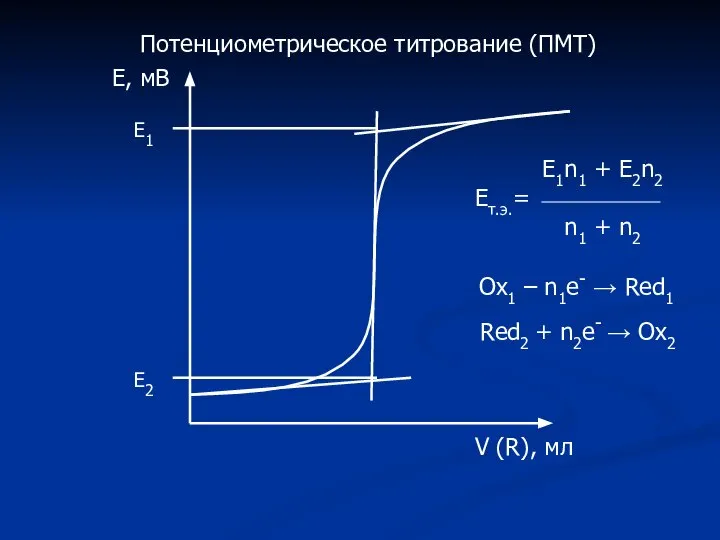
- 16. Потенциометрическое титрование (ПМТ) Е, мВ V (R), мл Е1 Е2 Е1n1 + E2n2 Ет.э.= n1 +
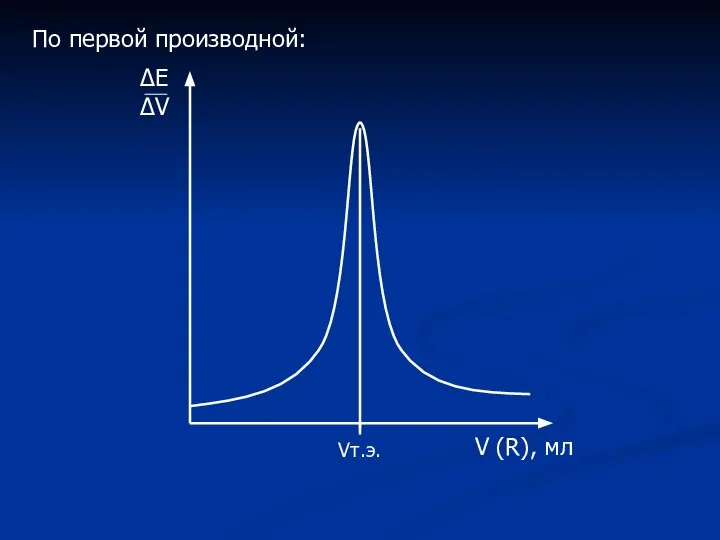
- 17. ΔЕ ΔV V (R), мл Vт.э. По первой производной:
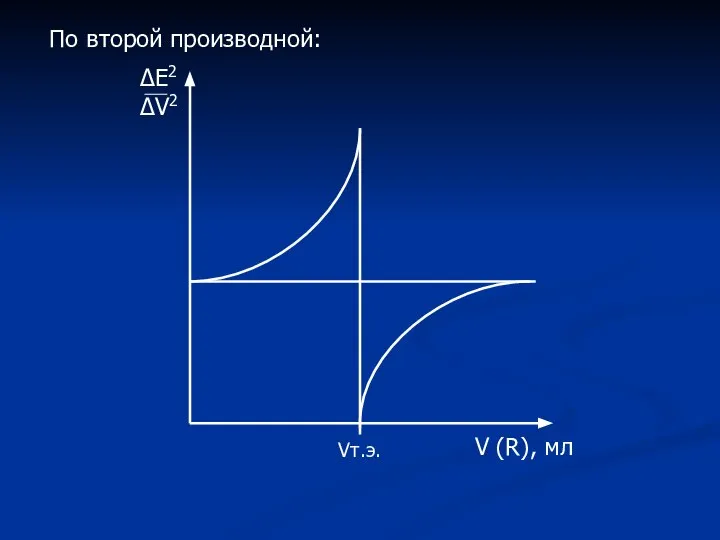
- 18. ΔЕ2 ΔV2 V (R), мл Vт.э. По второй производной:
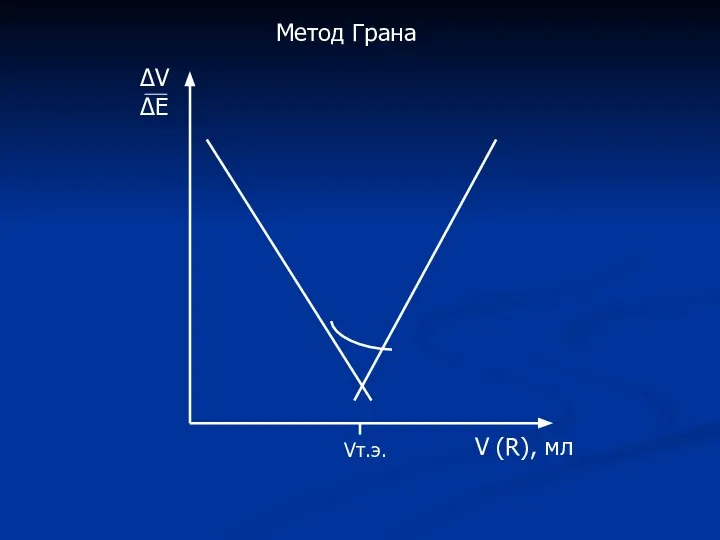
- 19. ΔV ΔЕ V (R), мл Vт.э. Метод Грана
- 21. Скачать презентацию







 ОСОБЕННОСТИ СТРОЕНИЯ ВРЕМЕННЫХ И ПОСТОЯННЫХ ЗУБОВ У ДЕТЕЙ, КОТОРЫЕ ИМЕЮТ ЗНАЧЕНИЕ В КЛИНИКЕ ДЕТСКОЙ СТОМАТОЛОГИИ
ОСОБЕННОСТИ СТРОЕНИЯ ВРЕМЕННЫХ И ПОСТОЯННЫХ ЗУБОВ У ДЕТЕЙ, КОТОРЫЕ ИМЕЮТ ЗНАЧЕНИЕ В КЛИНИКЕ ДЕТСКОЙ СТОМАТОЛОГИИ Презентация "Инвестиции муниципального образования" - скачать презентации по Экономике
Презентация "Инвестиции муниципального образования" - скачать презентации по Экономике Кибернетика
Кибернетика 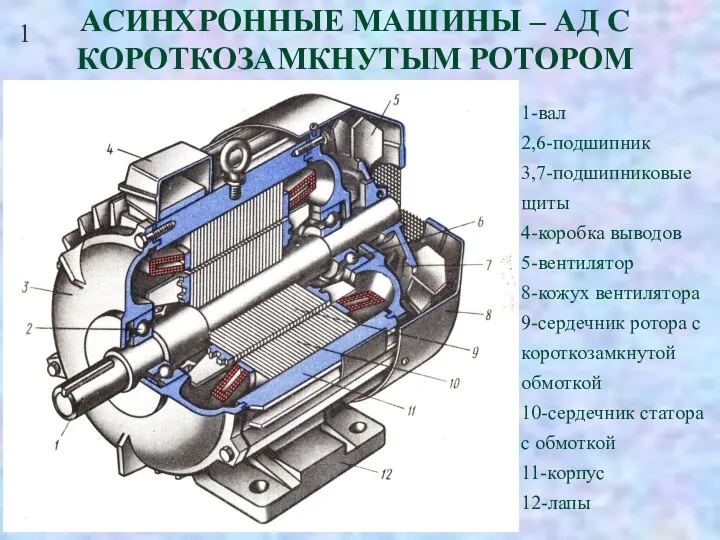 Асинхронные машины – АД с короткозамкнутым ротором
Асинхронные машины – АД с короткозамкнутым ротором Introduction to the HTML
Introduction to the HTML Презентация на тему "Формирования универсальных учебных действий у обучающихся на ступени начального общего образования" - с
Презентация на тему "Формирования универсальных учебных действий у обучающихся на ступени начального общего образования" - с Характеристика государственной, муниципальной, частной систем здравоохранения
Характеристика государственной, муниципальной, частной систем здравоохранения Восприятие русской аудиторией образа женщины-воина в современной японской массовой культуре
Восприятие русской аудиторией образа женщины-воина в современной японской массовой культуре Викторина по биографии Ю. А. Гагарина
Викторина по биографии Ю. А. Гагарина Дионисий. Знаменитые иконописцы
Дионисий. Знаменитые иконописцы История развития гидравлики
История развития гидравлики Отчет Богу
Отчет Богу Презентация Понятие Гражданско-правовой ответственнсти
Презентация Понятие Гражданско-правовой ответственнсти профессии 7 класс
профессии 7 класс Презентация "Организация контроля качества" - скачать презентации по Экономике
Презентация "Организация контроля качества" - скачать презентации по Экономике Глобальный этнический кризис
Глобальный этнический кризис Россия как тип культуры. Характерные черты
Россия как тип культуры. Характерные черты Презентация "Бизнес в Китае" - скачать презентации по Экономике
Презентация "Бизнес в Китае" - скачать презентации по Экономике Культура України в роки незалежності
Культура України в роки незалежності Формы правления
Формы правления Служебная документация для внутреннего пользования
Служебная документация для внутреннего пользования Материалы к заседанию Комиссии при Президенте Российской Федерации по модернизации и технологическому развитию экономик
Материалы к заседанию Комиссии при Президенте Российской Федерации по модернизации и технологическому развитию экономик Общие понятия микроклимата помещения
Общие понятия микроклимата помещения Периодические издания по дошкольному образованию
Периодические издания по дошкольному образованию Экстремизм и терроризм: основные понятия и причины его возникновения
Экстремизм и терроризм: основные понятия и причины его возникновения ПРОЕКТ Геометрическая вероятность. Теория вероятностей, 9 класс.
ПРОЕКТ Геометрическая вероятность. Теория вероятностей, 9 класс.  Презентация "Виды пейзажа" - скачать презентации по МХК
Презентация "Виды пейзажа" - скачать презентации по МХК Основные направления развития искусственного интеллекта
Основные направления развития искусственного интеллекта