Содержание
- 2. 1) До точки эквивалентности τ 0.059 [Fe3+] EFe3+/Fe2+ = E0Fe3+/Fe2+ + ∙ lg 1 [Fe2+] Обозначим
- 3. 2) В точке эквивалентности τ = 1: n1E10 + n2E20 , Ет.э. = n1 + n2
- 4. Пример 2. Построить кривую титрования Fe2+ раствором KMnO4, исходя из следующих условий: СН+ = 1 моль/л,
- 5. 4 9.00 9.0/10 = 0.900 E = 0.77 + 0.059∙lg (0.9/0.1) = 0.830 недотитровано на 10
- 6. После точки эквивалентности EMnO4-/Mn2+ = E0MnO4-/Mn2+ + (0.0118 ∙ lg (τ - 1)) 8 10.05 10.05/10
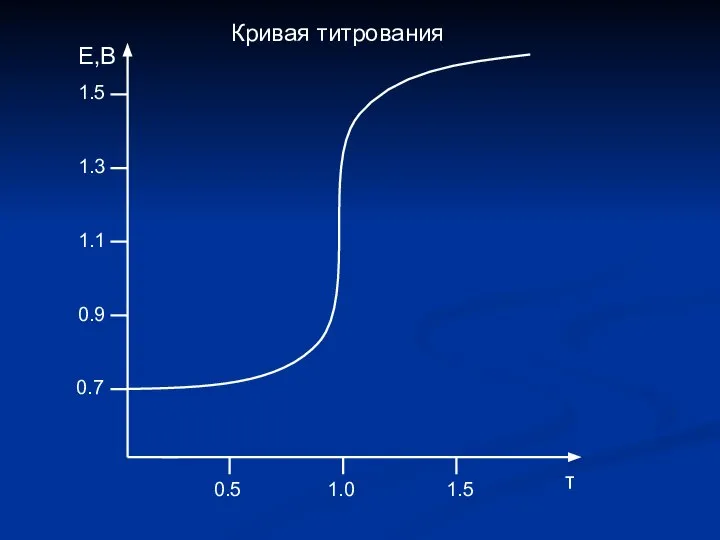
- 7. Кривая титрования Е,В 0.7 0.9 1.1 1.3 1.5 τ 0.5 1.0 1.5
- 8. Скачок титрования: 0.059 0.059 ΔЕ = ЕΔ=1.01 - ЕΔ=0.99 = Е20 + ∙ lg 10-2 –
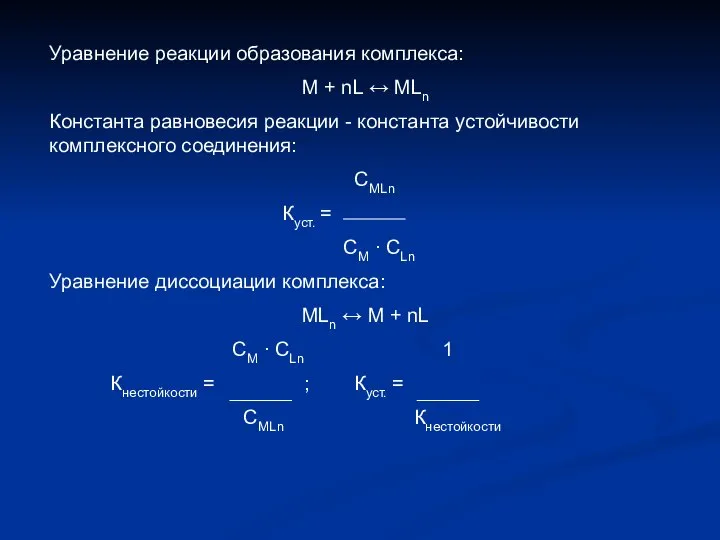
- 9. Уравнение реакции образования комплекса: М + nL ↔ MLn Константа равновесия реакции - константа устойчивости комплексного
- 11. Скачать презентацию
![1) До точки эквивалентности τ 0.059 [Fe3+] EFe3+/Fe2+ = E0Fe3+/Fe2+ +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1293272/slide-1.jpg)





 Интерфейсы при потере подвижности (лекция 1)
Интерфейсы при потере подвижности (лекция 1) Туристские узлы и их применение
Туристские узлы и их применение ВОЗРАСТНАЯ ПСИХОЛОГИЯ ЛЕКЦИЯ 1
ВОЗРАСТНАЯ ПСИХОЛОГИЯ ЛЕКЦИЯ 1 ПРЕДМЕТ,МЕТОДОЛОГИЯ И ЗАДАЧИ КУРСА 1. ПРЕДМЕТ КУРСА; 2. ОБЪЕКТ ИЗУЧЕНИЯ; 3. МЕТОДОЛОГИЧЕСКИЕ И МЕТОДИЧЕСКИЕ ОСНОВЫ; 4.ЗАДАЧИ КУРСА.
ПРЕДМЕТ,МЕТОДОЛОГИЯ И ЗАДАЧИ КУРСА 1. ПРЕДМЕТ КУРСА; 2. ОБЪЕКТ ИЗУЧЕНИЯ; 3. МЕТОДОЛОГИЧЕСКИЕ И МЕТОДИЧЕСКИЕ ОСНОВЫ; 4.ЗАДАЧИ КУРСА. Экономические основы деятельности фирмы
Экономические основы деятельности фирмы  2016 - год культуры в Беларуси
2016 - год культуры в Беларуси Теория и практика становления экономики, налогов и финансов России в Х – ХХ веках
Теория и практика становления экономики, налогов и финансов России в Х – ХХ веках  Языковая политика и языковое планирование: прикладные задачи (международный, российский, республиканский уровень)
Языковая политика и языковое планирование: прикладные задачи (международный, российский, республиканский уровень) ГРИБЫ. ЕСТЕСТВОЗНАНИЕ . 2 КЛАСС Гиль Наталья Николаевна Маардуская гимназия Сентябрь, 2011год
ГРИБЫ. ЕСТЕСТВОЗНАНИЕ . 2 КЛАСС Гиль Наталья Николаевна Маардуская гимназия Сентябрь, 2011год  Группа Магнезит. Производство и реализация огнеупорной продукции
Группа Магнезит. Производство и реализация огнеупорной продукции Модульное тестирование с JUnit
Модульное тестирование с JUnit ICX Kazakhstan: Total Available TNs : 24 Total Available EPs : 135 LC Almaty Total Available TNs : 24 Total Available EPs : 132. - презентация
ICX Kazakhstan: Total Available TNs : 24 Total Available EPs : 135 LC Almaty Total Available TNs : 24 Total Available EPs : 132. - презентация Государственный долг и его социально-экономические последствия Выполнила студентка группы Э111б Мотырева А
Государственный долг и его социально-экономические последствия Выполнила студентка группы Э111б Мотырева А Методы формирования физической культуры личности
Методы формирования физической культуры личности  Применение линейного программирования в математических моделях
Применение линейного программирования в математических моделях Кампанелла Томмазо
Кампанелла Томмазо  Финансовый контур
Финансовый контур  Чрезвычайные ситуации техногенного характера и их классификация
Чрезвычайные ситуации техногенного характера и их классификация  Диссидентское движение
Диссидентское движение Механизм кинематикасының графикалық әдістері
Механизм кинематикасының графикалық әдістері Системы пожарной сигнализации
Системы пожарной сигнализации Noţiunea, obiectul şi sistemul dreptului ecologic
Noţiunea, obiectul şi sistemul dreptului ecologic Философия кадрового консультирования
Философия кадрового консультирования Компьютерное моделирование артикуляторных и акустических процессов в естественных языков
Компьютерное моделирование артикуляторных и акустических процессов в естественных языков Десятичные дроби Понятие десятичной дроби. План: Немного истории Новая запись чисел Алгоритм десятичной записи Таблица раз
Десятичные дроби Понятие десятичной дроби. План: Немного истории Новая запись чисел Алгоритм десятичной записи Таблица раз Язык Javascript
Язык Javascript Введение в мировую художественную культуру Виды искусства
Введение в мировую художественную культуру Виды искусства Н.В. Гоголь. Биография гения
Н.В. Гоголь. Биография гения