Содержание
- 2. Роль коллоидов в самоочищении природных вод и формировании рудных месторождений. В природных водах происходит постоянный обмен
- 3. Коллоиды активно участвуют в формировании некоторых типов месторождений: железорудных формаций, полей металлоносных осадков (гидротермальный плюм на
- 4. Оксид кремния SiО2 В большинстве случаев SiО2 поступает в воды в результате гидролиза полевых шпатов при
- 5. В ультрапресных водах SiО2 является главным компонентом химического состава. Содержание его возрастает и в щелочных водах,
- 6. Гейзер Малахитовый, Камчатка
- 7. Гейзериты в районе проявления терм. Сиена, Италия
- 8. Термальные воды, насыщенные коллоидами кремния
- 9. Оксид кремния малотоксичен для человека, животных, микроорганизмов и растений. Для орошения почвы в США рекомендуется использовать
- 10. Кремнекислота добавляется в мягкие воды как средство защиты металлических трубопроводов от коррозии. В бальнеологии кремнекислота состава
- 11. Гидроксиды железа. Пределы растворимости ПРFе(OH)2 – 4,8.10-16; Fe(OH)3 – 4.10-38. При окислении (Fe2+→Fe3+) и гидролизе образуется
- 12. Окислительный и сульфидный барьеры. Гидротермальное поле Снейк Пит, Атлантика
- 13. Во многом поэтому железо относительно широко распространено в горных породах и минералах (кларк 4,2 %) (железорудные
- 14. Гидроксиды марганца. Предел растворимости ПРMn(OH)2 – 4.10-14. Марганец Мn2+ содержится в водах в концентрациях на порядок
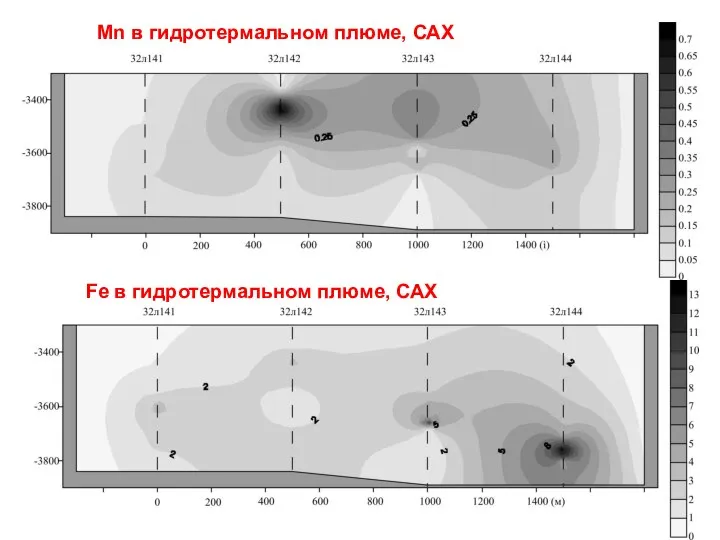
- 15. Fe в гидротермальном плюме, САХ Mn в гидротермальном плюме, САХ
- 16. Установлено, что наиболее эффективно Мn2+ переводится во взвешенное состояние с участием бактерий. В концентрациях больше 0,1
- 17. Образование железомарганцевых конкреций (дно Океана; Финский залив). Первые сведения о рудных образованиях на дне Океана были
- 19. Другой тип образований – Fe-Mn корки, которые, в отличие от конкреций, образуют относительно тонкие покровы на
- 20. Из восстановленных осадков растворенный Mn мигрирует к поверхности дна и в благоприятных фациальных условиях (высокие содержания
- 22. Кроме того железистые и марганцеворудные формации на суше хотя и сопутствуют друг другу, но всегда разделены
- 23. Гидроксиды алюминия. Предел растворимости алюминия гидроксида ПР Al(OH)3 1,9.10-33. Другие формулы: H3AlO , H3AlO , HAlO2,
- 24. В природных водах алюминий присутствует в ионной, коллоидной и взвешенной формах. Миграционная способность невысокая. Образует довольно
- 25. Используется для очистки питьевых вод Наиболее часто на водопроводах в качестве коагулянта применяют неочищенный алюминия сульфат
- 26. Al2(SO4)3 + ЗСа(НСO3)2 = 2Аl(ОН)3 + 3CaSO4 + 6СO2 Al2(SO4)3 + ЗMg(НСO3)2 = 2Аl(ОН)3 + 3MgSO4
- 27. Хлопья же самого коагулянта адсорбируют коллоидные и мелкие взвешенные частицы и выпадают на дно, механически захватывая
- 28. Образование бокситов В 1821 г. французский химик Вернье впервые исследовал и описал встречающуюся близ города Ле
- 29. По внешнему виду бокситы представляют глиноподобную, а часто каменистую породу, иногда плотного, иногда пористого сложения. Для
- 30. Боксит
- 31. По одной из гипотез, бокситы являются продуктом выветривания древней коры с последующим механическим перемещением и переотложением
- 32. Схема Акад. А. Е. Ферсмана осаждения гидратов окиси алюминия из растворов алюминиевых солей при разных значениях
- 33. Из этой схемы видно, что алюминий растворяется лишь при очень высоких и при очень низких рН.
- 34. Боксит
- 36. Скачать презентацию
































 Методы определения сметной стоимости строительных работ
Методы определения сметной стоимости строительных работ Москва-третий Рим. Выполнил студент группы Э-101 Лапов Артем
Москва-третий Рим. Выполнил студент группы Э-101 Лапов Артем Культурная идентичность
Культурная идентичность Первое родительское собрание Ваш ребёнок идет в школу Муниципальное бюджетное общеобразовательное учреждение средняя общео
Первое родительское собрание Ваш ребёнок идет в школу Муниципальное бюджетное общеобразовательное учреждение средняя общео Содержание функций статистических показателей
Содержание функций статистических показателей Виды ран и общие правила оказания первой медицинской помощи
Виды ран и общие правила оказания первой медицинской помощи Портфолио Графический дизайн и визуальные решения. - презентация
Портфолио Графический дизайн и визуальные решения. - презентация Политическое сознание
Политическое сознание Система смазки и суфлирования
Система смазки и суфлирования Художественное воплощение образов Ф.М. Достоевского в творчестве И.С Глазунова.
Художественное воплощение образов Ф.М. Достоевского в творчестве И.С Глазунова.  Солнечные опреснительные установки
Солнечные опреснительные установки  Презентация на тему "СПИД" - скачать презентации по Медицине
Презентация на тему "СПИД" - скачать презентации по Медицине Новые технологии голосования & права человека
Новые технологии голосования & права человека Минутка «психиатрии»
Минутка «психиатрии» Знание (информация) по своей сути является возобновляемым ресурсом. Вы, я и миллион других людей можем воспользоваться одним и тем
Знание (информация) по своей сути является возобновляемым ресурсом. Вы, я и миллион других людей можем воспользоваться одним и тем  Западноевропейское искусство
Западноевропейское искусство Страйкбол. История страйкбола
Страйкбол. История страйкбола Прерафаэлиты для Кристины
Прерафаэлиты для Кристины I.От знания учебного предмета II.От знакомства с процедурой проведения экзамена III.От стратегии подготовки к экзамену IV.От психологи
I.От знания учебного предмета II.От знакомства с процедурой проведения экзамена III.От стратегии подготовки к экзамену IV.От психологи Презентация ИСТОРИЯ КОСТЮМА
Презентация ИСТОРИЯ КОСТЮМА  Этические требования к критике
Этические требования к критике Подача шампанского, сервировка
Подача шампанского, сервировка Человеческий капитал и персональные компетенции современного коммуникатора
Человеческий капитал и персональные компетенции современного коммуникатора Прогрессио – движение вперед! Проект подготовлен учителем математики МОУ – СОШ № 13 г. Балаково Склеминой Галиной Александровной
Прогрессио – движение вперед! Проект подготовлен учителем математики МОУ – СОШ № 13 г. Балаково Склеминой Галиной Александровной Тайна имени
Тайна имени Методы воспитания
Методы воспитания Индуктивные измерительные устройства
Индуктивные измерительные устройства Примерная основная образовательная программа - основа образовательной программы образовательного учреждения
Примерная основная образовательная программа - основа образовательной программы образовательного учреждения