Содержание
- 2. Ката́лиз (от греч. κατάλυσις, восходит к καταλύειν — разрушение) — явление изменения скорости химической или биохимической
- 3. На изменении активности ферментов в организме основана энзимодиагностика, энзимотерапия и биохимическая генетика. Энзимодиагностика позволяет определять болезнь
- 4. Катализа́тор — … …вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. В отношении катализатора
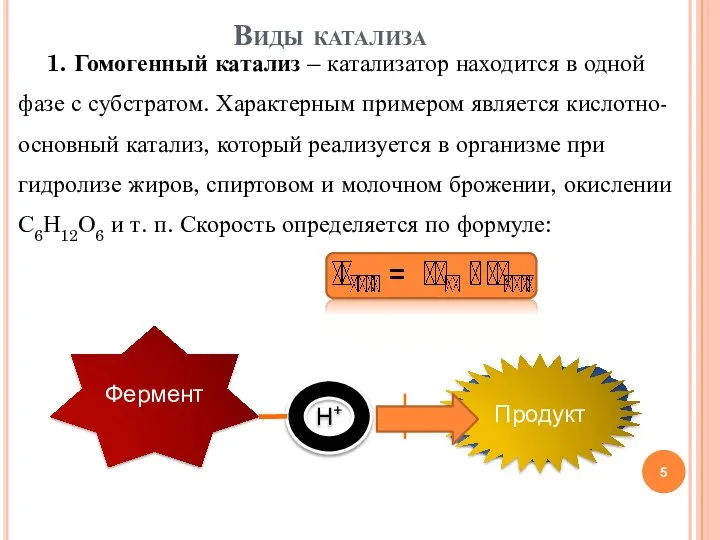
- 5. 1. Гомогенный катализ – катализатор находится в одной фазе с субстратом. Характерным примером является кислотно-основный катализ,
- 6. 2. Гетерогенный катализ – катализатор и субстрат находятся в разных фазах. Особенность таких катализаторов − наличие
- 7. 3. Ферментативный катализ (биокатализ) – ускорение биохимических реакций при участии белковых макромолекул, называемых ферментами (энзимами). Этот
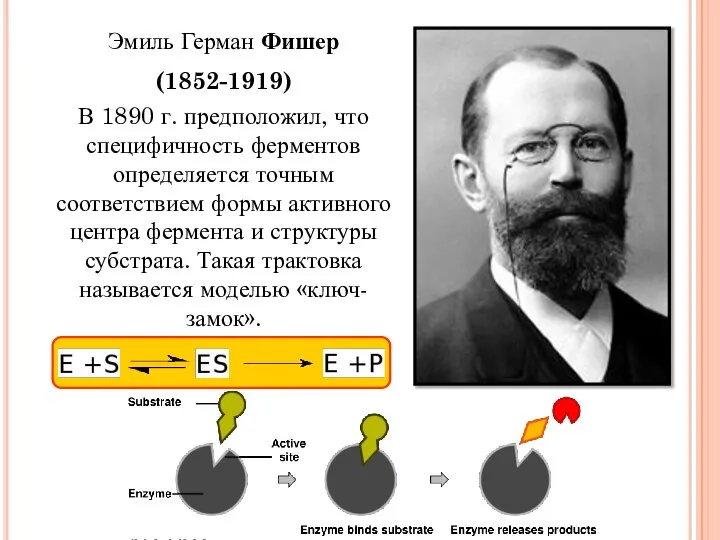
- 8. Эмиль Герман Фишер (1852-1919) В 1890 г. предположил, что специфичность ферментов определяется точным соответствием формы активного
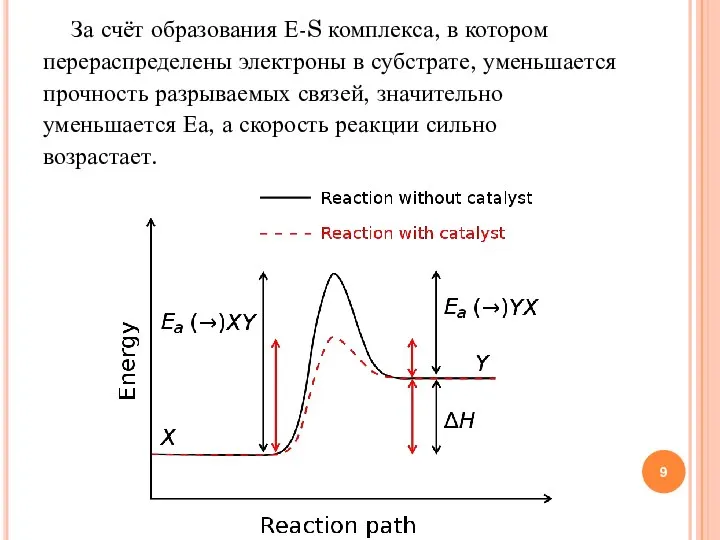
- 9. За счёт образования Е-S комплекса, в котором перераспределены электроны в субстрате, уменьшается прочность разрываемых связей, значительно
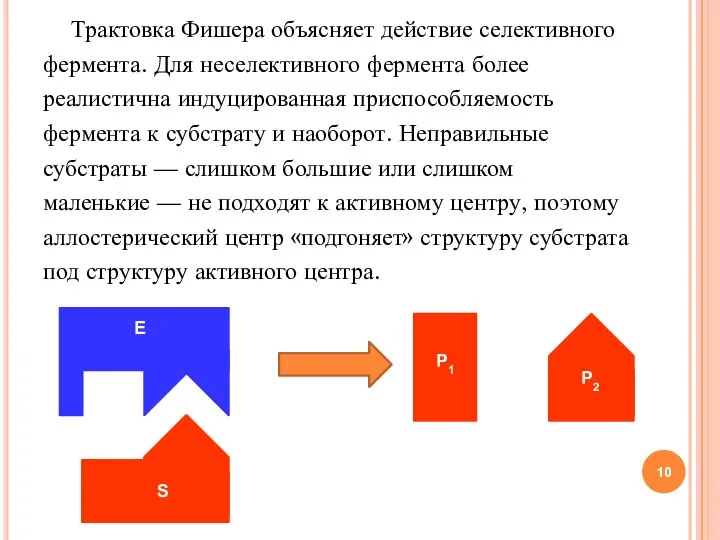
- 10. Трактовка Фишера объясняет действие селективного фермента. Для неселективного фермента более реалистична индуцированная приспособляемость фермента к субстрату
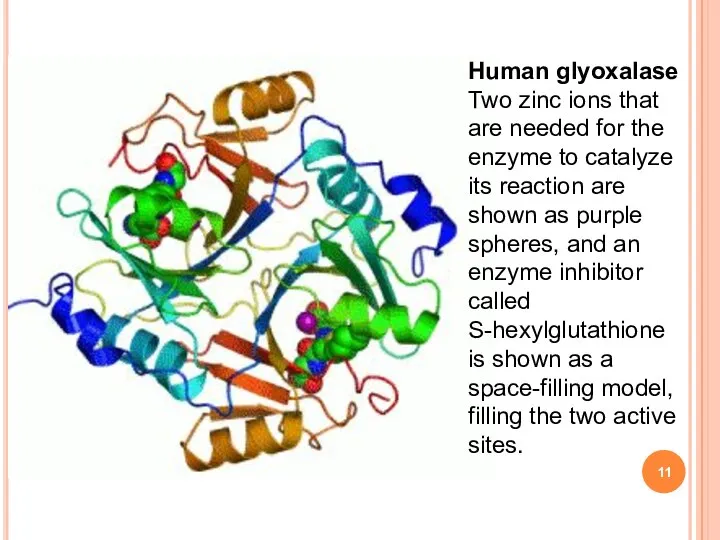
- 11. Human glyoxalase Two zinc ions that are needed for the enzyme to catalyze its reaction are
- 12. Elastase Protein Crystal Growth Porcine Elastase
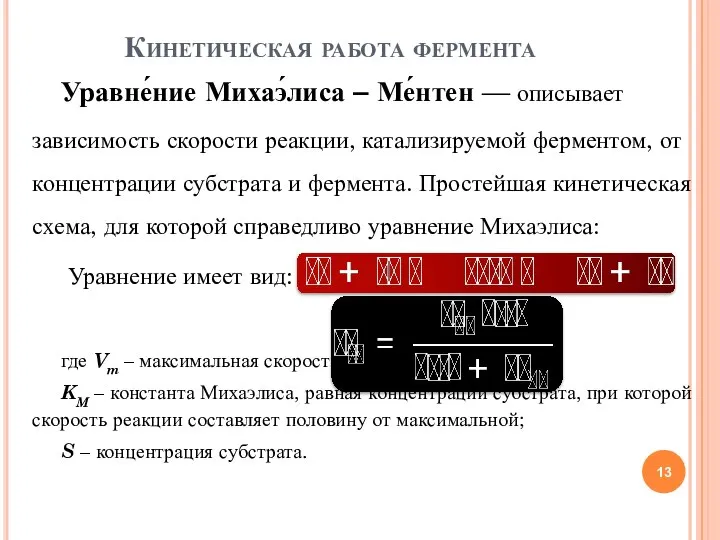
- 13. Уравне́ние Михаэ́лиса – Ме́нтен — описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента.
- 14. Графическое отображение уравнения Михаэлиса–Ментен При низких [S] − реакция I порядка; V=k[S] При высоких [S] −
- 15. Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее течение различных химических реакций. Ферментативный ингибитор
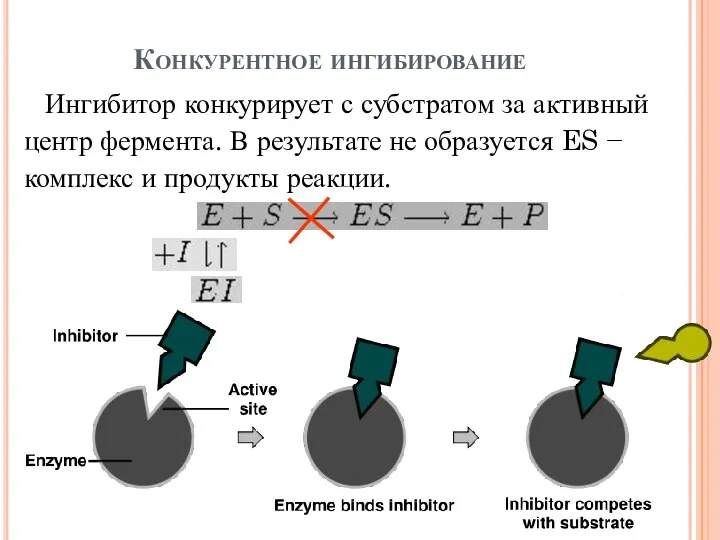
- 16. Конкурентное ингибирование Ингибитор конкурирует с субстратом за активный центр фермента. В результате не образуется ES −
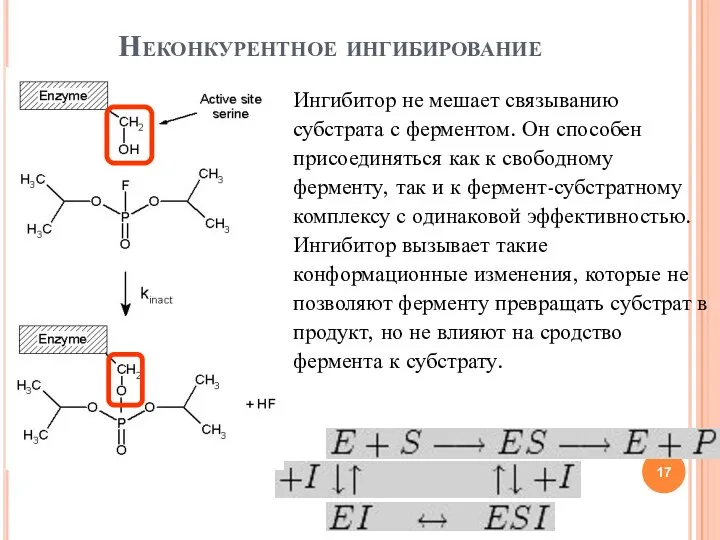
- 17. Неконкурентное ингибирование Ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту,
- 18. E I S E
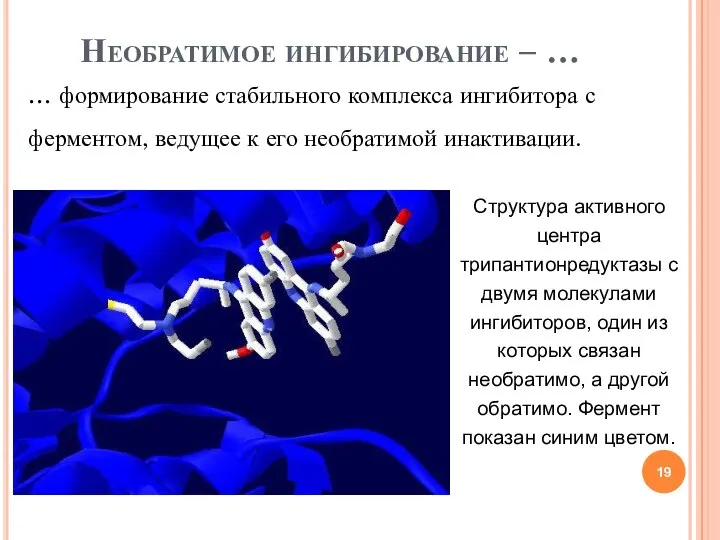
- 19. Необратимое ингибирование – … … формирование стабильного комплекса ингибитора с ферментом, ведущее к его необратимой инактивации.
- 21. Скачать презентацию






![Графическое отображение уравнения Михаэлиса–Ментен При низких [S] − реакция I порядка;](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304815/slide-13.jpg)


 Семейный фитнес-центр «СССР»
Семейный фитнес-центр «СССР» Презентация "Сочинение по картине Федора Александровича Васильева «Мокрый луг»" - скачать презентации по МХК
Презентация "Сочинение по картине Федора Александровича Васильева «Мокрый луг»" - скачать презентации по МХК Конструкторская документация
Конструкторская документация Цифровые технологии печати
Цифровые технологии печати Международный финансовый рынок
Международный финансовый рынок Деньги, кредит, банки
Деньги, кредит, банки  Биология в искусстве. Интеллектуальный марафон "Биологическое соцветие"
Биология в искусстве. Интеллектуальный марафон "Биологическое соцветие" Дефініція мистецтва, як відкритого поняття
Дефініція мистецтва, як відкритого поняття Система отчисления чаевых для сотрудника iPay
Система отчисления чаевых для сотрудника iPay Top Ten Culture Shocks in Korea
Top Ten Culture Shocks in Korea Культура Київської Русі
Культура Київської Русі Нормальная аэродинамическая схема
Нормальная аэродинамическая схема ОЗЕРА
ОЗЕРА  kp_student
kp_student Монеты
Монеты Налог на прибыль организации
Налог на прибыль организации У краіне майстроў
У краіне майстроў RAZMINKA_05_chto_eto
RAZMINKA_05_chto_eto международный день птиц - презентация для начальной школы
международный день птиц - презентация для начальной школы Презентация на тему "Ошибки ставшие откытиями" - скачать презентации по Педагогике
Презентация на тему "Ошибки ставшие откытиями" - скачать презентации по Педагогике Марина Цветаева
Марина Цветаева Самоуправление в школе
Самоуправление в школе Презентация Дальневосточный Федеральный округ
Презентация Дальневосточный Федеральный округ Презентация "Проблемы города" - скачать презентации по Экономике
Презентация "Проблемы города" - скачать презентации по Экономике Выявление причин не включения компрессора на одной из секции электропоезда ЭТ2М
Выявление причин не включения компрессора на одной из секции электропоезда ЭТ2М Художественная культура античности. Древний Рим
Художественная культура античности. Древний Рим Иконопись. Изобразительное искусство Средневековой Руси
Иконопись. Изобразительное искусство Средневековой Руси Челси-Лестер
Челси-Лестер