Содержание
- 2. Критерии равновесия Для химической реакции общего вида aA + bB ↔ xX + yY состояние равновесия
- 3. Критерии равновесия Для постоянного давления и температуры: ΔH = TΔS, тогда Δ G = 0. С
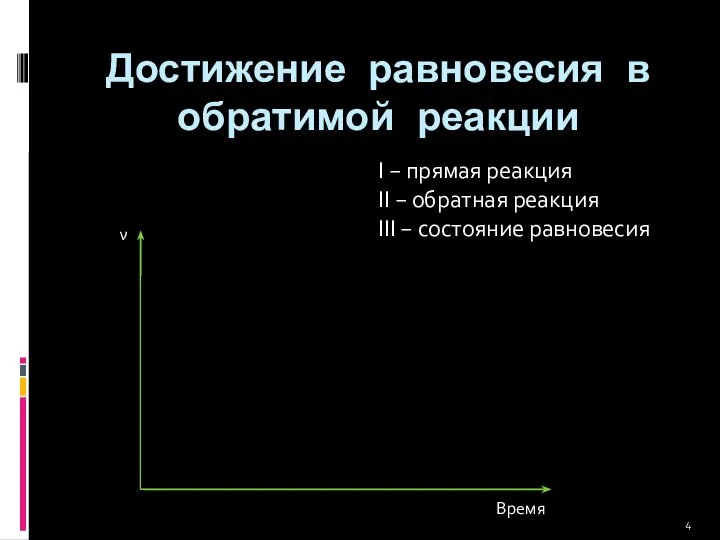
- 4. Достижение равновесия в обратимой реакции Время ν I II III I − прямая реакция II −
- 5. Уравнение изотермы химической реакции Для процесса в общем виде: В положении равновесия Якоб Хендрик Вант-Гофф (1852-1911)
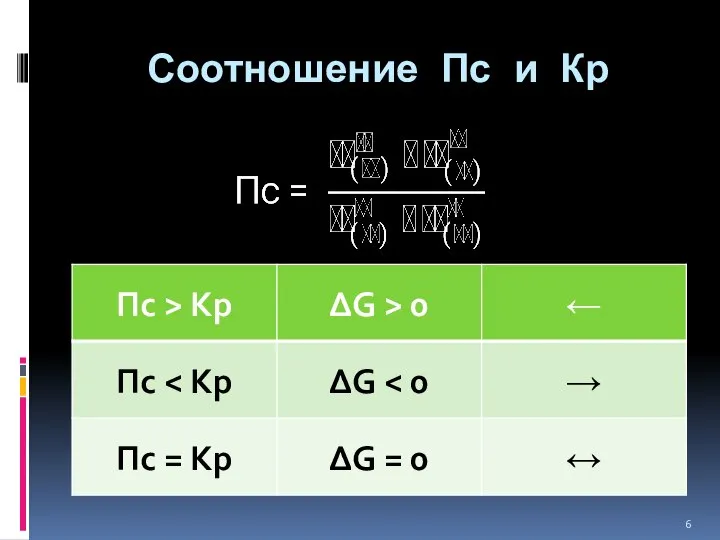
- 6. Соотношение Пс и Кр
- 7. Принцип подвижного равновесия При изменении одного из условий химического равновесия оно смещается в сторону той реакции,
- 8. Уравнение изобары химической реакции Ограничение: ΔТ − должна быть небольшой.
- 9. Влияние давления на смещение равновесия Δn = (x + y) − (a + b) Δn −
- 11. Скачать презентацию






 Сердечная недостаточность
Сердечная недостаточность ГОС кредит
ГОС кредит Стереотип и дискриминация как формы межкультурного конфликта и пути их преодоления
Стереотип и дискриминация как формы межкультурного конфликта и пути их преодоления Концепции современного естествознания
Концепции современного естествознания Изображения - виды, разрезы, сечения
Изображения - виды, разрезы, сечения DeutschSprechen: Anfänger
DeutschSprechen: Anfänger Требования, предъявляемые к выбору каналов сбыта в международном маркетинге
Требования, предъявляемые к выбору каналов сбыта в международном маркетинге  Основы программирования
Основы программирования География в танце. (Часть 2)
География в танце. (Часть 2) Банковская система,ее структура и функции
Банковская система,ее структура и функции  Документационное обеспечение редакционно-издательской деятельности
Документационное обеспечение редакционно-издательской деятельности Нанотехнологии в электронике и технике
Нанотехнологии в электронике и технике Человек и его внутренний мир
Человек и его внутренний мир  Презентация "Символика Древнего Египта" - скачать презентации по МХК
Презентация "Символика Древнего Египта" - скачать презентации по МХК Поняття циклу. Оператори циклу. Виклик функції
Поняття циклу. Оператори циклу. Виклик функції Когда командует словарь
Когда командует словарь Хімія у вирішенні промислової проблеми
Хімія у вирішенні промислової проблеми Кинематика точки
Кинематика точки Грамматика, как раздел языкознания
Грамматика, как раздел языкознания Двигатели внутреннего сгорания. История науки и техники. Часть 3,
Двигатели внутреннего сгорания. История науки и техники. Часть 3, Проектный офис "Революция изнутри"
Проектный офис "Революция изнутри" Дифференцированное обучение учащихся с разной функциональной асимметрией полушарий
Дифференцированное обучение учащихся с разной функциональной асимметрией полушарий Аналитическое распределение бюджетных ассигнований по проектам государственных программ Российской Федерации
Аналитическое распределение бюджетных ассигнований по проектам государственных программ Российской Федерации 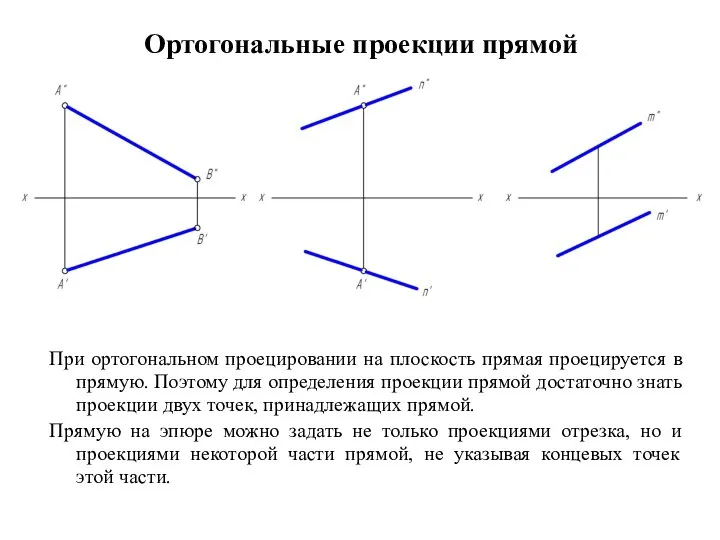 Ортогональные проекции прямой
Ортогональные проекции прямой Різдвяні традиції. Кутя
Різдвяні традиції. Кутя Резьбовые соединения
Резьбовые соединения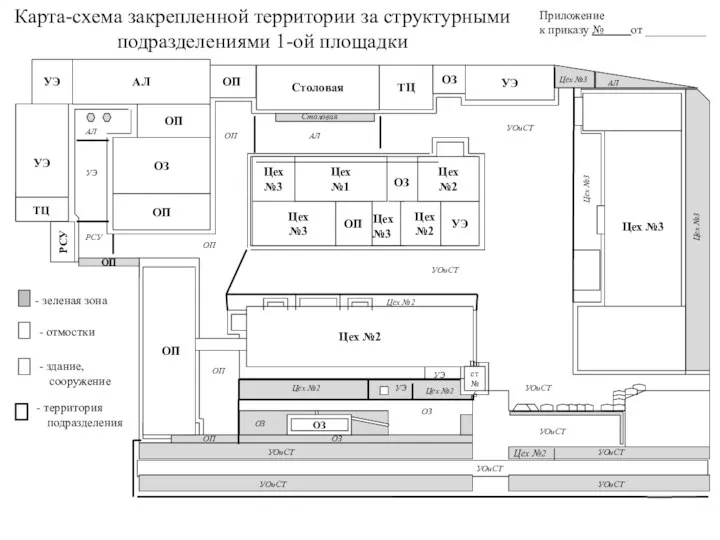 Карта-схема закрепленной территории за структурными подразделениями 1-ой площадки
Карта-схема закрепленной территории за структурными подразделениями 1-ой площадки Биохимия
Биохимия