Содержание
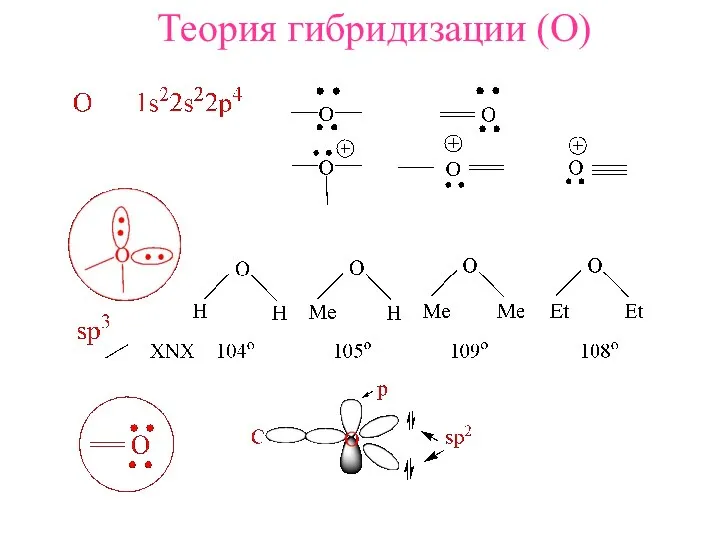
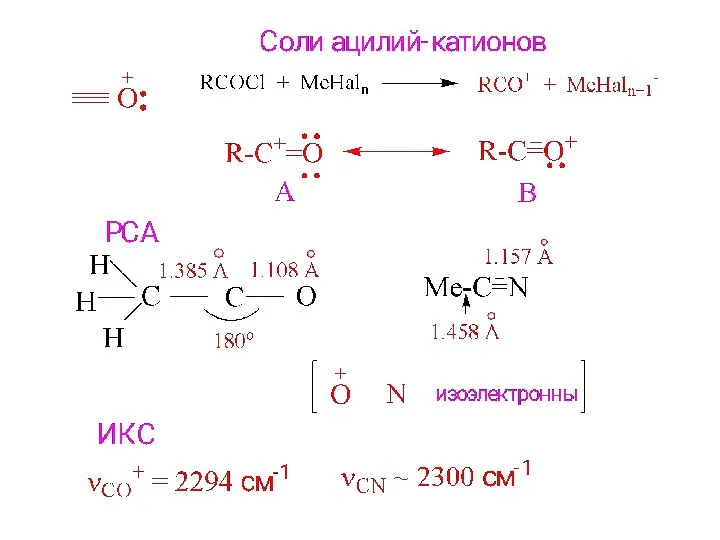
- 2. Теория гибридизации (O)
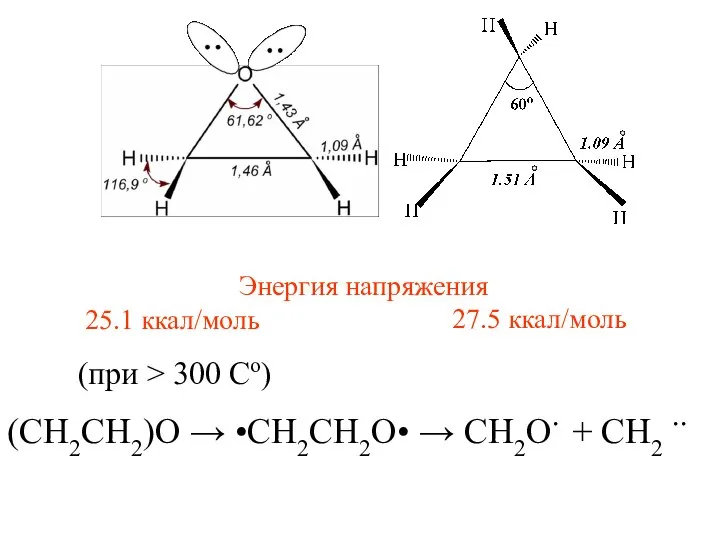
- 3. Энергия напряжения 25.1 ккал/моль 27.5 ккал/моль (при > 300 Сo) (CH2CH2)O → •CH2CH2O• → CH2O. +
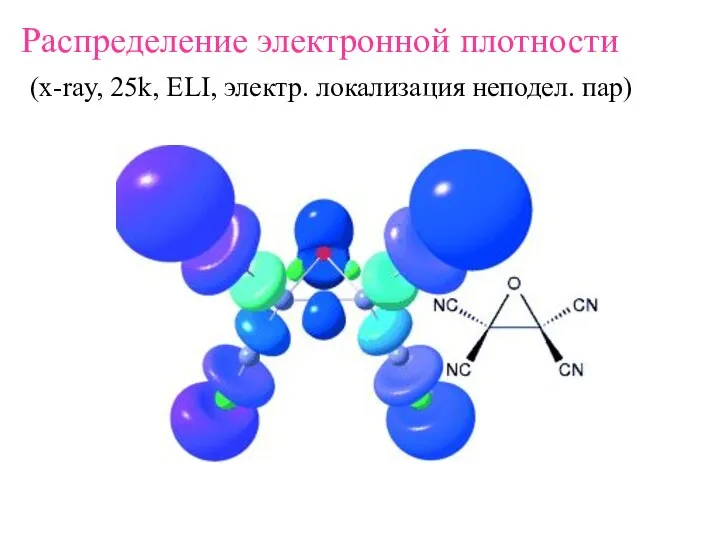
- 4. Распределение электронной плотности (x-ray, 25k, ELI, электр. локализация неподел. пар)
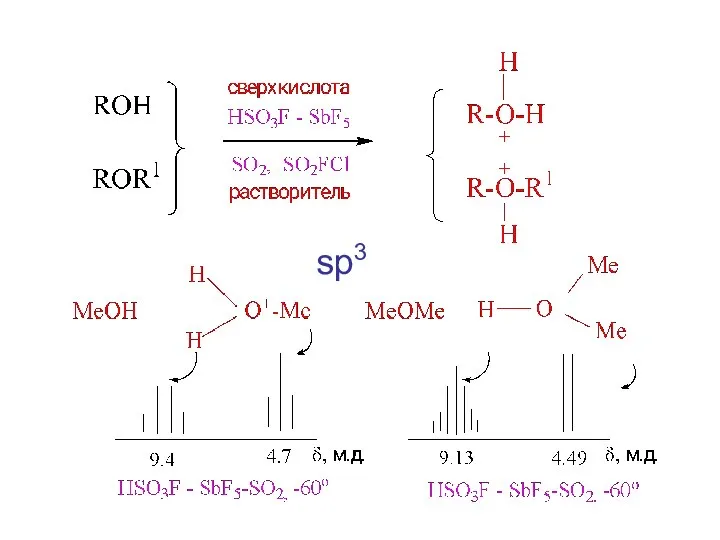
- 6. sp3
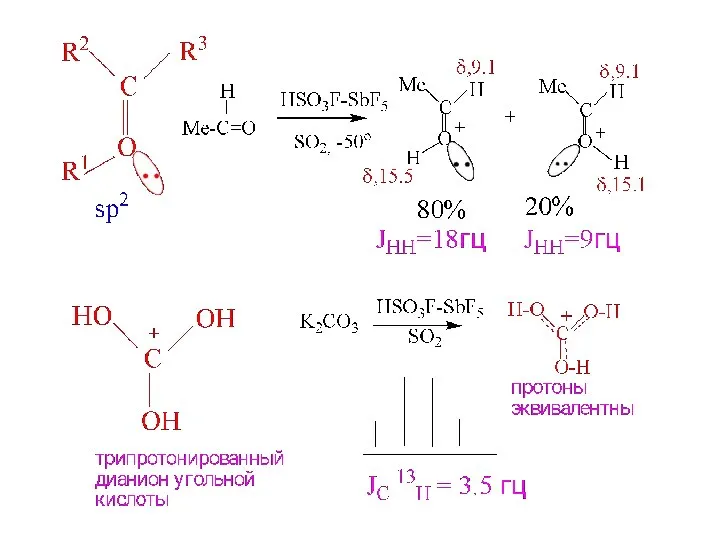
- 8. ЯМР 1Н
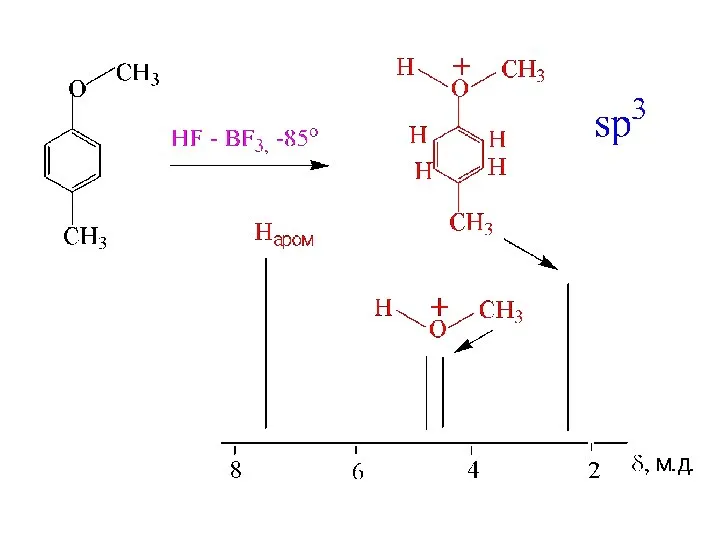
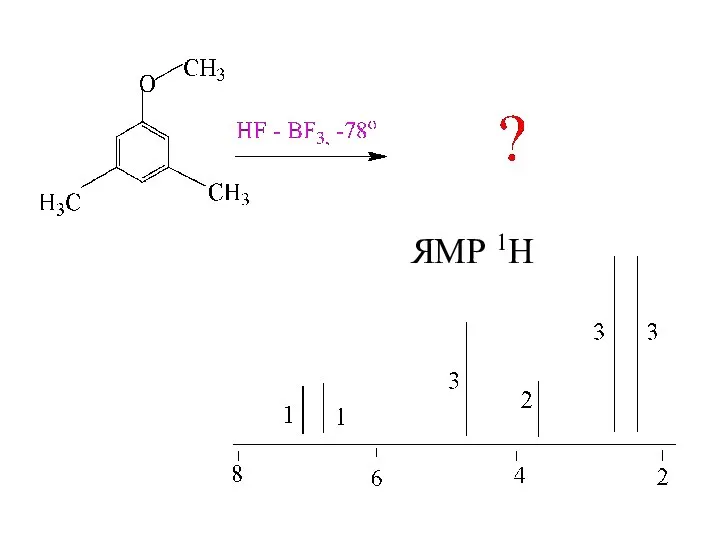
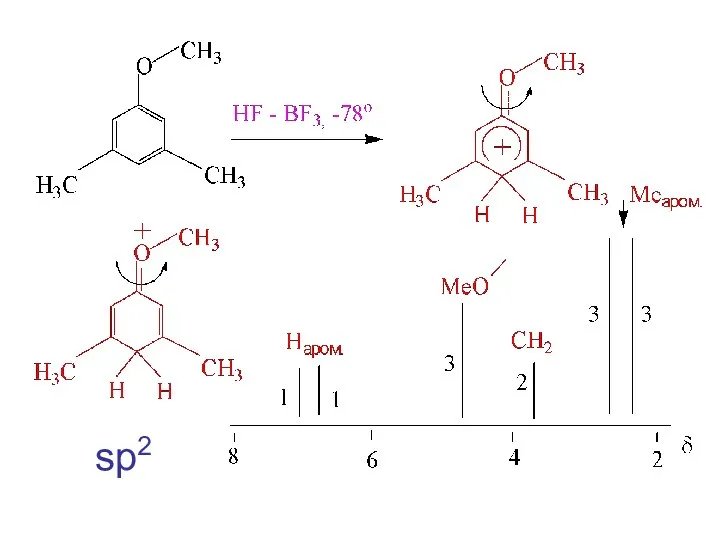
- 9. sp2
- 12. Галогенониевые ионы R-Hal+-R J+ Br+ Cl+ Ip, eV 10.5 11.8 13.0 17.4 J Br Cl F
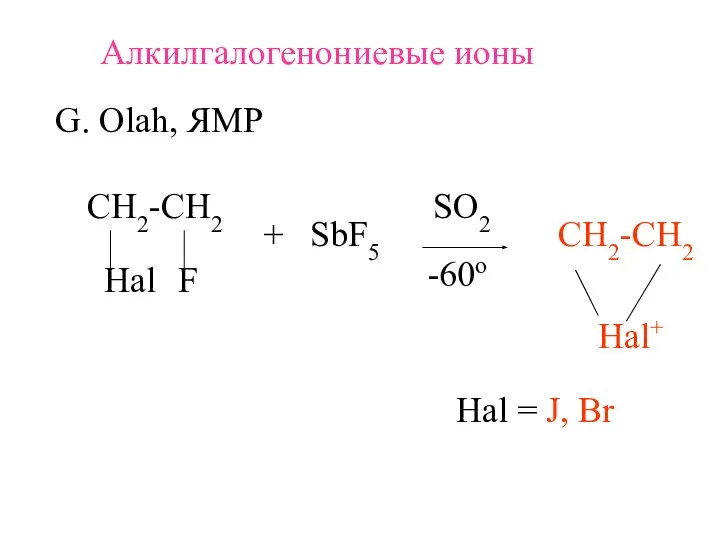
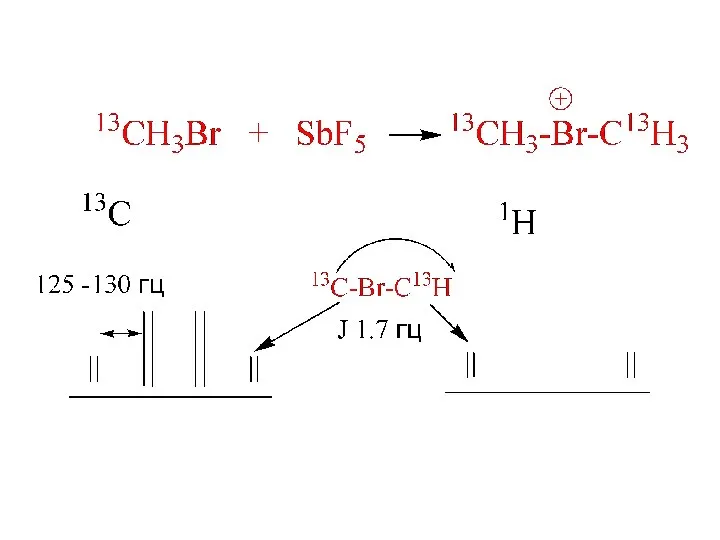
- 13. Алкилгалогенониевые ионы G. Olah, ЯМР СH2-CH2 Hal F + SbF5 SO2 -60o СH2-CH2 Hal+ Hal =
- 14. 2 AlkHal + SbF5 SbF5 SO2, -60o [AlkHal+Alk] SbF5Hal- Hal = J, Br, Cl AlkHal+Alk или
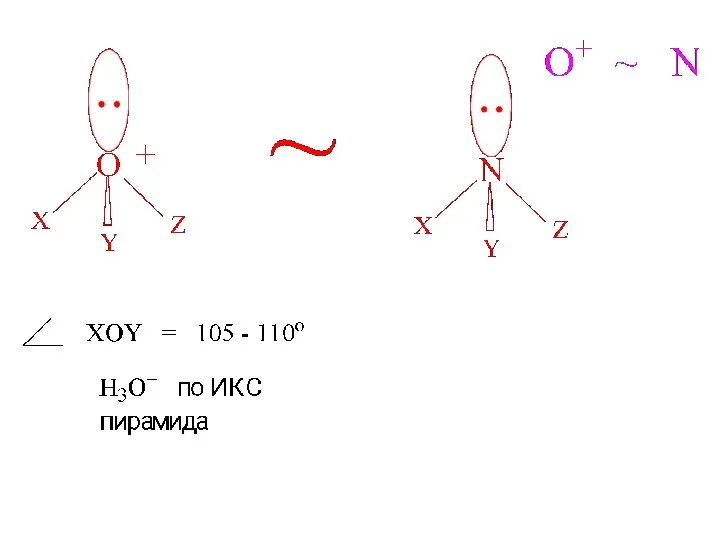
- 16. 3-ий и более периоды ? 2-ой период NH3 OH2 107o 104o 3-ий период PH3 SH2 94o
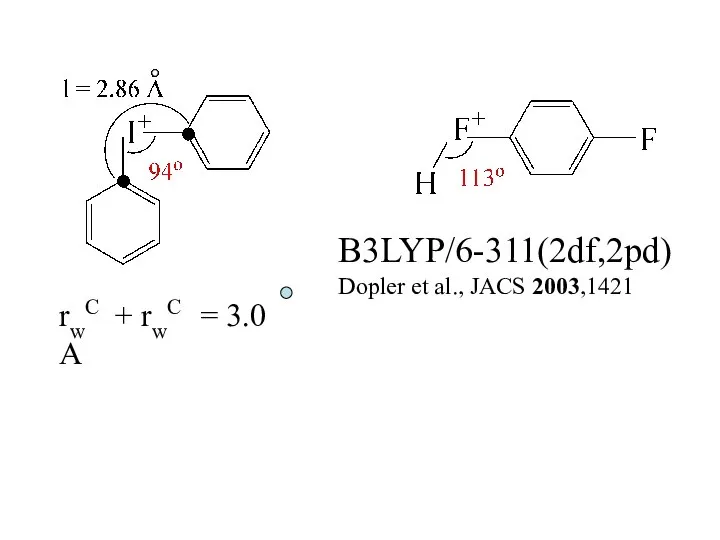
- 17. B3LYP/6-311(2df,2pd) Dopler et al., JACS 2003,1421 rwC + rwC = 3.0 A
- 18. Нет склонности к инверсии (P, As, Sb) ΔG = ккал/моль (ab initio) NH3 6 H3O 1-2
- 19. Оптические антиподы Alk1-P-Alk2 Ar Alk1-As-Alk2 Ar Alk1-Sb-Alk2 Ar [α] +255o не рацемизуется при 110о R1-S+-R2 R3
- 21. Скачать презентацию

![2 AlkHal + SbF5 SbF5 SO2, -60o [AlkHal+Alk] SbF5Hal- Hal =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304051/slide-13.jpg)


![Оптические антиподы Alk1-P-Alk2 Ar Alk1-As-Alk2 Ar Alk1-Sb-Alk2 Ar [α] +255o не](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304051/slide-18.jpg)
 Parametric Linear Programming
Parametric Linear Programming Страшный суд
Страшный суд Презентация на тему "Использование ИКТ на уроках обществознания (область «право»)" - скачать презентации по Педагогике
Презентация на тему "Использование ИКТ на уроках обществознания (область «право»)" - скачать презентации по Педагогике Прямая и плоскость
Прямая и плоскость  Одеський обласний осередок “Демократичного Альянсу”. Звіт про діяльність осередку
Одеський обласний осередок “Демократичного Альянсу”. Звіт про діяльність осередку Культурологическая теория Н.Я. Данилевского
Культурологическая теория Н.Я. Данилевского Открытое занятие «Введение в дополнительную образовательную программу»
Открытое занятие «Введение в дополнительную образовательную программу» Инновационная политика и научные технологии в системе ГРЭ Подготовили студенты гр. Т-091 Шабан К., Корженевский А., Королевич А., Вани
Инновационная политика и научные технологии в системе ГРЭ Подготовили студенты гр. Т-091 Шабан К., Корженевский А., Королевич А., Вани Отчет по производственной практике г. Когалым ПАО “ЛУКОЙЛ". Синхронные электродвигатели привода насосов
Отчет по производственной практике г. Когалым ПАО “ЛУКОЙЛ". Синхронные электродвигатели привода насосов Аттестационная работа. Значимость конструкторской и проектноисследовательской деятельности в учебных программах по робототехни
Аттестационная работа. Значимость конструкторской и проектноисследовательской деятельности в учебных программах по робототехни Город Будущего. Город Взаимозависимости
Город Будущего. Город Взаимозависимости Презентация Металлоизделия
Презентация Металлоизделия Алтернативни извори на енергија Хидроген Сончева енергија Ветер Етанол Биодизел
Алтернативни извори на енергија Хидроген Сончева енергија Ветер Етанол Биодизел Перспектива – вид центральной проекции
Перспектива – вид центральной проекции Буддизм
Буддизм Представления древних людей о вселенной
Представления древних людей о вселенной Презентация Анализ внешней и внутренней среды поставок ГМК "Норильский никель"
Презентация Анализ внешней и внутренней среды поставок ГМК "Норильский никель" Спеціалізована арендна дільниця з ремонту холодильної техніки з розробкою технологічного процесу
Спеціалізована арендна дільниця з ремонту холодильної техніки з розробкою технологічного процесу Принцип работы сканирующих зондовых микроскопов. Пьезокерамические сканеры.
Принцип работы сканирующих зондовых микроскопов. Пьезокерамические сканеры. Развитие гибкости
Развитие гибкости Новгородский областной колледж искусств им. С.В. Рахманинова
Новгородский областной колледж искусств им. С.В. Рахманинова Золотые руки мастеров. Труд на Руси (для дошкольников)
Золотые руки мастеров. Труд на Руси (для дошкольников) викторина животные - презентация для начальной школы
викторина животные - презентация для начальной школы Основы JDBC (Java DataBase Connectivity)
Основы JDBC (Java DataBase Connectivity) Использование информационно-коммуникационных технологий на уроках русского языка как средство развития универсальных умений
Использование информационно-коммуникационных технологий на уроках русского языка как средство развития универсальных умений  Процессы, приводящие к потере автомобилей работоспособности
Процессы, приводящие к потере автомобилей работоспособности Статические модели объектно-ориентированных программных систем
Статические модели объектно-ориентированных программных систем Смертная казнь, как высшая мера наказания
Смертная казнь, как высшая мера наказания