Содержание
- 2. Компоненты характеризуются высоким кларком, но низкой растворимостью солей, или небольшим кларком, но хорошей растворимостью. Средние содержания
- 3. Карбонат-ион (CO32-). Поскольку для большинства природных вод характерна среда, близкая к нейтральной, ион является достаточно редким.
- 4. Бром (Br-). Все соли, кроме AgBr хорошо растворимы: NaBr – 905 г/кг при 20о; 1210 при
- 5. Основной механизм концентрирования - испарительная концентрация. При испарении океанской воды в лагунах бром накапливается одновременно с
- 6. Начинается закономерное уменьшение хлор-бромного коэффициента, снижающегося на последних стадиях упаривания морской воды до значений 30–50. В
- 7. Другим источником брома в подземных водах может являться органическое вещество. Образующиеся из органики в соленых водах
- 8. Иод (I–). В природных водах преобладает I-; Все иодиды кроме AgI хорошо растворимы. NaI – 1787
- 9. Содержание иода в океанской воде составляет ~0,05 мг/кг. Даже на самых последних стадиях ее упаривания концентрация
- 10. Содержение иода в природных объектах. атмосфера: 1.10-8 – 1.10-6 г/м3; породы: магматические – n.10-5 – n.10-6
- 11. Переход значительных количеств иода из пород, содержащих органическое вещество, в подземные воды Лучше всего осуществляется в
- 12. Иод-131 (131I) Также называемый радиойодом (несмотря на наличие других радиоактивных изотопов этого элемента). Период его полураспада
- 13. Авария на АЭС Фукусима I в марте 2011 Вызвала значительный рост содержания 131I в продуктах питания,
- 14. У человека большая часть йода в организме концентрируется в щитовидной железе, имеющей небольшую массу по сравнению
- 15. Месторождения иодных вод. Западная Сибирь. Япония. Сахалин. Камчатка. Северо-запад России. Промышленная добыча иода. Мировое производство иода
- 16. Фтор (F–). Значительно менее распространен в природных водах, чем остальные галоиды. Растворимость фторидов ниже, чем хлоридов,
- 17. Важное отличие фтора от других галоидов – низкая растворимость его соединения с Са (флюорита) Составляет по
- 18. Растворимость повышается в щелочной и кислой средах: CaF2 + 2H + –––> Ca 2+ +2HF CaF2
- 19. ПДК : 0,7 мг/л. Содержание фтора выше и ниже этих концентраций вызывает разрушение зубной эмали, и
- 20. Антифлюорозное действие – кальций Причина – образование комплексов с кальцием. Соединения кальция способствуют выделению фтора из
- 21. Нитраты (NO3- ). Высокая растворимость всех солей. NaNO3 при 20о – 875 г/кг, при 100о –
- 22. Чаще всего нитраты – показатель органического загрязнения. В грунтовых водах часто встречаются значительные количества нитратов. Главная
- 23. Нитриты (NO2- ). Хорошо растворимы; NaNO2 при 20о – 845 г/кг, при 100о 1630. Присутствие в
- 24. Стронций (Sr2+). Растворимость SrCl2 – 530 г/кг при 20о, 1008 при 100о. Слабо растворимы сульфаты (целестин
- 25. «Стронциевая проблема» относится, прежде всего, к территориям гипсоносных фаций, в которых в парагенезисе с гипсом и
- 26. Другой процесс накопления стронция в подземных водах –упаривание морской воды Содержание стронция в морской воде около
- 27. Аммоний (NH4+). Растворимость аммонийных солей высокая (NH4Cl – 375 г/кг при 20о и 773 при 100о).
- 28. В нефтегазоносных районах наблюдаются повышенные концентрации NH4+ в водах глубоких водоносных горизонтов Они могут формироваться в
- 29. Железо (Fe2+ , Fe3+). Источники железа – сульфиды, окислы, гидроокислы. Несмотря на то, что примеси железа
- 30. Концентрации двухвалентного железа регулируются рН, СО2, органическим веществом. Некоторые регулирующие равновесия: FeS2 + 2H2O + 3O2
- 32. Скачать презентацию





























 Многозональные вытяжные вентиляторы
Многозональные вытяжные вентиляторы 11 класс
11 класс  Формы государства. Политика
Формы государства. Политика Богослужения суббот Великого поста
Богослужения суббот Великого поста Аполлон и Дафна
Аполлон и Дафна Культура и информатизация
Культура и информатизация  Бетон
Бетон Декоративно – прикладное искусство в жизни человека. Лоскутное шитье. (5 класс) Учитель – технологии Лисичкина Зинаида Алекс
Декоративно – прикладное искусство в жизни человека. Лоскутное шитье. (5 класс) Учитель – технологии Лисичкина Зинаида Алекс Деловая культура Кореи
Деловая культура Кореи (з†бвм-ѓа®ЂЃ¶•≠®•)-КРУГИ ЭЙЛЕРА
(з†бвм-ѓа®ЂЃ¶•≠®•)-КРУГИ ЭЙЛЕРА Презентация на тему "Семинар Методы и формы организации контроля усвоения учащимися учебного материала" - скачать презентаци
Презентация на тему "Семинар Методы и формы организации контроля усвоения учащимися учебного материала" - скачать презентаци лек9структур05прогр
лек9структур05прогр  Международные отношения на современном этапе
Международные отношения на современном этапе Зона комфорта
Зона комфорта  Виктор Михайлович Васнецов
Виктор Михайлович Васнецов Формирование современной городской среды. Город Глазов 2018-2022 годы. Общественная территория «Сквер у музыкальной школы»
Формирование современной городской среды. Город Глазов 2018-2022 годы. Общественная территория «Сквер у музыкальной школы» Теория культур Эдварда Холла
Теория культур Эдварда Холла Parallel programming technologies on hybrid architectures
Parallel programming technologies on hybrid architectures Марченко Мария, 8 «В»
Марченко Мария, 8 «В»  Презентация на тему "Технология проблемного обучения. Метапредметный подход" - скачать презентации по Педагогике
Презентация на тему "Технология проблемного обучения. Метапредметный подход" - скачать презентации по Педагогике Психические познавательные процессы
Психические познавательные процессы Жостовская роспись
Жостовская роспись О маркетинге. О книгах. О принципах. Игорь Манн
О маркетинге. О книгах. О принципах. Игорь Манн Теория и практика решения кейсов по корпоративному праву
Теория и практика решения кейсов по корпоративному праву Политическое сознание
Политическое сознание Государственные и заказы на муниципальном уровне
Государственные и заказы на муниципальном уровне Первый день творения
Первый день творения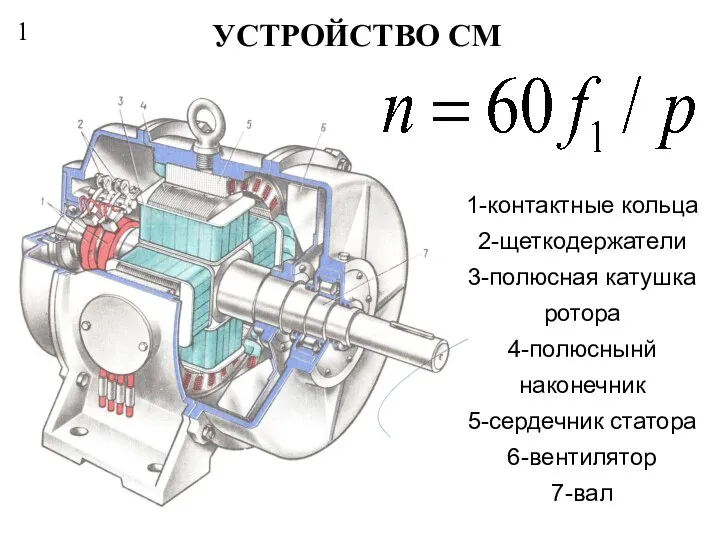 Устройство СМ
Устройство СМ