Содержание
- 2. Два подхода к квантово-химическому описанию межмолекулярных взаимодействий. 1) Проводится вариационный расчет комплекса АВС… и составляющих его
- 3. Величина суперпозиционной ошибки при расчете энергии межмолекулярного взаимодействия 2) Используется теория возмущений: отдельные молекулы описывают гамильтонианами
- 4. Уравнение Шредингера приобретает вид: (НА+НВ) ΨАnΨВm = (ЕАn+ЕВm) ΨАnΨВm Квантовые числа n и m характеризуют состояния
- 5. Выражение для поляризационной энергии имеет вид Индукционная энергия Еинд отвечает взаимодействию невозмущенной молекулы А с поляризованной
- 6. На больших расстояниях между молекулами R их электронные плотности перекрываются слабо, и каждый из перечисленных вкладов
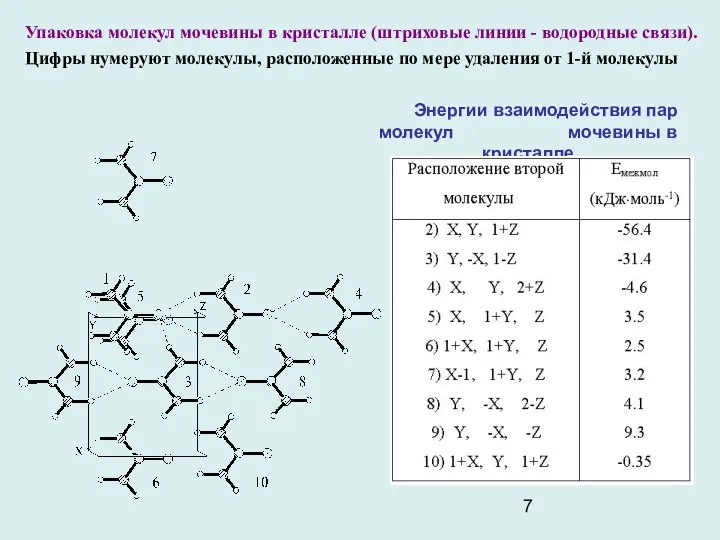
- 7. Упаковка молекул мочевины в кристалле (штриховые линии - водородные связи). Цифры нумеруют молекулы, расположенные по мере
- 8. Приближенные схемы для больших молекул (биологические и фармакологические задачи) 1. Молекулярный комплекс разбивается на молекулярные фрагменты,
- 9. Оценка ван-дер-ваальсовых атомных радиусов Когда молекулы в кристалле или жидкости связаны лишь ван-дер-ваальсовыми силами, то расстояния
- 10. Донорно-акцепторные молекулярные комплексы Молекулярные комплексы - группы связанных между собой молекул. В них одни из молекул,
- 11. Энергия взаимодействия донора и акцептора ΔЕ геом , ΔЕ эл, ΔЕ обм, ΔЕ поляр, ΔЕ перенос
- 12. Комплексы с переносом заряда например, являются высокопроводящими твердыми органическими материалами. Одно из таких соединений – соль
- 13. Водородная связь Атом Н обладает особой способностью образовывать внутри и между молекулами мостиковые связи X-H∙∙∙Y, соединяясь
- 14. Общий подход к описанию Н-связи не отличается от такового в случае межмолекулярных взаимодействий. Здесь также выделяют
- 15. Сильная Н-связь: небольшая поляризация ЭП неподеленной пары атома О3 к атому Н1 плюс (в результате интерференции
- 16. Специфические невалентные взаимодействия В органических (и металлоорганических кристаллах) кратчайшие расстояния между соседними молекулами меньше, чем сумма
- 17. Структура кристаллического хлора Лапласиан ЭП в кристалле Cl2 (HF 6.21G*)
- 18. Лапласиан ЭП в димере (Cl2)2 (HF 6.311G*)
- 20. Скачать презентацию
Два подхода к квантово-химическому описанию межмолекулярных взаимодействий.
1) Проводится вариационный расчет
Два подхода к квантово-химическому описанию межмолекулярных взаимодействий.
1) Проводится вариационный расчет
Е(АВС…) - [Е(А)+Е(В)+Е(С)+…]
равна ~1% полной энергии и для ее расчета необходим учет электронной корреляции и широкий базисный набор, близкий к ХФ пределу.
Суперпозиционная ошибка базиса (basis set superpositional error - BSSE) является результатом использования более широкого набора базисных функций, относящихся ко всем молекулам, по сравнению с базисом, в котором рассчитывалась каждая молекула в отдельности. Она ведет к искусственно занижению энергии комплекса, т.е. к завышенной энергии взаимодействия. Чтобы исправить эту ошибку, энергию отдельной молекулы рассчитывают, включая в базис функции, центрированные на атомных центрах соседних молекул, полагая при этом, что заряды ядер последних равны нулю и беря число электронов равным таковому в рассматриваемой молекуле.
Величина суперпозиционной ошибки при расчете энергии межмолекулярного взаимодействия
2) Используется теория
Величина суперпозиционной ошибки при расчете энергии межмолекулярного взаимодействия
2) Используется теория
Н0= НА + НВ ( а и в - ядра, i и j – электроны). На расстояниях R>7А обменом можно пренебречь и волновая функция комплекса Ψ есть произведение волновых функций молекул ΨА и ΨВ.
Уравнение Шредингера приобретает вид:
(НА+НВ) ΨАnΨВm = (ЕАn+ЕВm) ΨАnΨВm
Квантовые числа
Уравнение Шредингера приобретает вид:
(НА+НВ) ΨАnΨВm = (ЕАn+ЕВm) ΨАnΨВm
Квантовые числа
Энергия прямого электростатического взаимодействия невозмущенных молекул определяется нулевым порядком теории возмущений: Е0=<ΨАnΨВm⎮V⎮ΨАnΨВm> Это среднее значение оператора возмущения, вычисленное с невозмущенными волновыми функциями. Через электронные плотности:
электрон-ядерное взаимодействие
электрон-электронное
и ядер-ядерное взаимодействия
Вклады в энергию межмолекулярного взаимодействия, связанные со взаимной поляризацией молекул, описываются первым и вторым порядками теории возмущений.
Выражение для поляризационной энергии имеет вид
Индукционная энергия Еинд отвечает взаимодействию невозмущенной
Выражение для поляризационной энергии имеет вид
Индукционная энергия Еинд отвечает взаимодействию невозмущенной
На больших расстояниях между молекулами R их электронные плотности перекрываются слабо,
На больших расстояниях между молекулами R их электронные плотности перекрываются слабо,
Кристаллохимический дизайн. Задача - конструирование новых веществ с заданными свойствами. Необходимое условие - адекватное понимание картины межмолекулярных взаимодействий, определяющее упаковку молекул в кристалле. Пример мочевины CO(NH2)2 , легко образующей комплексы с различными молекулами и обладающей в кристалле нелинейными оптическими свойствами. Молекулы расположены парами «голова к хвосту», образуя за счет водородных связей ленты вдоль оси с тетрагональной кристаллической ячейки. Плоскость каждой ленты перпендикулярна плоскости другой ленты, ориентированной в противоположном направлении. Расчет объясняет причину такой организации кристалла. Расчет дает ЕМЕЖМОЛ -90,5 кДж⋅моль-1, близкую к экстраполированной к 0 К энергии сублимации кристалла мочевины 98,6 кДж⋅моль-1.
Упаковка молекул мочевины в кристалле (штриховые линии - водородные связи). Цифры
Упаковка молекул мочевины в кристалле (штриховые линии - водородные связи). Цифры
Энергии взаимодействия пар молекул мочевины в кристалле
Приближенные схемы для больших молекул (биологические и фармакологические задачи)
1. Молекулярный
Приближенные схемы для больших молекул (биологические и фармакологические задачи)
1. Молекулярный
2. Базис составляют из локализованных гибридных АО (большое число многоцентровых интегралов в методе ССП становится пренебрежимо малым по величине), к ним добавляют функции, центрированные на связях. Взаимодействие описывается с помощью теории возмущений, что автоматически учитывает электронную корреляцию. Для приемлемой оценки ЕМЕЖМОЛ достаточно ограничиться 3-им порядком теории возмущений.
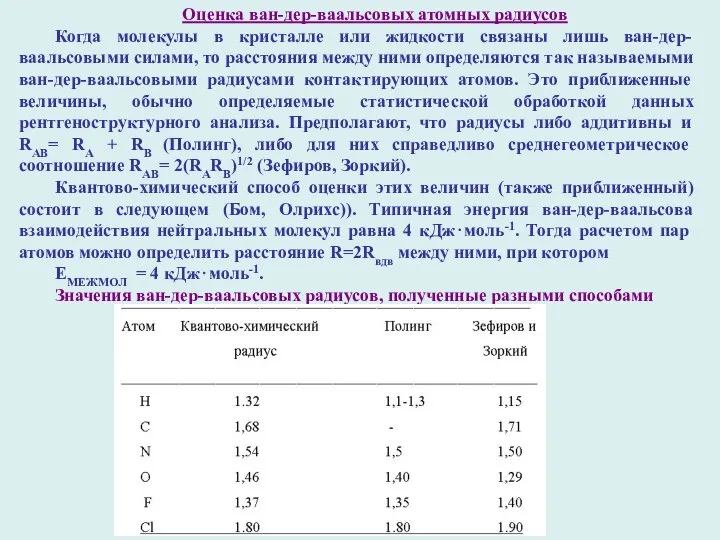
Оценка ван-дер-ваальсовых атомных радиусов
Когда молекулы в кристалле или жидкости связаны лишь
Оценка ван-дер-ваальсовых атомных радиусов
Когда молекулы в кристалле или жидкости связаны лишь
Квантово-химический способ оценки этих величин (также приближенный) состоит в следующем (Бом, Олрихс)). Типичная энергия ван-дер-ваальсова взаимодействия нейтральных молекул равна 4 кДж⋅моль-1. Тогда расчетом пар атомов можно определить расстояние R=2Rвдв между ними, при котором
ЕМЕЖМОЛ = 4 кДж⋅моль-1.
Значения ван-дер-ваальсовых радиусов, полученные разными способами
Донорно-акцепторные молекулярные комплексы
Молекулярные комплексы - группы связанных между собой молекул. В
Донорно-акцепторные молекулярные комплексы
Молекулярные комплексы - группы связанных между собой молекул. В
Волновая функция основного состояния ДА комплекса есть линейная комбинация антисимметризованных произведений нейтральных и ионизированных молекул: ΨАΨД и ΨА−ΨД+. Величина примеси ионизированных состояний зависит от степени переноса заряда от одной молекулы к другой: перенос заряда стабилизирует систему.
Понятие «перенос заряда» следует понимать в том же смысле, что и понятие «валентная структура» в методе валентных связей: волновая функция включает примеси состояния, отвечающего ионизированным молекулам комплекса. Реальное смещение электронов, конечно, имеет место, хотя количественно точно определить его невозможно.
Энергия взаимодействия донора и акцептора
ΔЕ геом , ΔЕ эл, ΔЕ обм,
Энергия взаимодействия донора и акцептора
ΔЕ геом , ΔЕ эл, ΔЕ обм,
ΔЕ поляр и ΔЕ перенос заряда можно визуализировать.
ΔЕ поляр есть разность между энергией мономеров, описываемых антисимметризованным и простым (функция Хартри) произведением волновых функций каждого из них.
ΔЕ перенос заряда есть разность между энергией комплекса и энергией мономеров, описываемых антисимметризованным произведением волновых функций каждого из них. Поляризация смещает ЭП к молекуле BH3 и, одновременно, - ЭП внутри этой молекулы из-за отталкивания от неподеленной электронной пары атома N.
Перенос заряда в основном обусловлен смещением электронов на пустую р-АО атома В. Величина переноса заряда по Малликену NH3 →BH3 равна 0,262 э.
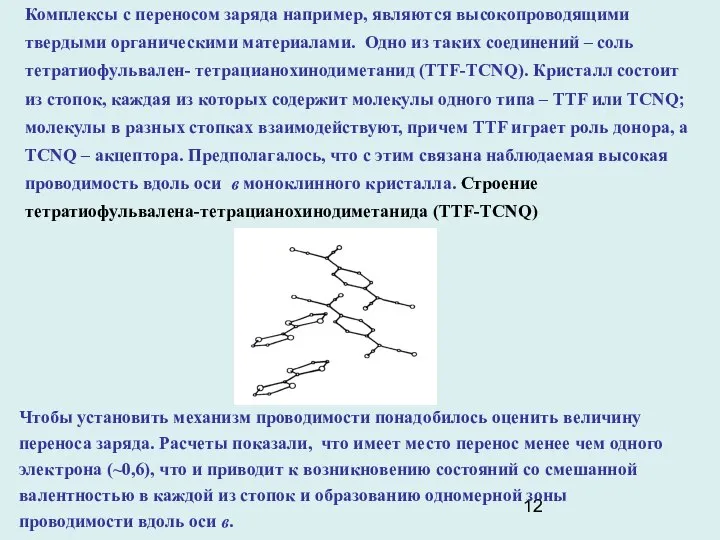
Комплексы с переносом заряда например, являются высокопроводящими твердыми органическими материалами. Одно
Комплексы с переносом заряда например, являются высокопроводящими твердыми органическими материалами. Одно
Чтобы установить механизм проводимости понадобилось оценить величину переноса заряда. Расчеты показали, что имеет место перенос менее чем одного электрона (~0,6), что и приводит к возникновению состояний со смешанной валентностью в каждой из стопок и образованию одномерной зоны проводимости вдоль оси в.
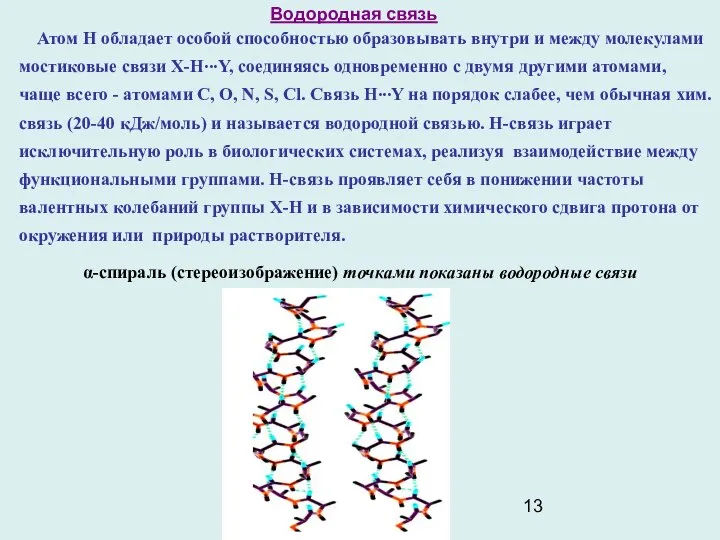
Водородная связь
Атом Н обладает особой способностью образовывать внутри и между
Водородная связь
Атом Н обладает особой способностью образовывать внутри и между
α-спираль (стереоизображение) точками показаны водородные связи
Общий подход к описанию Н-связи не отличается от такового в
Общий подход к описанию Н-связи не отличается от такового в
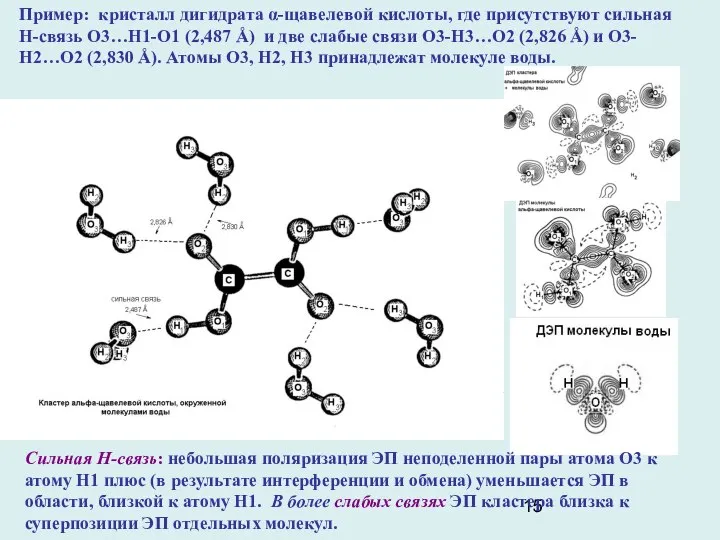
Сильная Н-связь: небольшая поляризация ЭП неподеленной пары атома О3 к атому
Сильная Н-связь: небольшая поляризация ЭП неподеленной пары атома О3 к атому
Пример: кристалл дигидрата α-щавелевой кислоты, где присутствуют сильная Н-связь О3…Н1-О1 (2,487 Å) и две слабые связи О3-Н3…О2 (2,826 Å) и О3-Н2…О2 (2,830 Å). Атомы О3, Н2, Н3 принадлежат молекуле воды.
Специфические невалентные взаимодействия
В органических (и металлоорганических кристаллах) кратчайшие расстояния между
Специфические невалентные взаимодействия
В органических (и металлоорганических кристаллах) кратчайшие расстояния между
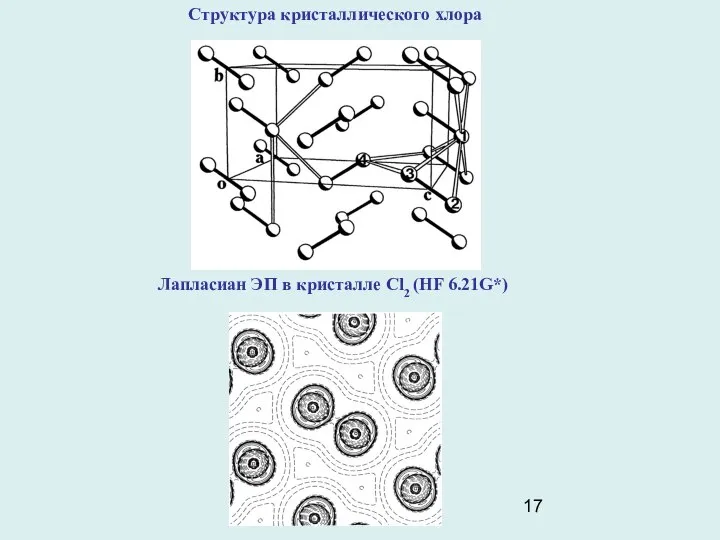
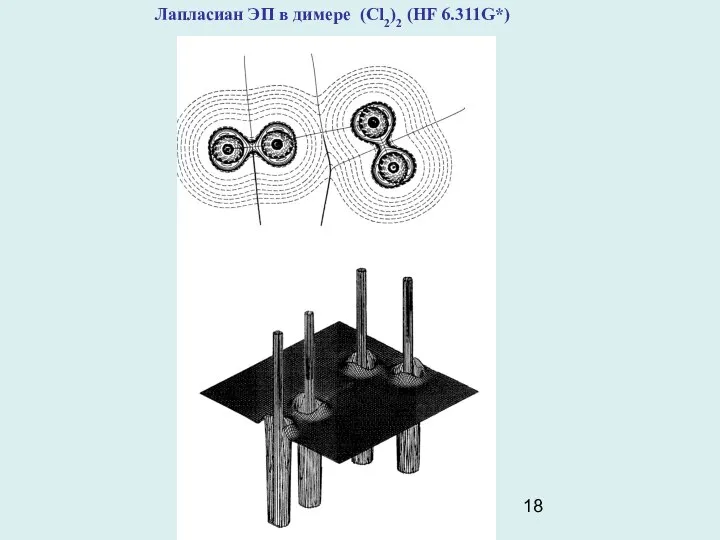
Пример: кристаллический молекулярный хлор. Молекулы Cl2 образуют в ромбической элементарной ячейке кристалла слои, параллельные плоскости вс, Кратчайшие расстояния между соседними молекулами в этой плоскости равно 3,284А. Это намного меньше, чем удвоенный ван-дер-ваальсов радиус атома Cl (3,6А). Расчеты ЕМЕЖМОЛ в кристалле Cl2, игнорировавшие наличие короткого контакта Cl- Cl, оказались безуспешными. Топологический анализ ЭП (HF 6.21G*) кристалла Cl2, показал, что между ближайшими атомами в слое имеется критическая точка (3,-1). Т.е. в кристалле Cl2 действительно имеет место некоторое связывающее взаимодействие между молекулами. Картина лапласиана ЭП прояснила его механизм:концентрации электронов в валентных оболочках Cl, ( неподеленные электронные пары), “смотрят” на области пониженной электронной плотности в соседних молекулах слоя. Из-за этого притяжение электронных пар к ядрам соседних атомов укорачивает контакт Cl-Cl. Такой же характер взаимодействия проявляется и в димере (Cl2)2 .
Структура кристаллического хлора
Лапласиан ЭП в кристалле Cl2 (HF 6.21G*)
Структура кристаллического хлора
Лапласиан ЭП в кристалле Cl2 (HF 6.21G*)
Лапласиан ЭП в димере (Cl2)2 (HF 6.311G*)
Лапласиан ЭП в димере (Cl2)2 (HF 6.311G*)










 Унифицированные системы документации в системе управления персоналом
Унифицированные системы документации в системе управления персоналом Страницы истории Олимпийских игр
Страницы истории Олимпийских игр Информационные технологии в психологии 5
Информационные технологии в психологии 5 Жилой комплекс в Японии, меняющий судьбу
Жилой комплекс в Японии, меняющий судьбу занятие 5 поженились женаты
занятие 5 поженились женаты Паразитологические методы исследования
Паразитологические методы исследования  Основные источники загрязнения окружающей среды и технические меры защиты от загрязнений
Основные источники загрязнения окружающей среды и технические меры защиты от загрязнений Векторы.Линейные операции
Векторы.Линейные операции  Только в боге мы находим силу побеждать (фотографии)
Только в боге мы находим силу побеждать (фотографии) Гражданское право
Гражданское право Организация и техника внешне-экономических операций по купле-продаже лицензий Выполнили: Белоглазова Ю.В., Безнощук Б.Ю.
Организация и техника внешне-экономических операций по купле-продаже лицензий Выполнили: Белоглазова Ю.В., Безнощук Б.Ю.  Ц в е т о в е д е н и е Карточка 4
Ц в е т о в е д е н и е Карточка 4 Презентация на тему "Метод проектів у розвитку якості дошкільної освіти" - скачать презентации по Педагогике
Презентация на тему "Метод проектів у розвитку якості дошкільної освіти" - скачать презентации по Педагогике Хочу быть здоровым! (1 класс) - презентация для начальной школы_
Хочу быть здоровым! (1 класс) - презентация для начальной школы_ Було тихо в Гефсиманії. Н. Н. Німецька мелодія
Було тихо в Гефсиманії. Н. Н. Німецька мелодія Инновационный учебно-методический комплекс "Россия в XIX веке" Визуализированный план-проспект В ИУМК входят: электронный ку
Инновационный учебно-методический комплекс "Россия в XIX веке" Визуализированный план-проспект В ИУМК входят: электронный ку Графики в социально-правовых исследованиях
Графики в социально-правовых исследованиях Объёмное моделирование из гофрированного картона. Стилизованная дымковская игрушка «Индюк»
Объёмное моделирование из гофрированного картона. Стилизованная дымковская игрушка «Индюк» Стратегический выбор. Виды стратегий
Стратегический выбор. Виды стратегий Системы счисления 10 класс
Системы счисления 10 класс  Забойные двигатели: Типы, классификация, устройство. Монтаж и эксплуатация бурового оборудования. Лекция 4
Забойные двигатели: Типы, классификация, устройство. Монтаж и эксплуатация бурового оборудования. Лекция 4 Флаг США
Флаг США Физико-химические основы спекания ультра- и- нанодисперсных порошокв tic- mo, полученных в процессе плазменой переконденсации
Физико-химические основы спекания ультра- и- нанодисперсных порошокв tic- mo, полученных в процессе плазменой переконденсации Регистратор фемтосекундных временных интервалов на основе фотонного эха в тонких пленках
Регистратор фемтосекундных временных интервалов на основе фотонного эха в тонких пленках Тест по простым комбинациям в игре шашки
Тест по простым комбинациям в игре шашки The cultural life of Oxford
The cultural life of Oxford Мат ладьей и королем
Мат ладьей и королем В чем причины изменения литературных направлений начала 19 в.? В чем причины изменения литературных направлений начала 19 в.? Охарак
В чем причины изменения литературных направлений начала 19 в.? В чем причины изменения литературных направлений начала 19 в.? Охарак