Содержание
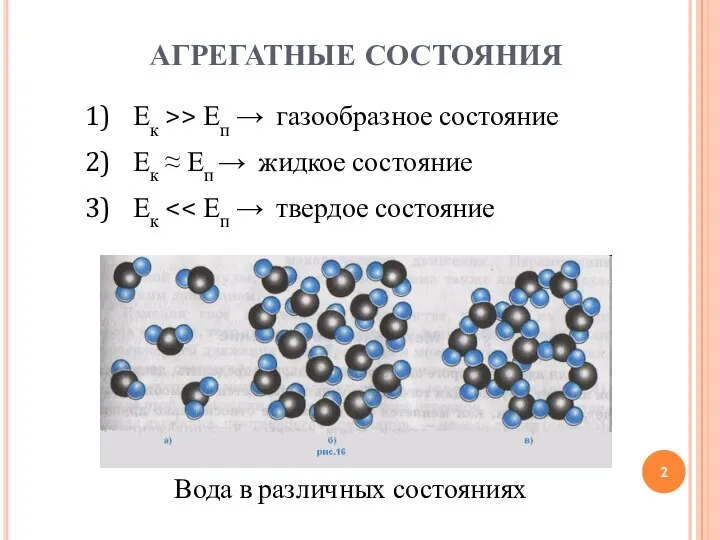
- 2. Ек >> Еп → газообразное состояние Ек ≈ Еп → жидкое состояние Ек Вода в различных
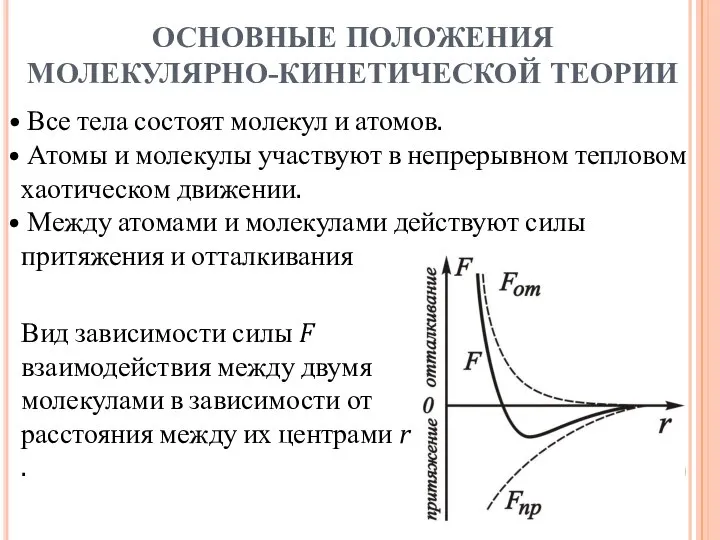
- 3. Все тела состоят молекул и атомов. Атомы и молекулы участвуют в непрерывном тепловом хаотическом движении. Между
- 4. Относительная атомная масса: Относительная молекулярная масса: [1] [2] ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ - масса изотопа углерода
- 5. NA = 6,02·1023 моль-1 [3] μ = Mr (г/моль) (моль) - количество вещества N – число
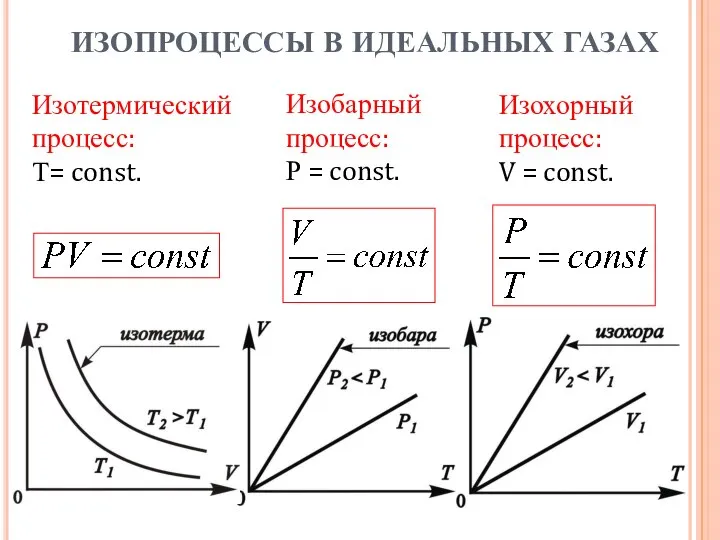
- 6. Изотермический процесс: Т= const. Изобарный процесс: Р = const. Изохорный процесс: V = const. ИЗОПРОЦЕССЫ В
- 7. Идеальный газ – это газ, молекулы которого можно считать материальными точками, т. е. расстояния между ними
- 8. Концентрация вещества: [1/м3] [5] или УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА Уравнение (4) можно записать в виде: [6]
- 9. Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений этих газов Уравнение состояния смеси идеальных
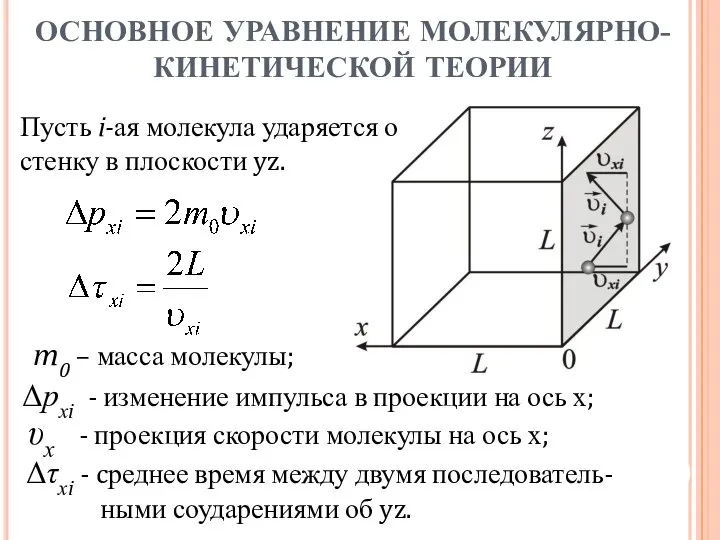
- 10. Рассмотрим идеальный газ в кубическом сосуде со стороной L. Положим: скорость молекул одинакова и равна средней
- 11. Δрхi - изменение импульса в проекции на ось х; υх - проекция скорости молекулы на ось
- 12. Найдем давление как отношение силы к площади стенки S = L2: (V = L3) Аналогичные уравнения
- 13. – среднее значение квадрата скорости молекул Все направления движений молекул равновероятны Просуммируем давления Рxi, Рyi ,
- 14. Среднеквадратичная скорость молекулы: – формула Клаузиуса – основное уравнение МКТ идеальных газов. [11] [10] ОСНОВНОЕ УРАВНЕНИЕ
- 15. T = t0С + 273,15 - термодинамическая температура 1oС = 1 К Т = 0 К
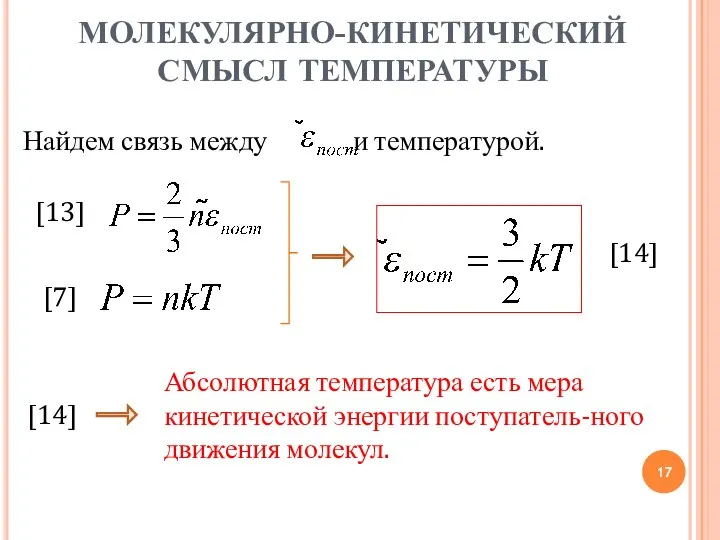
- 16. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ СМЫСЛ ТЕМПЕРАТУРЫ [12] Кинетическая энергия поступательного движения молекулы: [11] [13] [7] [11] Найдем связь между
- 17. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ СМЫСЛ ТЕМПЕРАТУРЫ Абсолютная температура есть мера кинетической энергии поступатель-ного движения молекул. [14] [7] Найдем связь
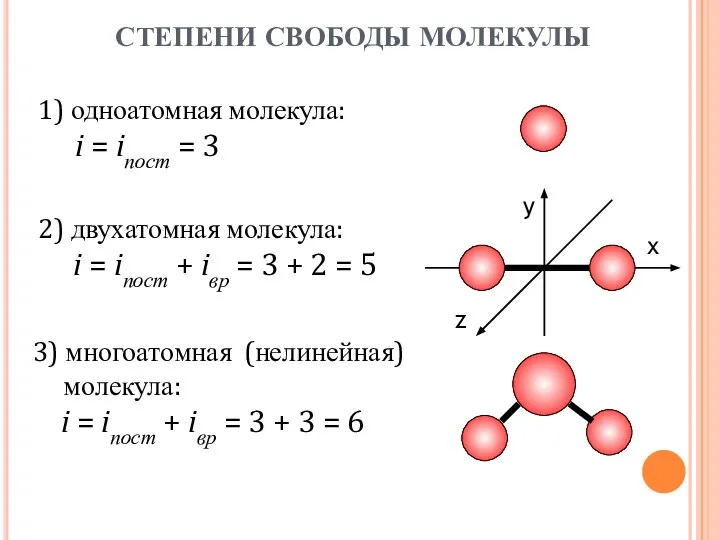
- 18. 1) одноатомная молекула: i = iпост = 3 х y z 2) двухатомная молекула: i =
- 20. Скачать презентацию
![Относительная атомная масса: Относительная молекулярная масса: [1] [2] ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1299945/slide-3.jpg)
![NA = 6,02·1023 моль-1 [3] μ = Mr (г/моль) (моль) -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1299945/slide-4.jpg)

![Концентрация вещества: [1/м3] [5] или УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА Уравнение (4)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1299945/slide-7.jpg)






![МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ СМЫСЛ ТЕМПЕРАТУРЫ [12] Кинетическая энергия поступательного движения молекулы: [11] [13]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1299945/slide-15.jpg)
 Презентация "FERRY LINE IZMAYL - TULCEA" - скачать презентации по Экономике
Презентация "FERRY LINE IZMAYL - TULCEA" - скачать презентации по Экономике Проблемы правового регулирования рекламы в сети Интернет
Проблемы правового регулирования рекламы в сети Интернет Электронные платежные системы в Интернет и их особенности. Выполнил: Студент 3 курса (ШФ) ЮРГИ Факультет «Прикладная информатика
Электронные платежные системы в Интернет и их особенности. Выполнил: Студент 3 курса (ШФ) ЮРГИ Факультет «Прикладная информатика Муниципальное бюджетное дошкольное образовательное учреждение
Муниципальное бюджетное дошкольное образовательное учреждение  Складнопідрядні речення з кількома підрядними
Складнопідрядні речення з кількома підрядними Лекция 10. Международные и региональные валютно-кредитные
Лекция 10. Международные и региональные валютно-кредитные  АЛГЕБРА, 8 класс Тема урока: «Квадратные уравнения» Если ты услышишь, что кто-то не любит математику, не верь. Её нельзя н
АЛГЕБРА, 8 класс Тема урока: «Квадратные уравнения» Если ты услышишь, что кто-то не любит математику, не верь. Её нельзя н JavaScript安全 从浏览器到服务端 余弦
JavaScript安全 从浏览器到服务端 余弦 Языки программирования
Языки программирования Непрерывность функции в точке и на интервале
Непрерывность функции в точке и на интервале Казахстан в мировом сообществе. Внешняя политика Республики Казахстан
Казахстан в мировом сообществе. Внешняя политика Республики Казахстан ДИСКОНТИРОВАНИЕ мсфо
ДИСКОНТИРОВАНИЕ мсфо  Зима 2017. Издания книг
Зима 2017. Издания книг Система «человек - социальная среда
Система «человек - социальная среда Анкетирование. Опросный лист, его логика и структура
Анкетирование. Опросный лист, его логика и структура Понятие записи
Понятие записи Уголовно-правовые аспекты противодействия незаконному перемещению через границу объектов дикой флоры и фауны Курамшина Ольга
Уголовно-правовые аспекты противодействия незаконному перемещению через границу объектов дикой флоры и фауны Курамшина Ольга  Аттестационная работа. Совершенствование и проектирование ранее изученных элементов техники акробатических упражнений
Аттестационная работа. Совершенствование и проектирование ранее изученных элементов техники акробатических упражнений Гражданские правоотношения. (Лекция 6)
Гражданские правоотношения. (Лекция 6) Уильям Риверс
Уильям Риверс Why are family holidays important
Why are family holidays important Урок математики 1 класс
Урок математики 1 класс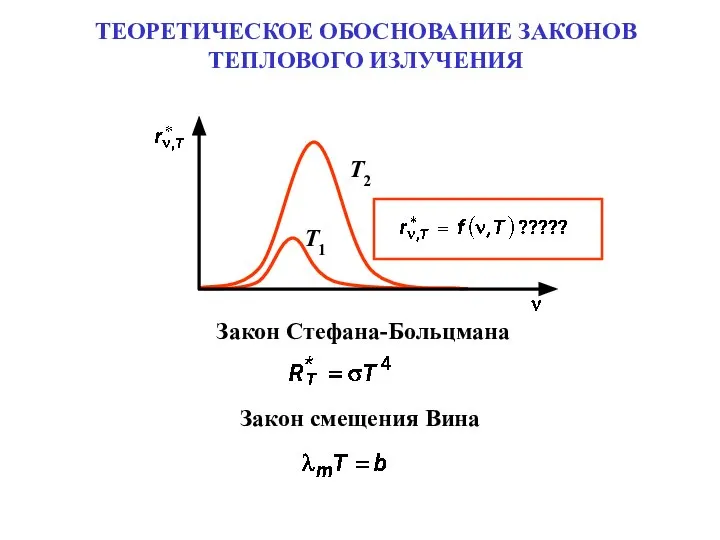 ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ ЗАКОНОВ ТЕПЛОВОГО ИЗЛУЧЕНИЯ
ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ ЗАКОНОВ ТЕПЛОВОГО ИЗЛУЧЕНИЯ Точность деталей сборочных единиц изделий
Точность деталей сборочных единиц изделий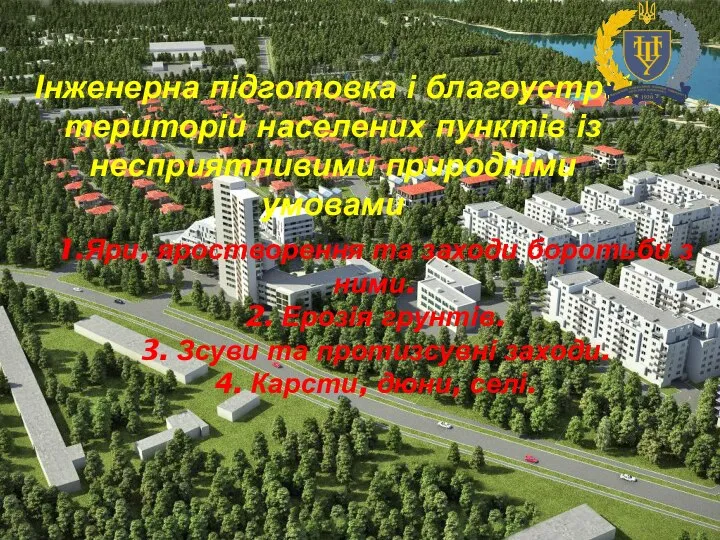 Інженерна підготовка і благоустрій територій населених пунктів із несприятливими природніми умовами
Інженерна підготовка і благоустрій територій населених пунктів із несприятливими природніми умовами Прогнозирование прибыли и рентабельности. УЭФ-Л 12-13
Прогнозирование прибыли и рентабельности. УЭФ-Л 12-13 Якими якостями повинна володти людина
Якими якостями повинна володти людина Спортивная медицина
Спортивная медицина