Содержание
- 2. Обмен белков - это совокупность процессов генетически детерминируемого синтеза, процессов распада с образованием специфических конечных продуктов,
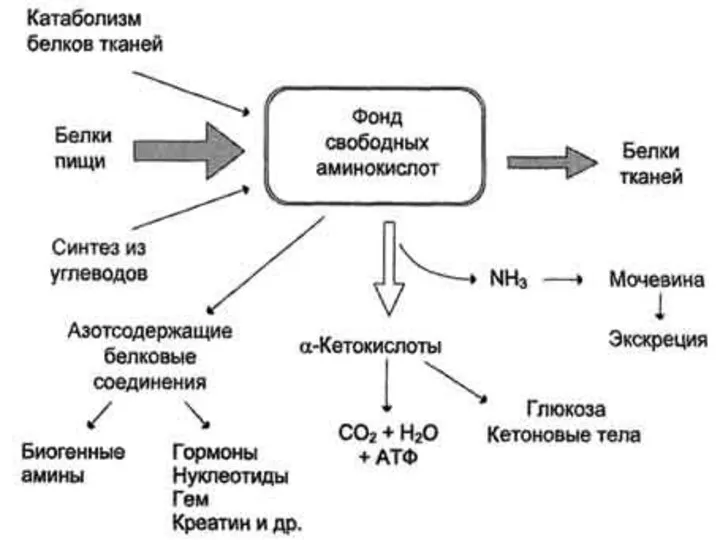
- 4. Основной источник аминокислот организма- белки пищи. Минимальное количество белка, поступающего с пищей-30-50 г. Более правильно рассчитывать
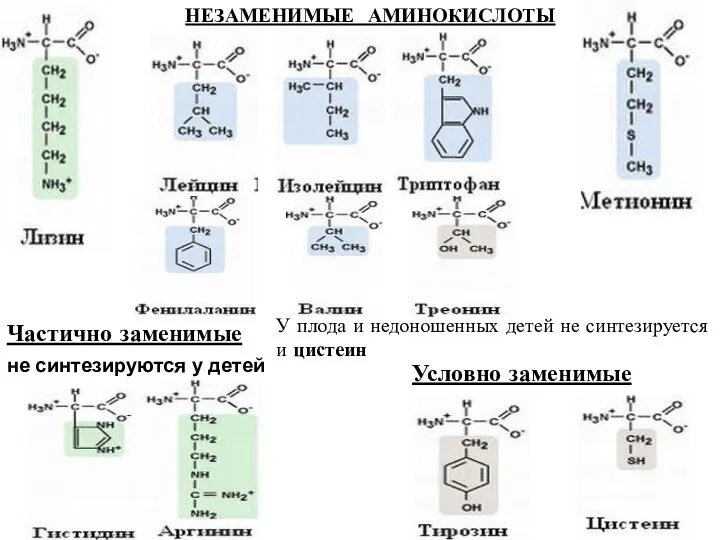
- 5. НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ Условно заменимые Частично заменимые не синтезируются у детей У плода и недоношенных детей не
- 6. Азотистый баланс- это количественная разница между поступившим в организм азотом, связанным с белками пищи и азотом,
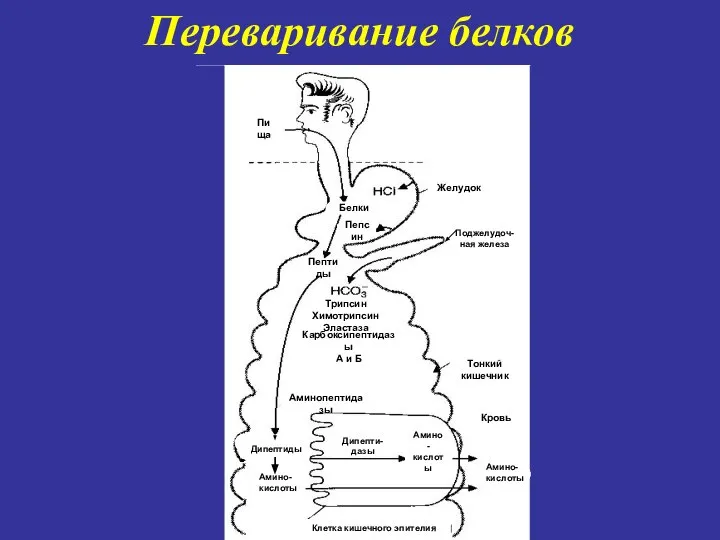
- 7. Переваривание белков Пища Желудок Белки Пепсин Пептиды Трипсин Химотрипсин Эластаза Карбоксипептидазы А и Б Тонкий кишечник
- 8. Соляная кислота выполняет следующие функции: 1) способствует денатурации и набуханию белков пищи, не подвергшихся термической обработке;
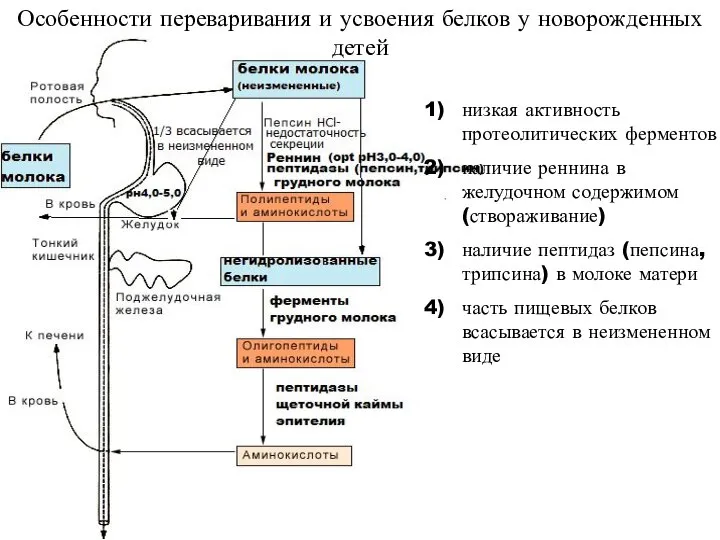
- 9. низкая активность протеолитических ферментов наличие реннина в желудочном содержимом (створаживание) наличие пептидаз (пепсина, трипсина) в молоке
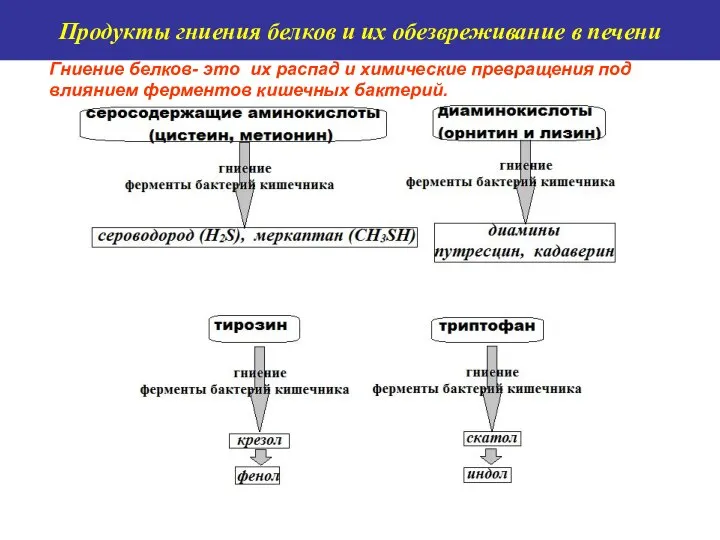
- 10. Гниение белков- это их распад и химические превращения под влиянием ферментов кишечных бактерий. Продукты гниения белков
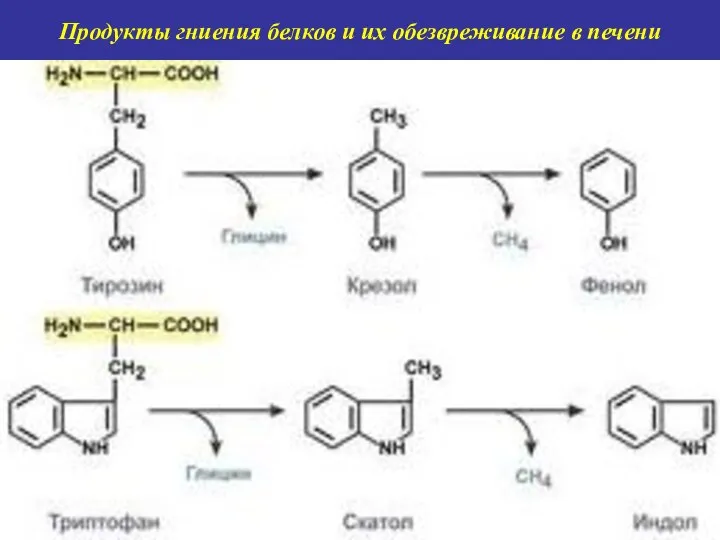
- 11. Продукты гниения белков и их обезвреживание в печени
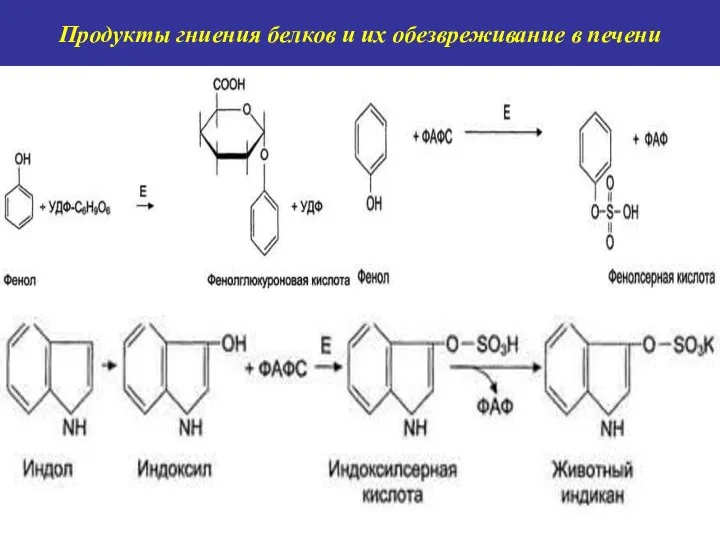
- 12. Продукты гниения белков и их обезвреживание в печени
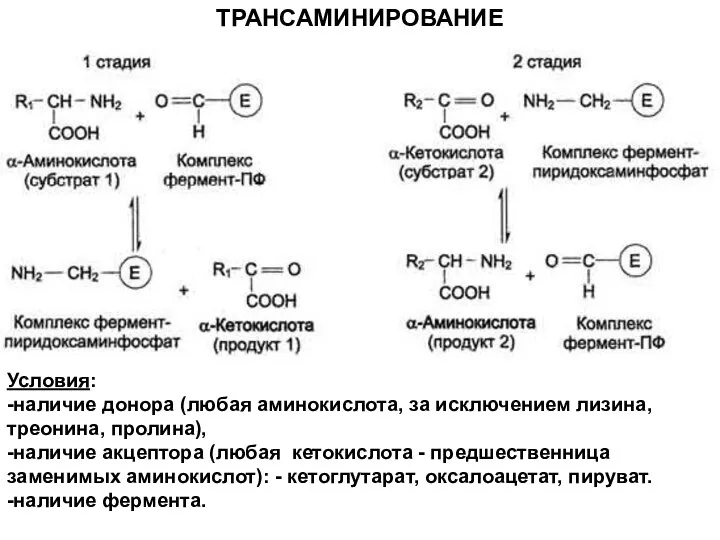
- 13. Трансаминирование аминокислот
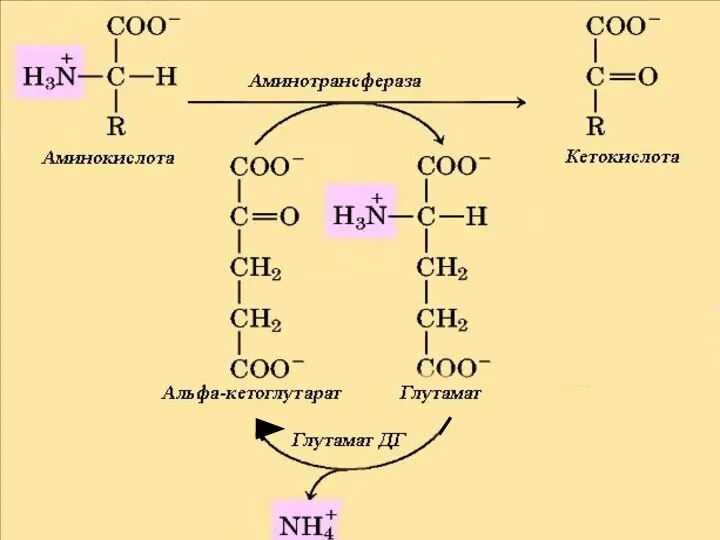
- 14. Александр Евсеевич Браунштейн (1902-1986) советский биохимик Трансаминирование - реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту без
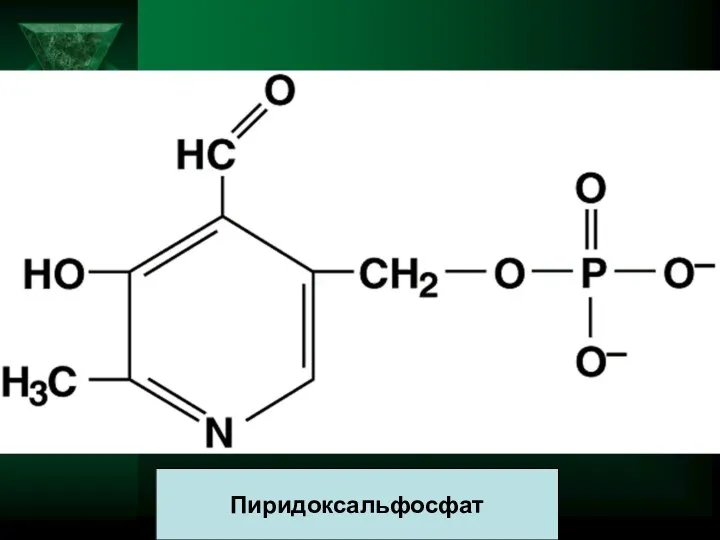
- 15. Пиридоксальфосфат
- 16. Условия: -наличие донора (любая аминокислота, за исключением лизина, треонина, пролина), -наличие акцептора (любая кетокислота - предшественница
- 17. Физиологическое значение трансаминирования Синтез заменимых аминокислот Перераспределение в фонде аминокислот, создание оптимальных соотношений их концентраций Подготовка
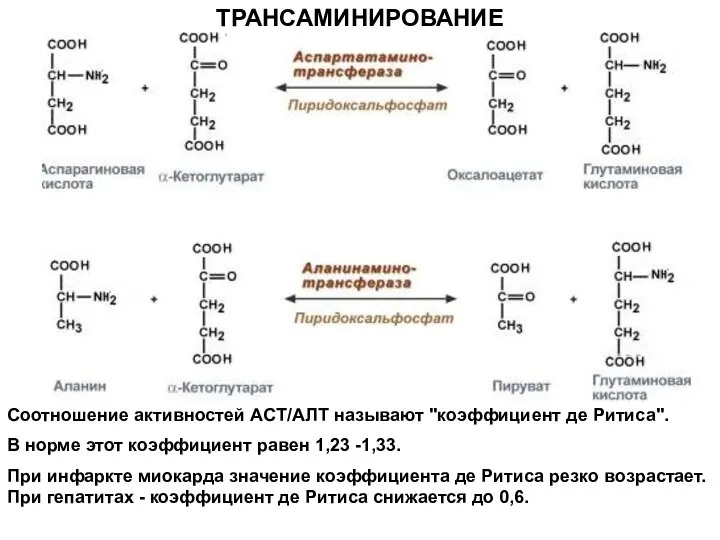
- 18. ТРАНСАМИНИРОВАНИЕ Соотношение активностей ACT/АЛТ называют "коэффициент де Ритиса". В норме этот коэффициент равен 1,23 -1,33. При
- 19. Дезаминирование аминокислот- реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и
- 20. 2 Окислительное дезаминирование глутамииновой кислоты НАД(Ф) НАД(Ф)Н2
- 21. Аллостерические регуляторы ГДГ Активаторы: АДФ ГДФ НАД Ингибиторы: АТФ ГТФ НАДН2
- 22. Непрямое дезаминирование трансдезаминирование) – это последовательное осуществление двух реакций: -трансаминирования любой аминокислоты с альфа-кетоглутарутаратом, -окислительного дезаминирования
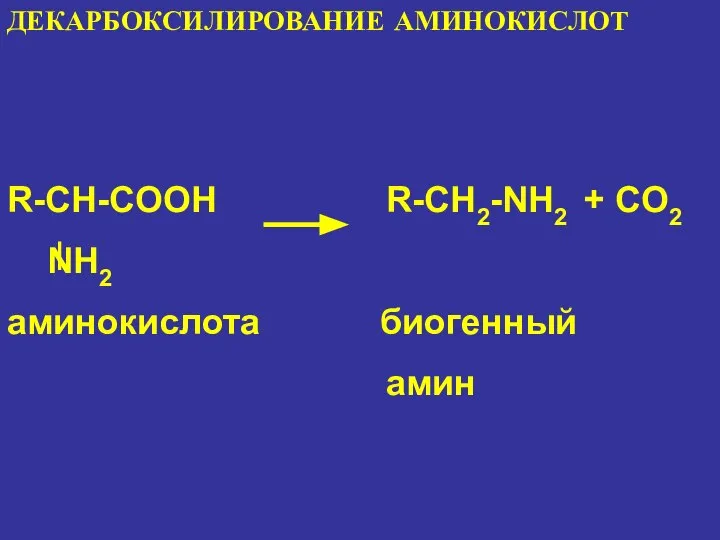
- 24. ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ R-CH-COOH R-CH2-NH2 + CO2 NH2 аминокислота биогенный амин
- 25. Метаболические превращения аминокислот по радикалу. Особенности преобразований циклических аминокислот (фенилаланина и тирозина)
- 26. Фенилкетонурия
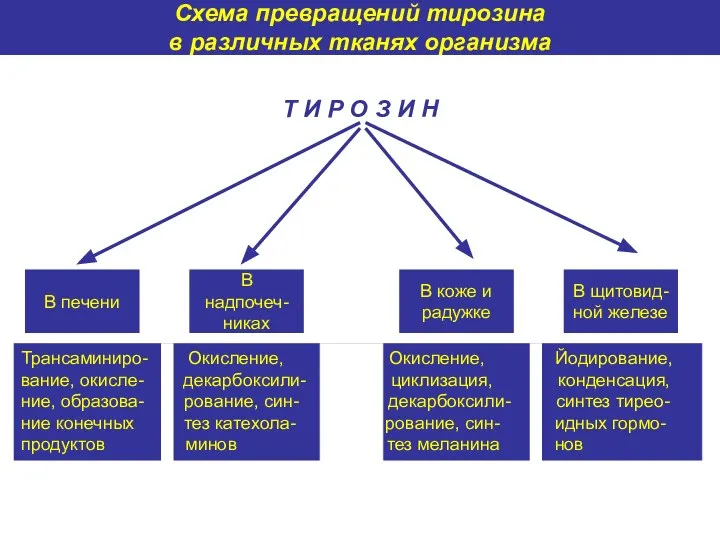
- 27. Т И Р О З И Н В печени В надпочеч- никах В коже и радужке
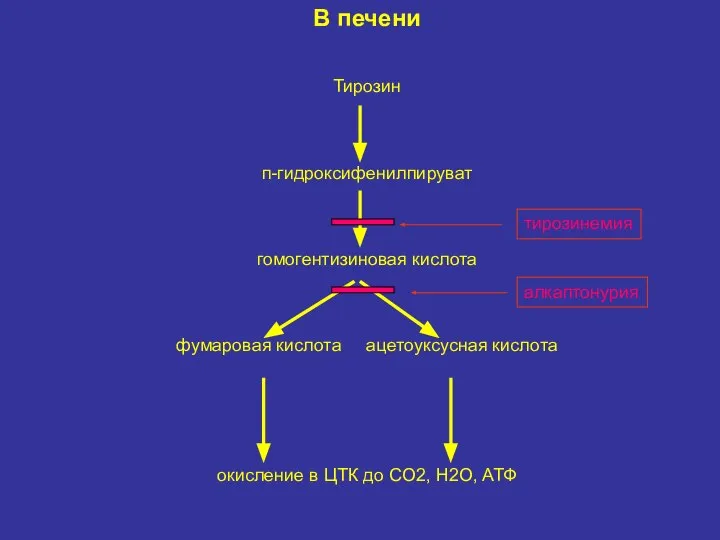
- 28. В печени Тирозин п-гидроксифенилпируват гомогентизиновая кислота фумаровая кислота ацетоуксусная кислота окисление в ЦТК до СО2, Н2О,
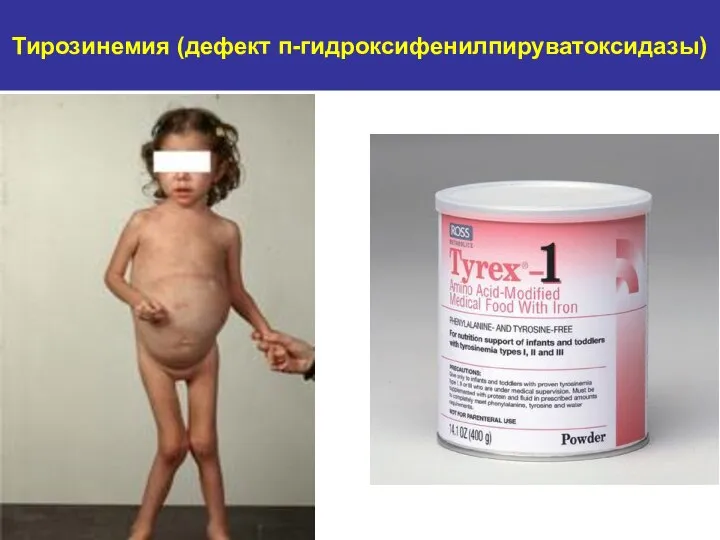
- 29. Тирозинемия (дефект п-гидроксифенилпируватоксидазы)
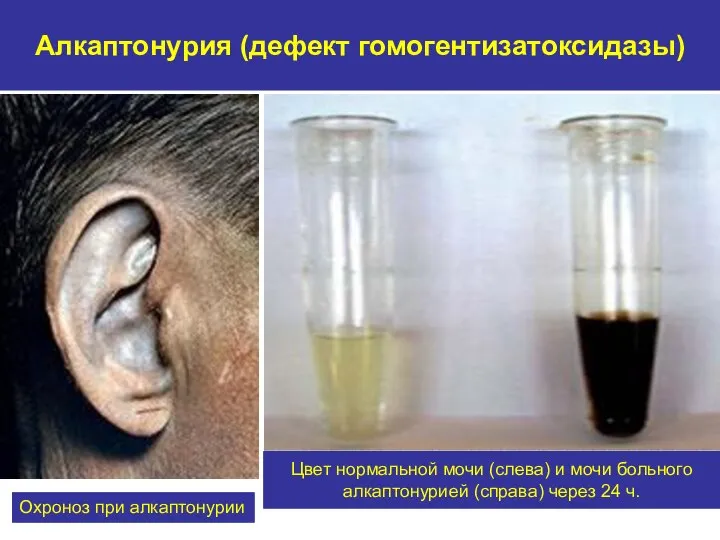
- 30. Алкаптонурия (дефект гомогентизатоксидазы) Охроноз при алкаптонурии Цвет нормальной мочи (слева) и мочи больного алкаптонурией (справа) через
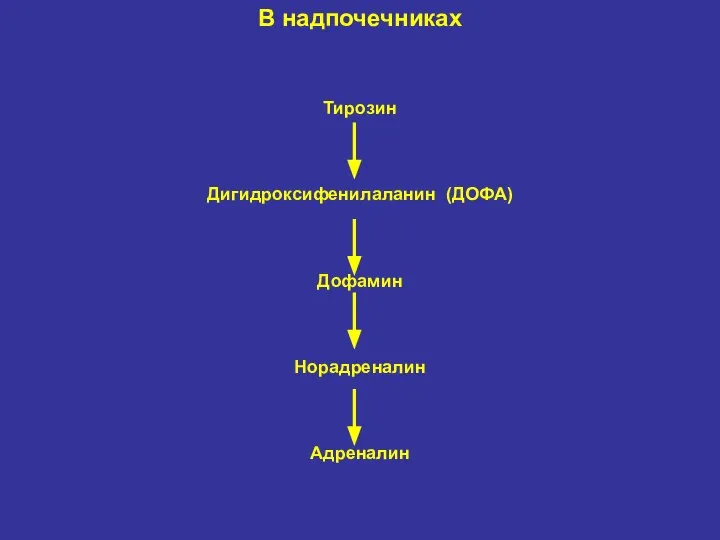
- 31. В надпочечниках Тирозин Дигидроксифенилаланин (ДОФА) Дофамин Норадреналин Адреналин
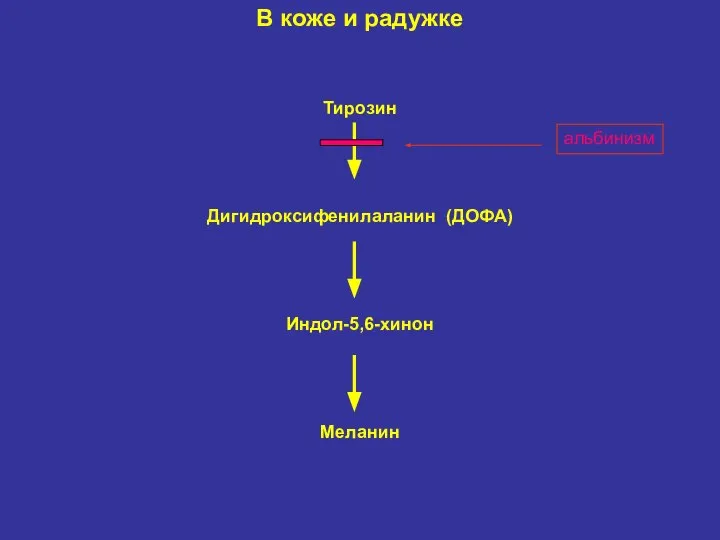
- 32. В коже и радужке Тирозин Дигидроксифенилаланин (ДОФА) Индол-5,6-хинон Меланин альбинизм
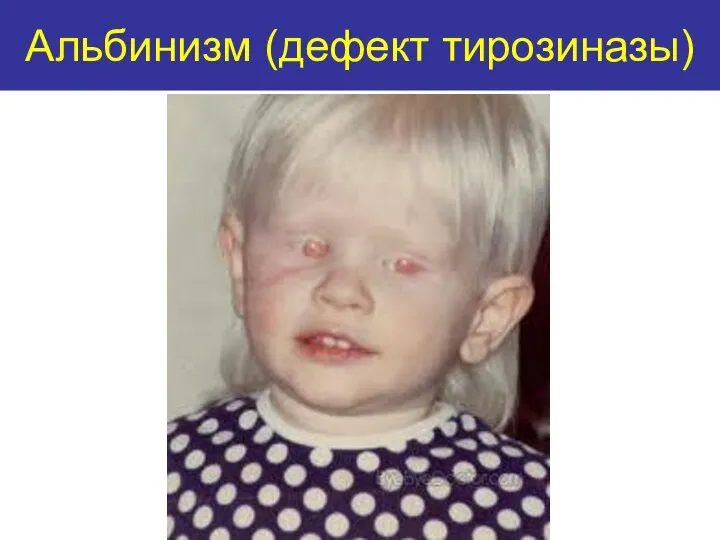
- 33. Альбинизм (дефект тирозиназы)
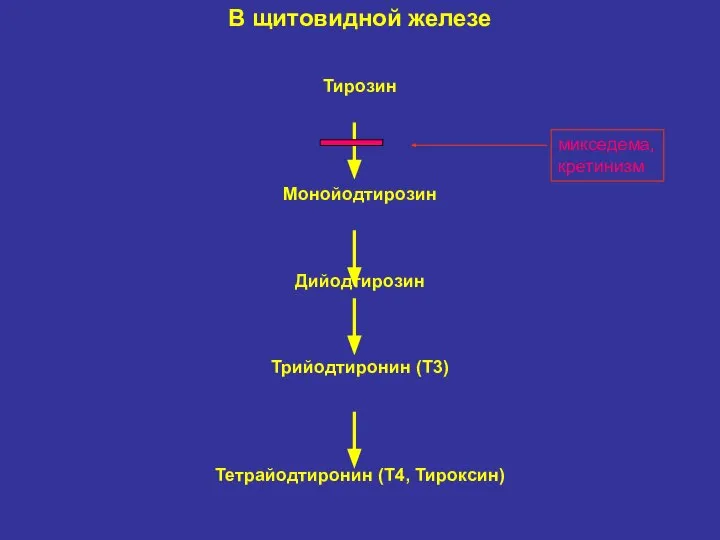
- 34. В щитовидной железе Тирозин Монойодтирозин Дийодтирозин Трийодтиронин (T3) Тетрайодтиронин (T4, Тироксин) микседема, кретинизм
- 35. Myxedema & Cretinism Myxedema Cretinism
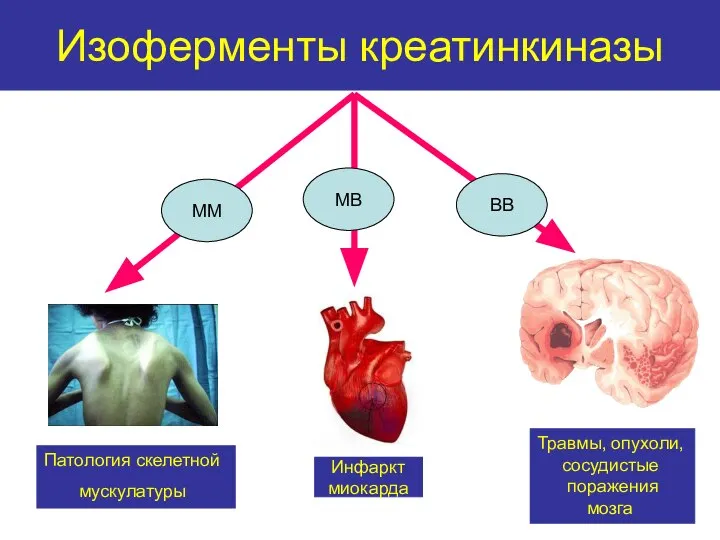
- 36. Изоферменты креатинкиназы Инфаркт миокарда Патология скелетной мускулатуры Травмы, опухоли, сосудистые поражения мозга ММ МВ ВВ
- 37. Пути образования и обезвреживания аммиака в организме
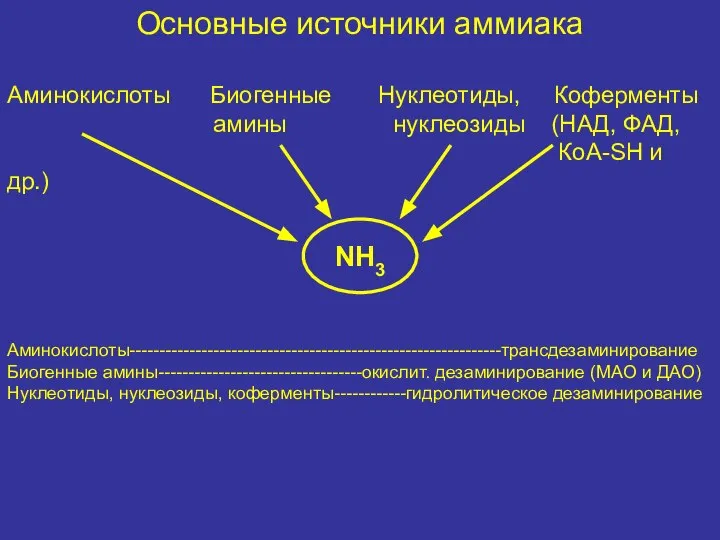
- 38. Основные источники аммиака Аминокислоты Биогенные Нуклеотиды, Коферменты амины нуклеозиды (НАД, ФАД, КоА-SH и др.) Аминокислоты--------------------------------------------------------------трансдезаминирование Биогенные
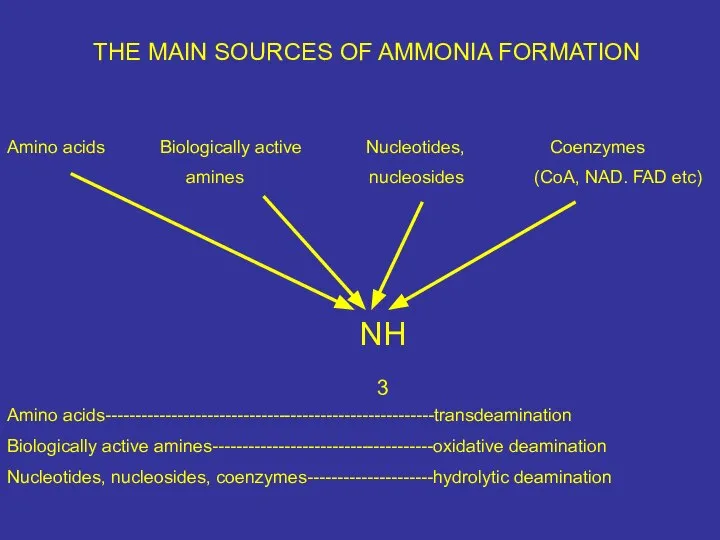
- 39. THE MAIN SOURCES OF AMMONIA FORMATION Amino acids Biologically active Nucleotides, Coenzymes amines nucleosides (CoA, NAD.
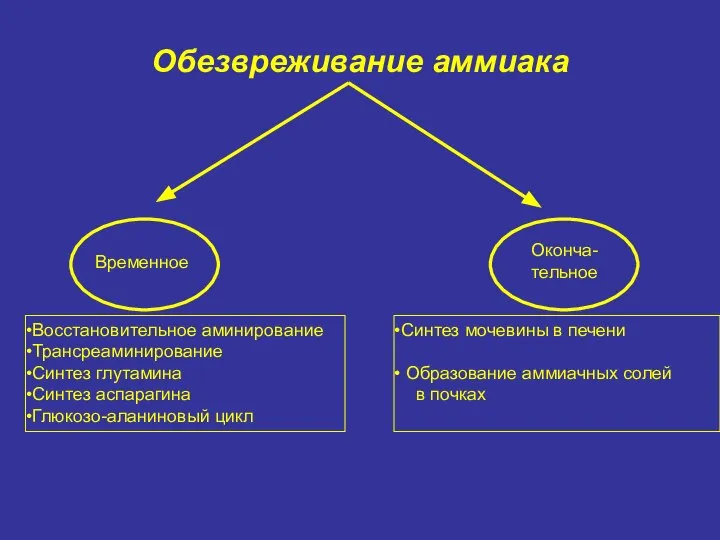
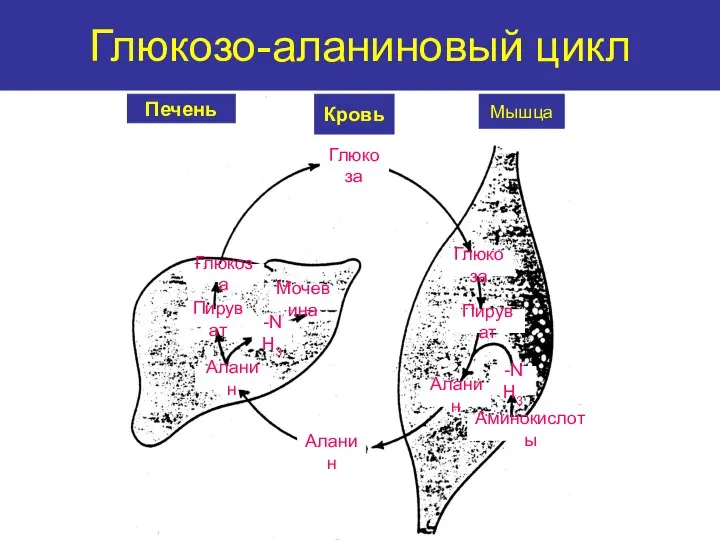
- 40. Обезвреживание аммиака Временное Оконча- тельное Восстановительное аминирование Трансреаминирование Синтез глутамина Синтез аспарагина Глюкозо-аланиновый цикл Синтез мочевины
- 41. Глюкозо-аланиновый цикл Печень Кровь Мышца Глюкоза Глюкоза Пируват Аланин -NH3 Аминокислоты Аланин Аланин Пируват Глюкоза -NH3
- 42. Остаточный азот крови (14-28 мM/л) Мочевина------------------------------------------------------------------50% Свободные аминокислоты-------------------------------------------25% Креатиновый пул (креатин, креатинин, креатинфосфат)---8% эрготионеин (тиопроизводное гистидина)-----------------------8%
- 44. Скачать презентацию
















 Облицовка поверхностей пола керамической плиткой
Облицовка поверхностей пола керамической плиткой Этапы технологии диалогового обучения и воспитания
Этапы технологии диалогового обучения и воспитания Биологические методы утилизации нефтешламов
Биологические методы утилизации нефтешламов СПбГУ СПбГУ 2012г.
СПбГУ СПбГУ 2012г.  Применение общеизвестных инструментов Интернет-маркетинга для продвижения услуг по размещению 20 февраля 2010 года © ООО «КПОРТ», город Симферополь
Применение общеизвестных инструментов Интернет-маркетинга для продвижения услуг по размещению 20 февраля 2010 года © ООО «КПОРТ», город Симферополь Презентация Государственный флаг РФ
Презентация Государственный флаг РФ Культура Древней Руси
Культура Древней Руси Аңшы киімі мен жабдықтары
Аңшы киімі мен жабдықтары Компьютерная томография в диагностике неопухолевых заболеваний позвоночника К.м.н. Митусова Галина Мариновна
Компьютерная томография в диагностике неопухолевых заболеваний позвоночника К.м.н. Митусова Галина Мариновна  Классификация вычислительной техники и программного обеспечения
Классификация вычислительной техники и программного обеспечения Sports in Russia
Sports in Russia Особенности договора поставки товаров для государственных нужд
Особенности договора поставки товаров для государственных нужд Участие граждан в политической жизни
Участие граждан в политической жизни Строевые упражнения (начальная школа)
Строевые упражнения (начальная школа) Эпигенитические процессы окислительного ряда
Эпигенитические процессы окислительного ряда Автосцепное устройство
Автосцепное устройство Компьютерные вирусы
Компьютерные вирусы  Строки и символы
Строки и символы Основы SOA. Сервис-ориентированная архитектура
Основы SOA. Сервис-ориентированная архитектура Диссеминированный туберкулез легких
Диссеминированный туберкулез легких Процессор и жесткий диск
Процессор и жесткий диск Технологии регистрации заряженных частиц, сбор и анализ данных детекторов в ФВЭ. Ядерная электроника. (Лекция 3)
Технологии регистрации заряженных частиц, сбор и анализ данных детекторов в ФВЭ. Ядерная электроника. (Лекция 3) Народна медицина і лікувальна магія українців
Народна медицина і лікувальна магія українців Презентация на тему "Школа и педагогика в России 19 в" - скачать презентации по Педагогике
Презентация на тему "Школа и педагогика в России 19 в" - скачать презентации по Педагогике Ростов Великий
Ростов Великий Political parties all over the world
Political parties all over the world Работа с формами. Компоненты формы
Работа с формами. Компоненты формы Как тысячи лет назад лечили простуду? Выполнили: Мухомодьярова Динара, Карпенко Иван, Кулагин Илья Руководитель: Ребенок О.И.
Как тысячи лет назад лечили простуду? Выполнили: Мухомодьярова Динара, Карпенко Иван, Кулагин Илья Руководитель: Ребенок О.И.