Содержание
- 2. В настоящее время получены неопровержимые экспериментальные доказательства белковой природы ферментов. Исключение – рибозимы - молекулы ряда
- 3. Ферменты, как и все белки, обладают рядом свойств, характерных для высокомолекулярных соединений: - -- амфотерностью, -
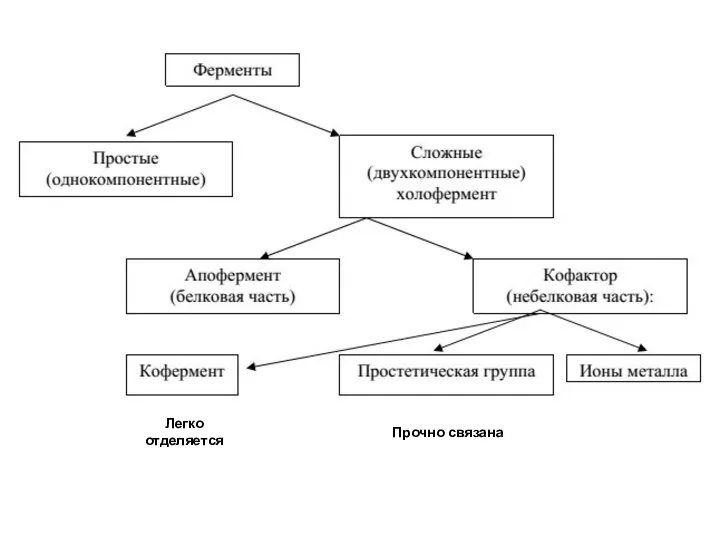
- 4. В природе существуют как простые, так и сложные ферменты. Простые представлены полипептидными цепями и при гидролизе
- 5. Большинство природных ферментов относится к классу сложных белков, содержащих помимо полипептидных цепей какой-либо небелковый компонент (кофактор),
- 6. Если константа диссоциации сложного фермента настолько мала, что в растворе все полипептидные цепи оказываются связанными со
- 7. Легко отделяется Прочно связана
- 9. Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Роль металлов в
- 10. а) Ионы металлов– стабилизаторы молекулы субстрата Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом
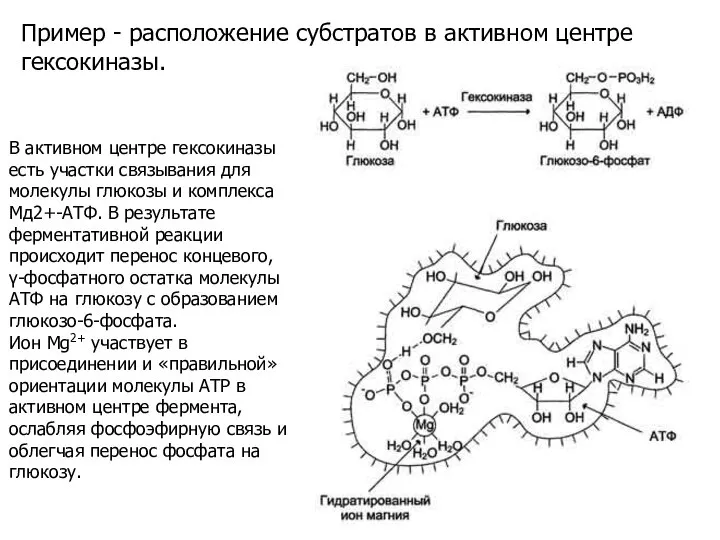
- 11. Пример - расположение субстратов в активном центре гексокиназы. В активном центре гексокиназы есть участки связывания для
- 12. б) Ионы металла - стабилизаторы активного центра фермента В некоторых случаях ионы металла служат «мостиком» между
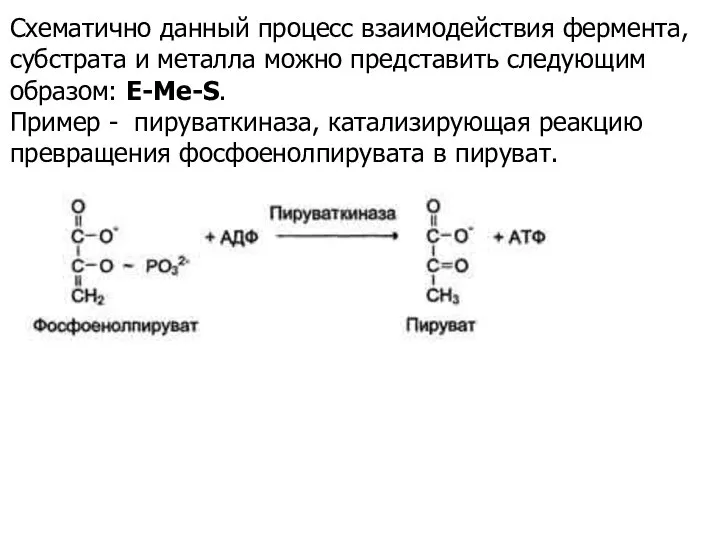
- 13. Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом: E-Me-S. Пример - пируваткиназа,
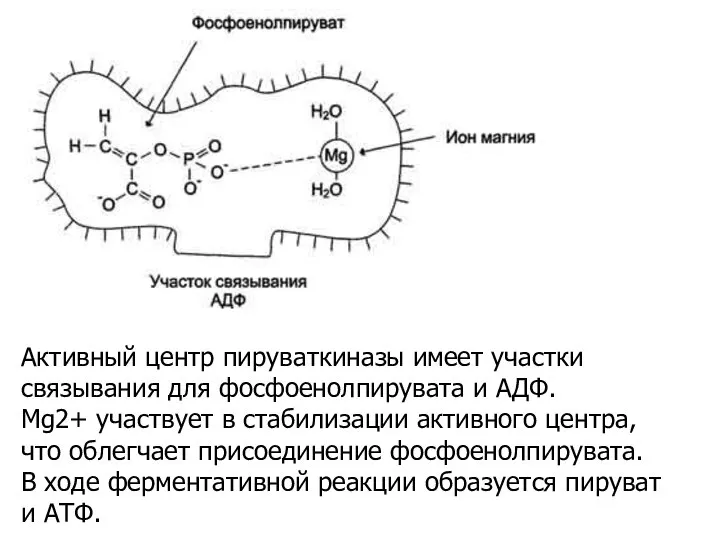
- 14. Активный центр пируваткиназы имеет участки связывания для фосфоенолпирувата и АДФ. Мg2+ участвует в стабилизации активного центра,
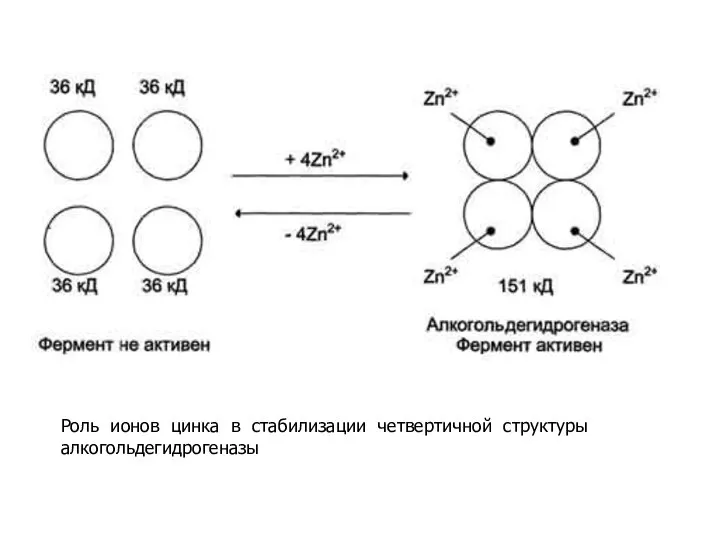
- 15. в) Ионы металлов – роль в стабилизации третичной и четвертичной структуры фермента Такие ферменты в отсутствие
- 16. Иногда в стабилизации вторичной и третичной структуры принимают участие ионы щёлочноземельных металлов. Так, для поддержания третичной
- 17. Роль ионов цинка в стабилизации четвертичной структуры алкогольдeгидрогеназы
- 18. 2. Ионы металлов могут принимать непосредственное участие в акте катализа. а) Участие в электрофильном катализе Наиболее
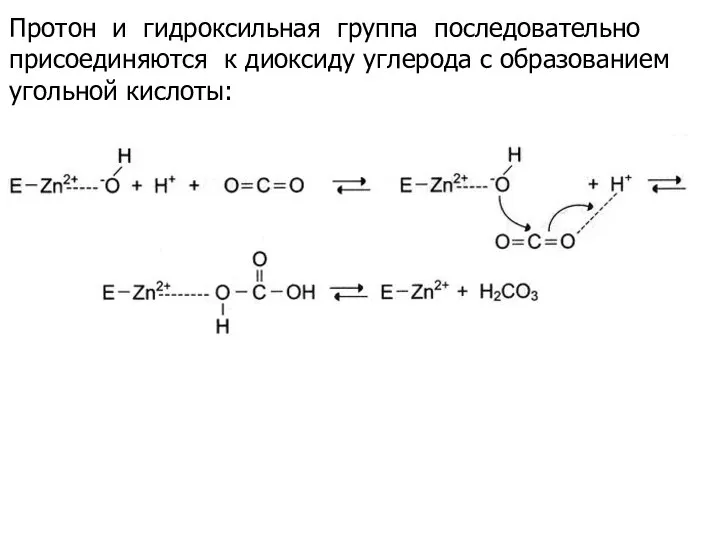
- 19. Пример, карбоангидраза – цинксодержащий фермент, катализирующий реакцию образования угольной кислоты: Ион Zn2+ в результате электрофильной атаки
- 20. Протон и гидроксильная группа последовательно присоединяются к диоксиду углерода с образованием угольной кислоты:
- 21. б) Участие в окислительно-восстановительных реакциях Ионы металлов с переменной валентностью могут также участвовать в переносе электронов.
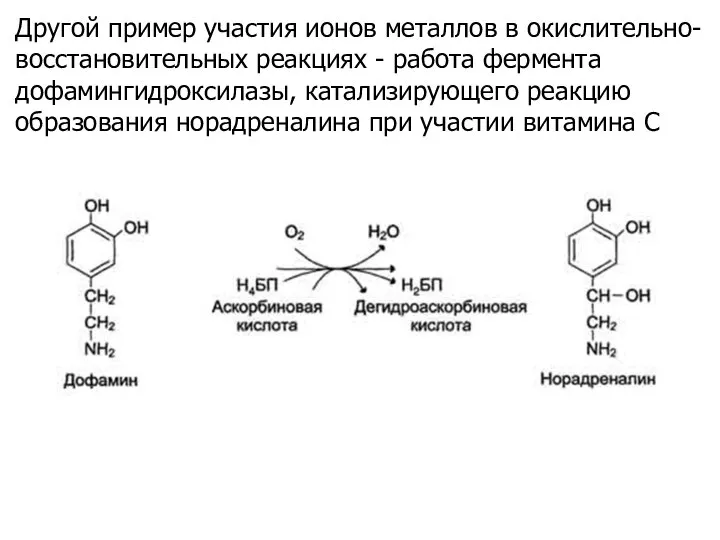
- 22. Другой пример участия ионов металлов в окислительно-восстановительных реакциях - работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина
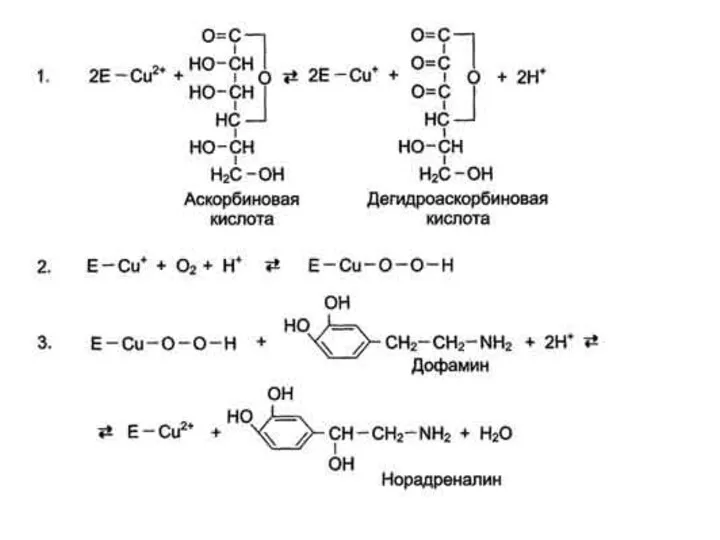
- 23. За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди. Фермент, содержащий ион Сu2+, не вступает в реакцию
- 26. Скачать презентацию















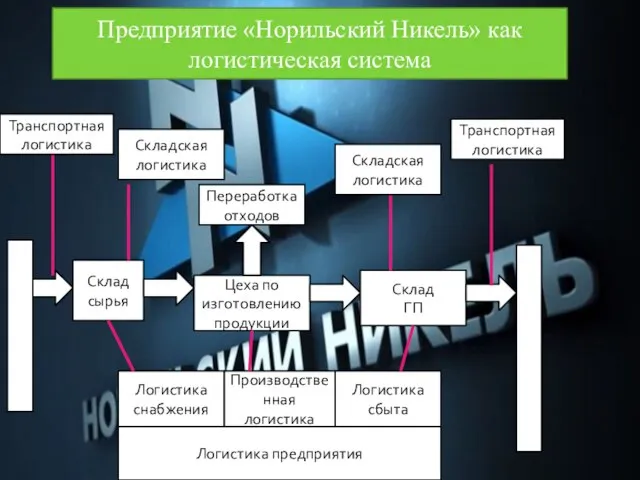 Презентация Норильский никель: логистическая система
Презентация Норильский никель: логистическая система АРХИП ИВАНОВИЧ КУИНДЖИ (1842-1910)
АРХИП ИВАНОВИЧ КУИНДЖИ (1842-1910)  The «Millennium» bridge
The «Millennium» bridge Аналоговые электронные вольтметры
Аналоговые электронные вольтметры Презентация____
Презентация____ разделение_смесей_19-09-19
разделение_смесей_19-09-19 Презентация "Архитектура и дизайн конструктивные искусства в ряду пространственных искусств" - скачать презентации по МХК
Презентация "Архитектура и дизайн конструктивные искусства в ряду пространственных искусств" - скачать презентации по МХК Традиционные теории обучении
Традиционные теории обучении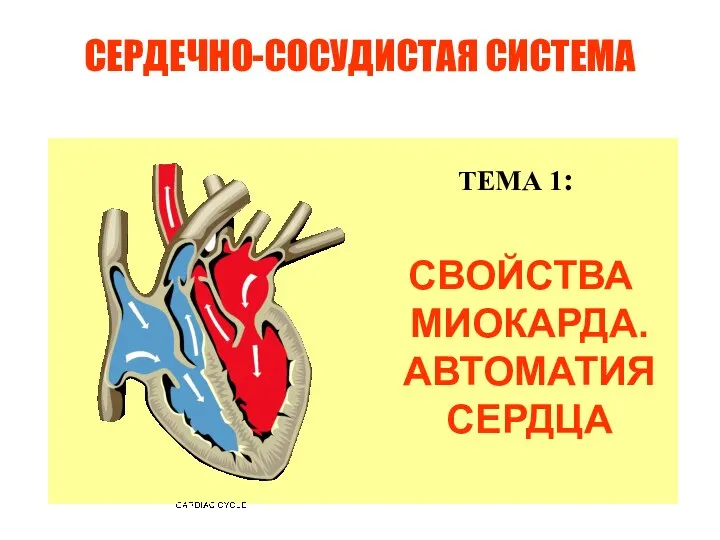 ФУНКЦИИ КРОВООБРАЩЕНИЯ И АВТОМАТИЯ СЕРДЦА
ФУНКЦИИ КРОВООБРАЩЕНИЯ И АВТОМАТИЯ СЕРДЦА Влияние планирования продаж и операций на логистические решения компании
Влияние планирования продаж и операций на логистические решения компании Кинематика точки
Кинематика точки Международные отношения в 80-е годы XX века
Международные отношения в 80-е годы XX века Реферат по зданию Сиднейская Опера
Реферат по зданию Сиднейская Опера Управление тепловыми электростанциями
Управление тепловыми электростанциями Эшмоловский музей
Эшмоловский музей Непрерывность функции в точке и на интервале
Непрерывность функции в точке и на интервале Der Verkehr in einer Groβstadt. Wie orientiert man sich hier?
Der Verkehr in einer Groβstadt. Wie orientiert man sich hier?  London is the capital of Great Britain
London is the capital of Great Britain Моя история в Medialab
Моя история в Medialab Просте речення
Просте речення Реформы 1860 – 1870 гг. Исполнитель: Куликова Ю. Т-104
Реформы 1860 – 1870 гг. Исполнитель: Куликова Ю. Т-104 Training Manual
Training Manual Поиск информации и поисковые запросы
Поиск информации и поисковые запросы Тайный покупатель. Структура
Тайный покупатель. Структура Весна
Весна Патогенные спирохеты
Патогенные спирохеты  Валеология наука о здоровье
Валеология наука о здоровье Классный час «Выбор профессии в условиях рынка» Подготовила: Курчина Е. М. классный руководитель 11 класса МБОУ «СОШ№7» Гапч
Классный час «Выбор профессии в условиях рынка» Подготовила: Курчина Е. М. классный руководитель 11 класса МБОУ «СОШ№7» Гапч