Содержание
- 2. Углеводы Углеводы входят в состав клеток и тканей всех растительных и животных организмов и по массе
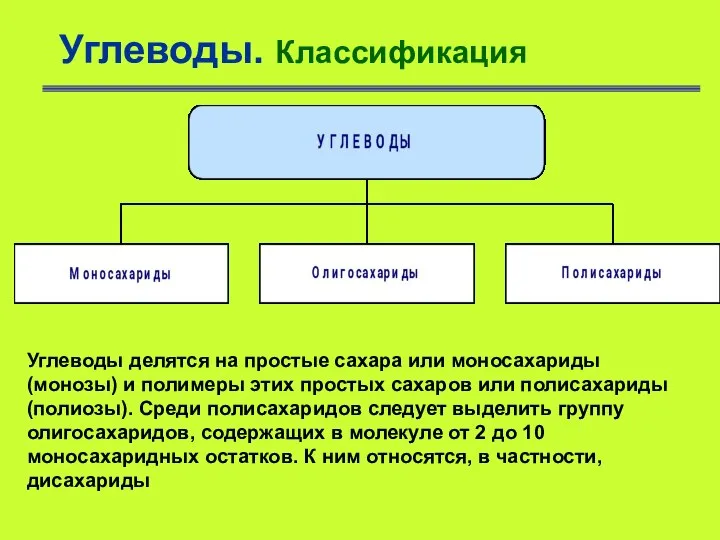
- 3. Углеводы. Классификация Углеводы делятся на простые сахара или моносахариды (монозы) и полимеры этих простых сахаров или
- 4. Углеводы. Классификация Сложные углеводы разделяют на: а) сахароподобные углеводы или олигосахариды, сладкие по вкусу соединения, состоящие
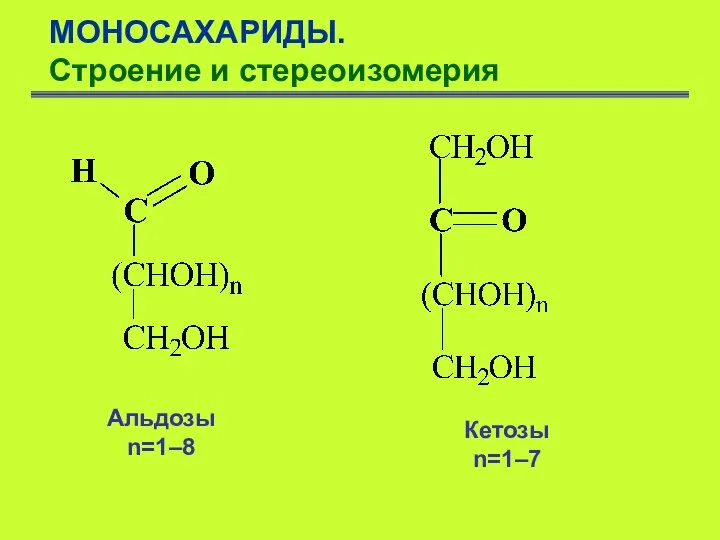
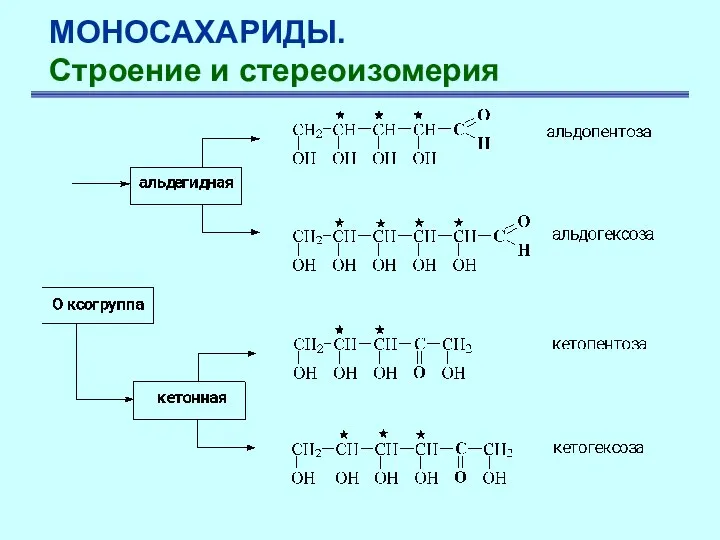
- 5. Моносахариды — это гетерофункциональные соединения, содержащие оксогруппу и несколько гидроксильных групп, т.е. полгидроксиальдегиды и полигидроксикетоны. МОНОСАХАРИДЫ.
- 6. МОНОСАХАРИДЫ. Строение и стереоизомерия Альдозы n=1–8 Кетозы n=1–7
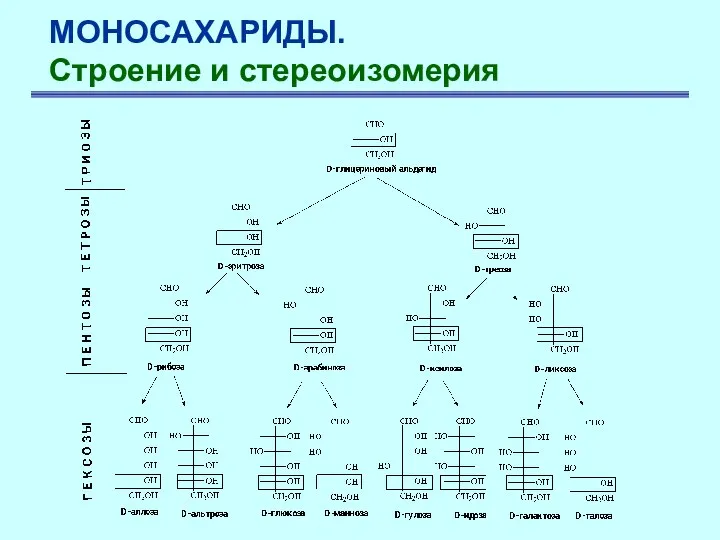
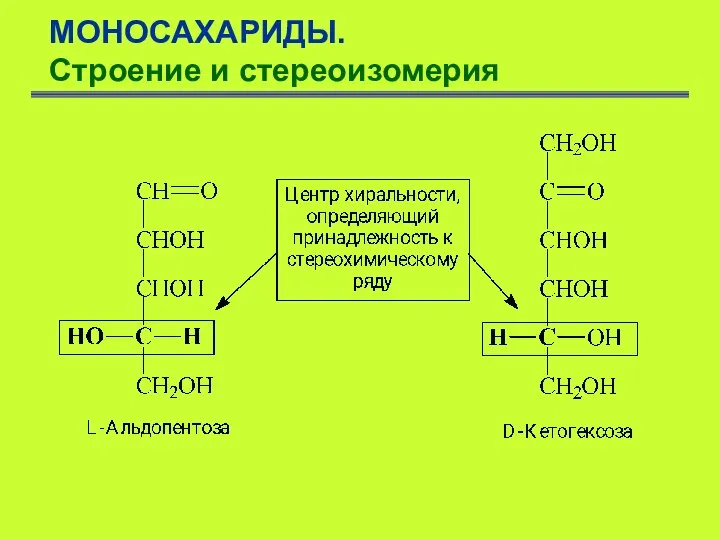
- 7. МОНОСАХАРИДЫ. Строение и стереоизомерия Моносахариды изображаются в виде проекционных формул Фишера, т.е. в виде проекции тетраэдрической
- 8. МОНОСАХАРИДЫ. Строение и стереоизомерия Установление абсолютной конфигурации, т.е. истинного расположения в пространстве заместителей у асимметрического атома
- 9. МОНОСАХАРИДЫ. Строение и стереоизомерия По R,S-номенклатуре D-(+)-глицериновый альдегид соответствует R-изомеру, L-(-) – S-изомеру. С конфигурацией их
- 10. МОНОСАХАРИДЫ. Строение и стереоизомерия
- 11. МОНОСАХАРИДЫ. Строение и стереоизомерия
- 12. МОНОСАХАРИДЫ. Строение и стереоизомерия
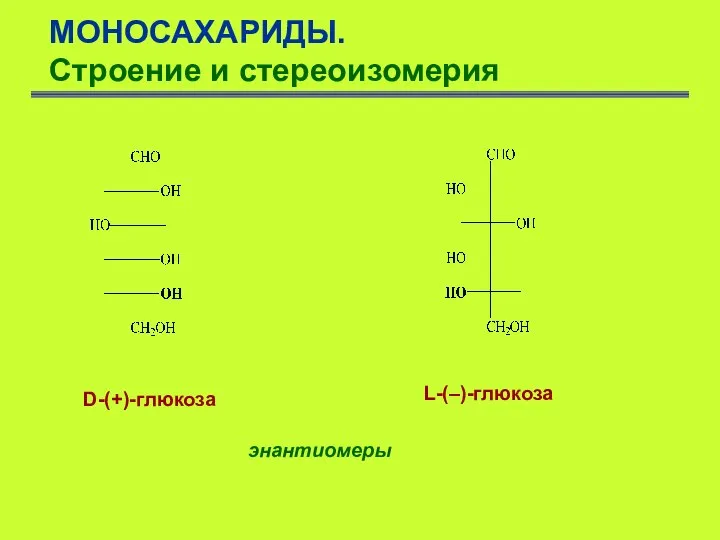
- 13. МОНОСАХАРИДЫ. Строение и стереоизомерия D-(+)-глюкоза L-(–)-глюкоза энантиомеры
- 14. МОНОСАХАРИДЫ. Строение и стереоизомерия Одновременно с введением в органическую химию представлений о строении глюкозы и других
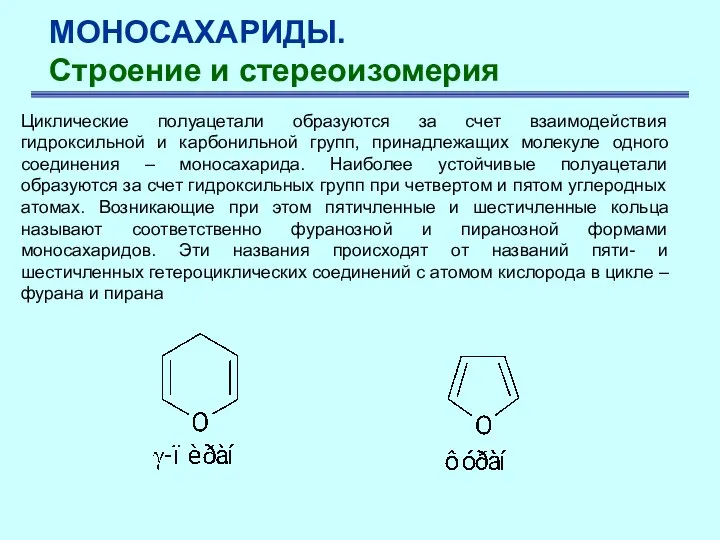
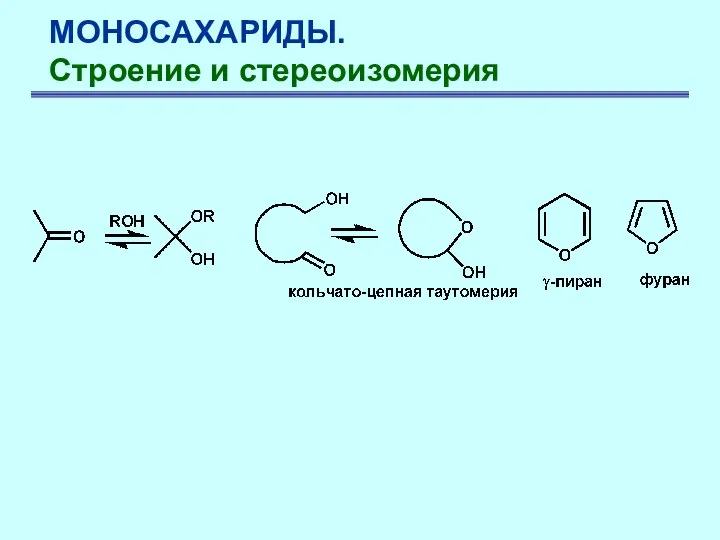
- 15. МОНОСАХАРИДЫ. Строение и стереоизомерия Циклические полуацетали образуются за счет взаимодействия гидроксильной и карбонильной групп, принадлежащих молекуле
- 16. МОНОСАХАРИДЫ. Строение и стереоизомерия
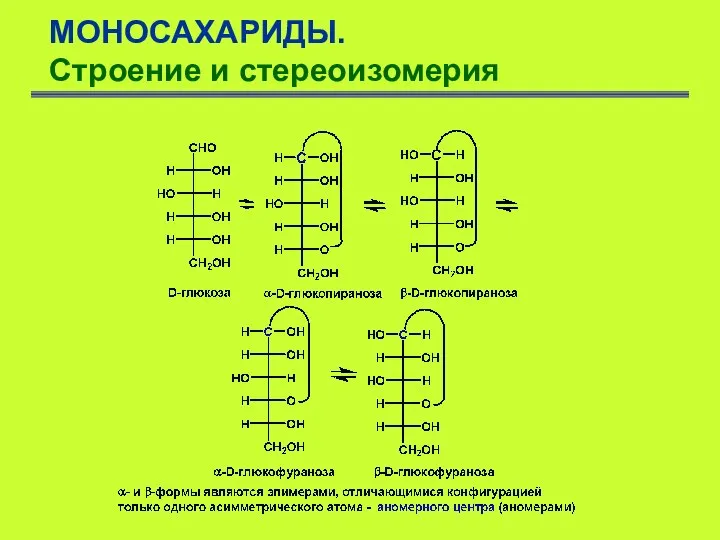
- 17. МОНОСАХАРИДЫ. Строение и стереоизомерия Моносахариды, имеющие циклическую форму, удобно изображать перспективными формулами Хеуорса. Они представляют собой
- 18. МОНОСАХАРИДЫ. Строение и стереоизомерия Циклические формы глюкозы являются внутренними полуацеталями: гидроксигруппа при атоме С5 присоединена к
- 19. МОНОСАХАРИДЫ. Строение и стереоизомерия
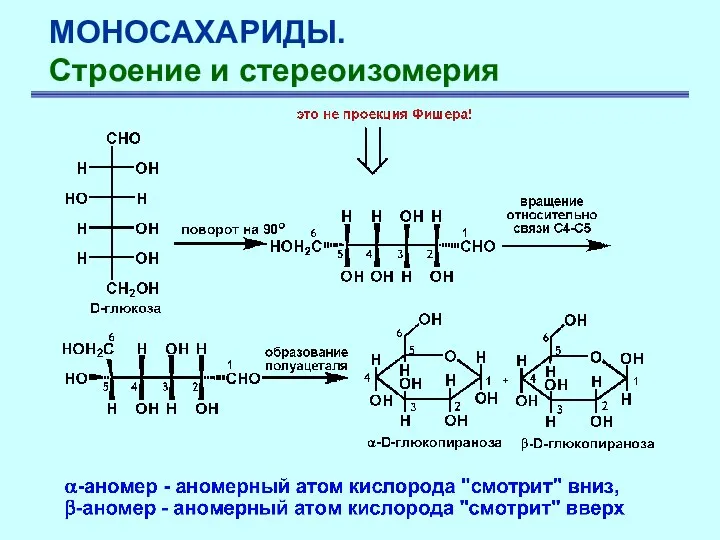
- 20. МОНОСАХАРИДЫ. Строение и стереоизомерия Имеется простой способ трансформации проекционной формулы Толленса в флормулу Хеуорса и наоборот.
- 21. МОНОСАХАРИДЫ. Строение и стереоизомерия
- 22. МОНОСАХАРИДЫ. Строение и стереоизомерия Фруктоза вместо альдегидной функции содержит оксогруппу. Поэтому ее пятичленная циклическая форма представляет
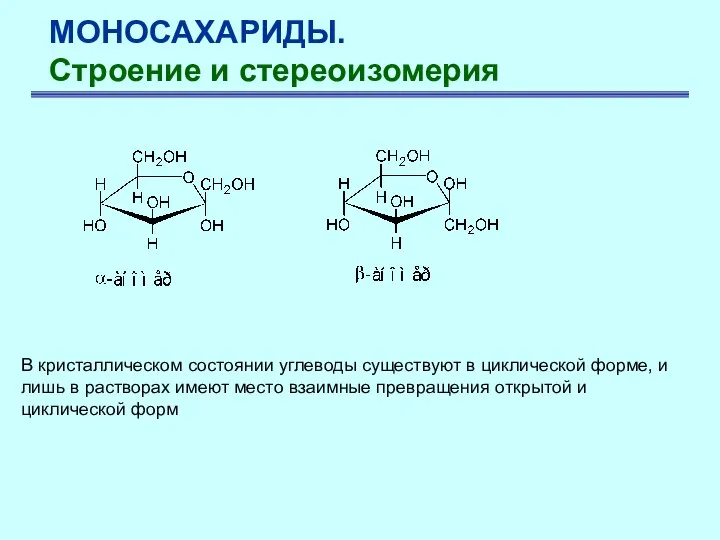
- 23. МОНОСАХАРИДЫ. Строение и стереоизомерия В кристаллическом состоянии углеводы существуют в циклической форме, и лишь в растворах
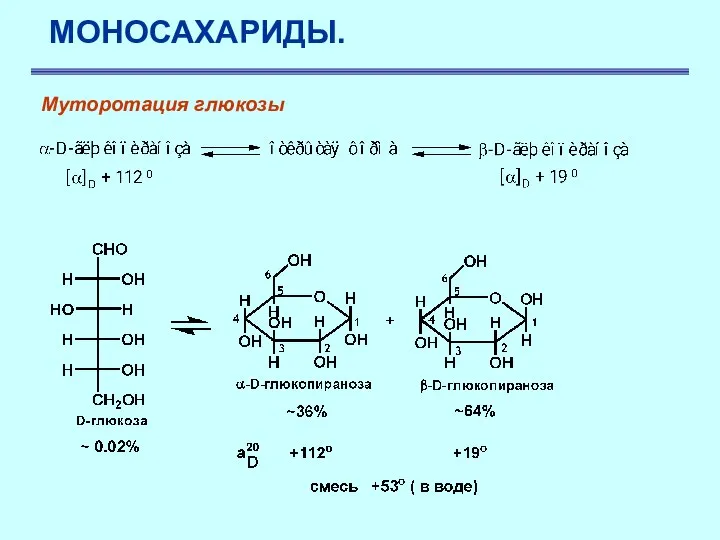
- 24. МОНОСАХАРИДЫ. Муторотация глюкозы Химические свойства Моносахариды проявляют свойства спиртов и карбонильных соединений Чистая α-D-глюкопираноза имеет угол
- 25. МОНОСАХАРИДЫ. Муторотация глюкозы
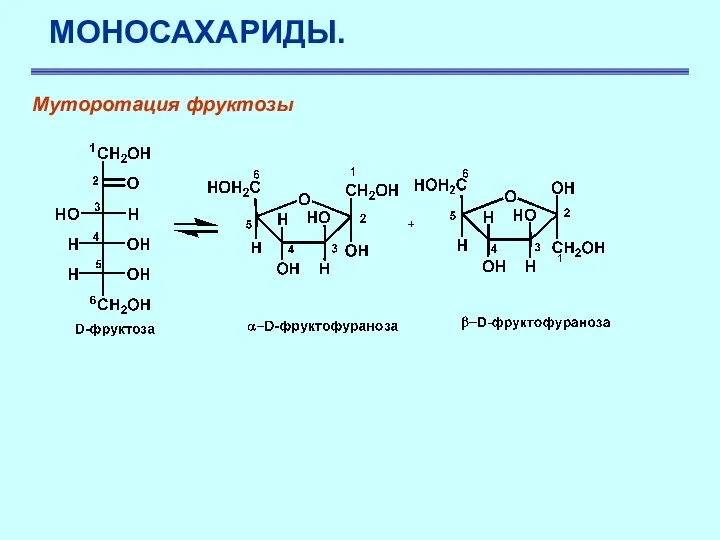
- 26. МОНОСАХАРИДЫ. Муторотация фруктозы
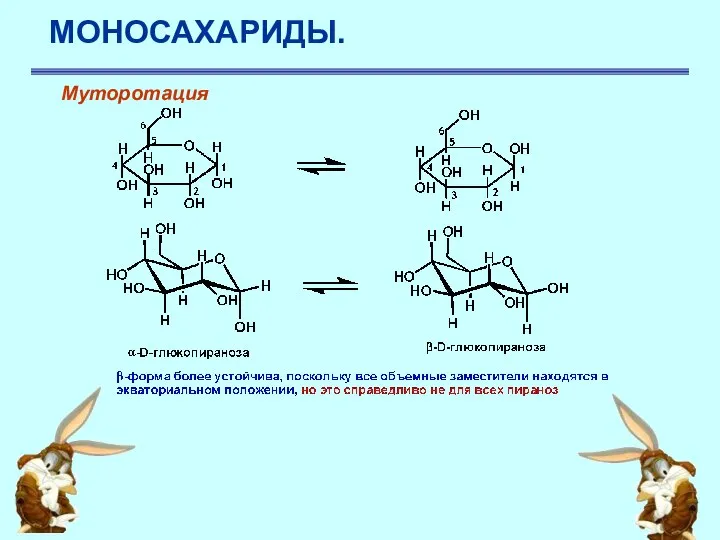
- 27. МОНОСАХАРИДЫ. Муторотация
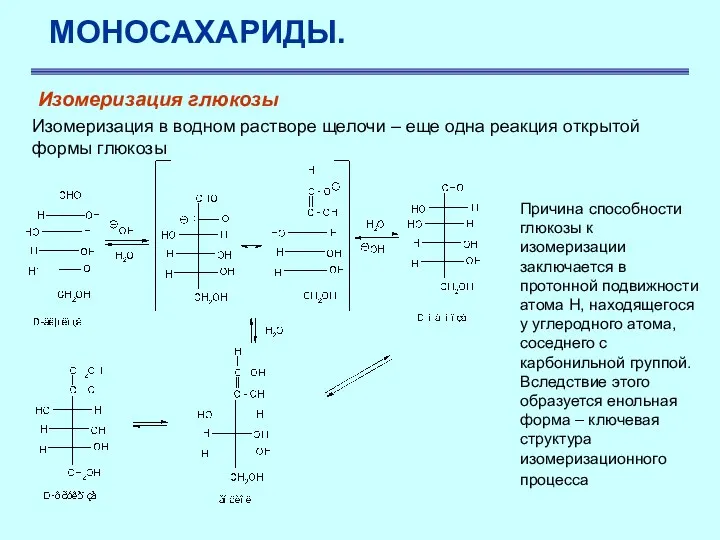
- 28. МОНОСАХАРИДЫ. Изомеризация глюкозы Изомеризация в водном растворе щелочи – еще одна реакция открытой формы глюкозы Причина
- 29. МОНОСАХАРИДЫ. Реакции по карбонильной группе 1. Окисление Как и у всех альдегидов, окисление моносахаридов мягкими окислителями
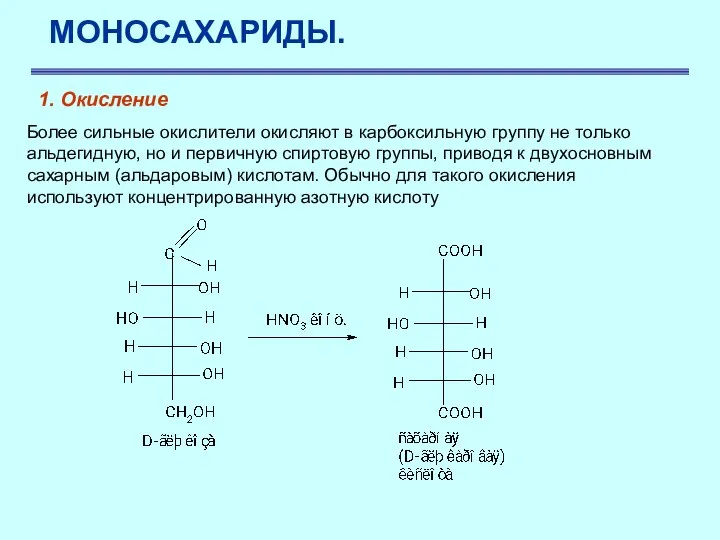
- 30. МОНОСАХАРИДЫ. 1. Окисление Более сильные окислители окисляют в карбоксильную группу не только альдегидную, но и первичную
- 31. МОНОСАХАРИДЫ. 2. Восстановление Восстановление сахаров приводит к многоатомным спиртам. В качестве восстановителя используют водород в присутствии
- 32. МОНОСАХАРИДЫ. 3. Реакции с фенилгидразином. Фенилозазоны Альдегидная группа альдоз реагирует с гидроксиламином и фенилгидразином. В мягких
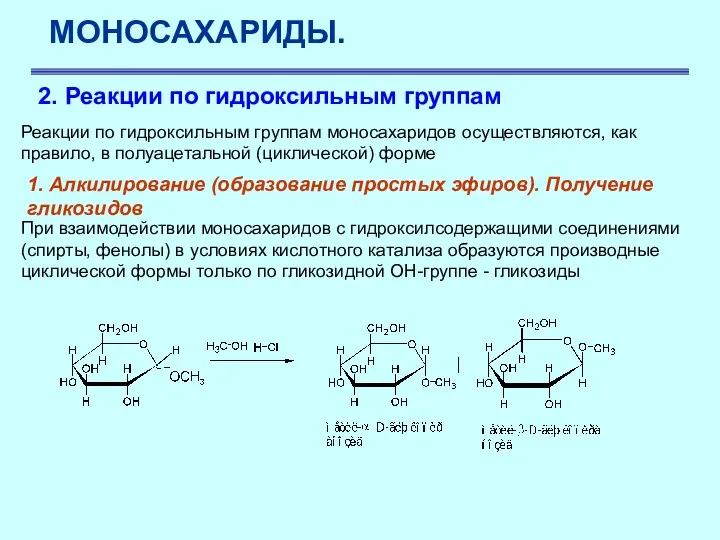
- 33. МОНОСАХАРИДЫ. 2. Реакции по гидроксильным группам Реакции по гидроксильным группам моносахаридов осуществляются, как правило, в полуацетальной
- 34. МОНОСАХАРИДЫ. 1. Алкилирование (образование простых эфиров). Получение гликозидов Механизм реакции следующий: происходит протонирование гликозидной гидроксильной группы,
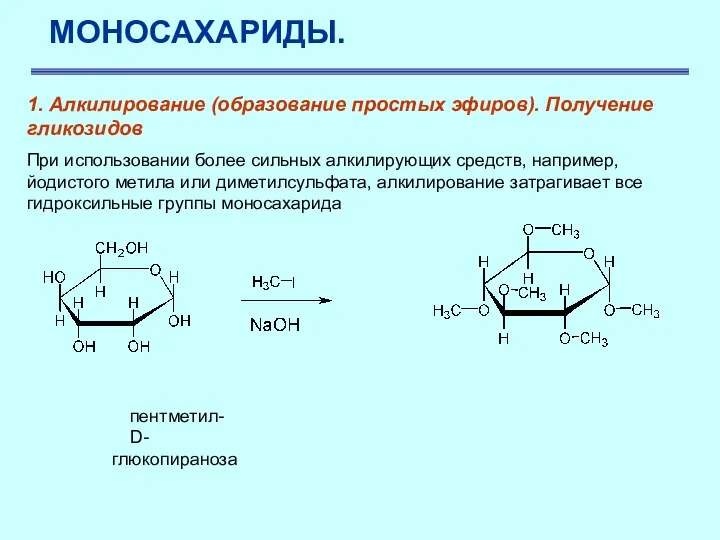
- 35. МОНОСАХАРИДЫ. 1. Алкилирование (образование простых эфиров). Получение гликозидов При использовании более сильных алкилирующих средств, например, йодистого
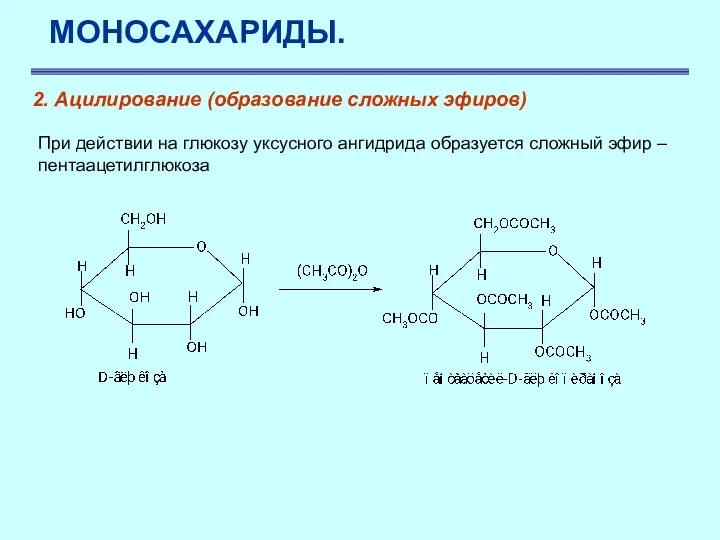
- 36. МОНОСАХАРИДЫ. При действии на глюкозу уксусного ангидрида образуется сложный эфир – пентаацетилглюкоза 2. Ацилирование (образование сложных
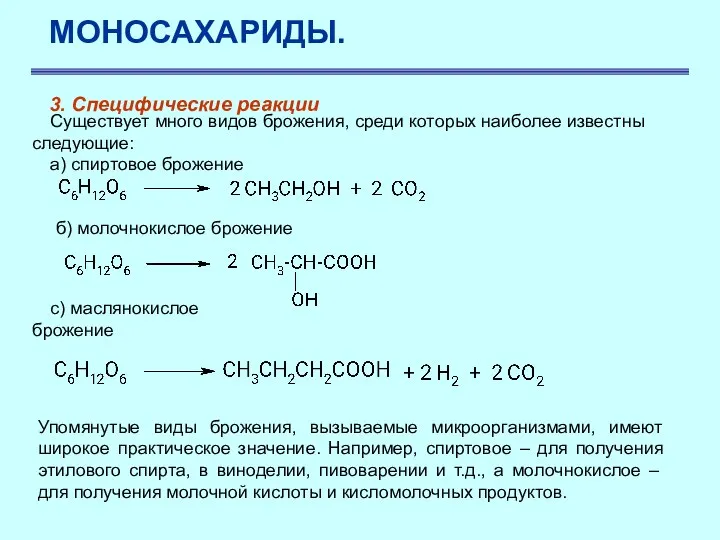
- 37. МОНОСАХАРИДЫ. 3. Специфические реакции Кроме приведенных выше, глюкоза характеризуется и некоторыми специфическими свойствами - процессами брожения.
- 38. МОНОСАХАРИДЫ. 3. Специфические реакции Существует много видов брожения, среди которых наиболее известны следующие: a) спиртовое брожение
- 39. ДИСАХАРИДЫ. Дисахариды (биозы) при гидролизе образуют два одинаковых или разных моносахарида. Для установления строения дисахаридов необходимо
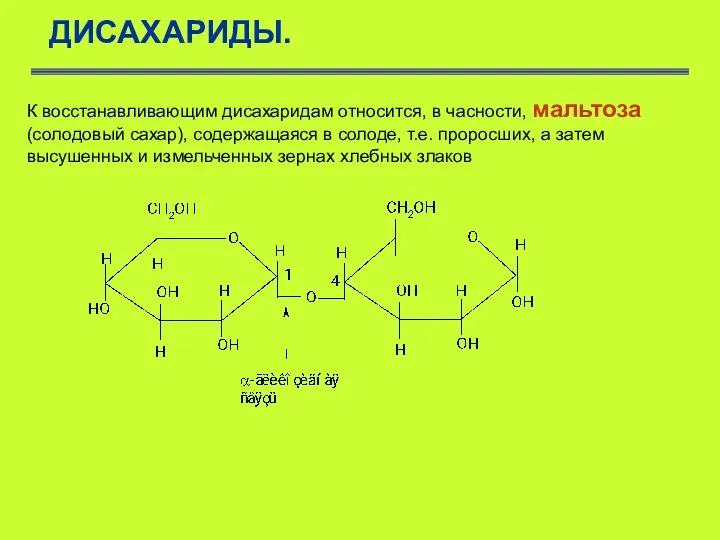
- 40. ДИСАХАРИДЫ. К восстанавливающим дисахаридам относится, в часности, мальтоза (солодовый сахар), содержащаяся в солоде, т.е. проросших, а
- 41. ДИСАХАРИДЫ. Мальтоза составлена из двух остатков D- глюкопиранозы, которые связаны (1–4) -гликозидной связью, т.е. в образовании
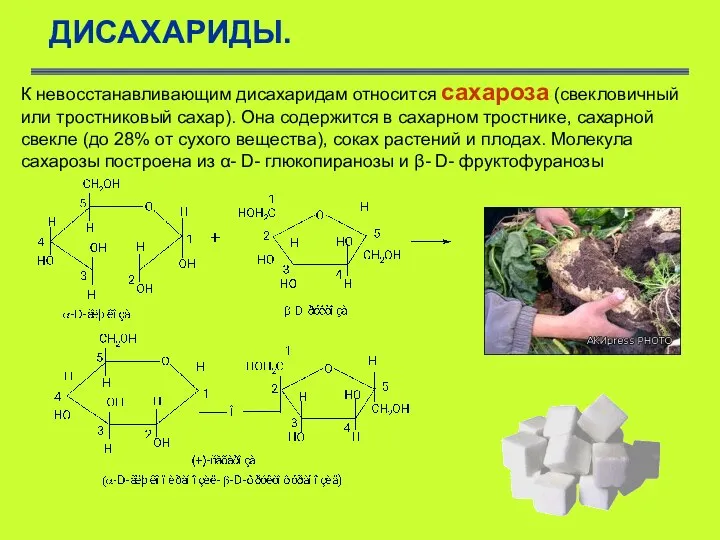
- 42. ДИСАХАРИДЫ. К невосстанавливающим дисахаридам относится сахароза (свекловичный или тростниковый сахар). Она содержится в сахарном тростнике, сахарной
- 43. ДИСАХАРИДЫ. В противоположность мальтозе гликозидная связь (1–2) между моносахаридами образуется за счет гликозидных гидроксилов обеих молекул,
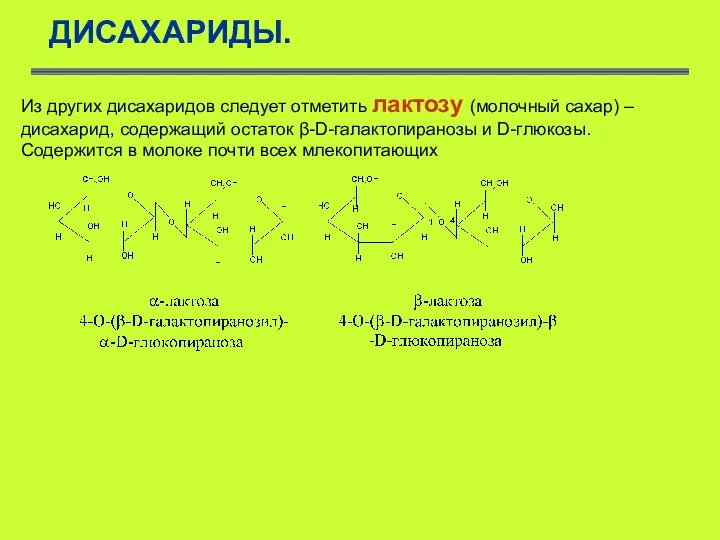
- 44. ДИСАХАРИДЫ. Из других дисахаридов следует отметить лактозу (молочный сахар) – дисахарид, содержащий остаток β-D-галактопиранозы и D-глюкозы.
- 45. ПОЛИСАХАРИДЫ Важнейшие из полисахаридов – это крахмал и целлюлоза (клетчатка). Они построены из остатков глюкозы. Общая
- 46. КРАХМАЛ Крахмал представляет собой смесь двух полисахаридов, построенных из α- D- глюкопиранозных звеньев: амилозы (10-20%) и
- 47. КРАХМАЛ При обработке крахмала теплой водой удается выделить две фракции: фракцию, растворимую в теплой воде и
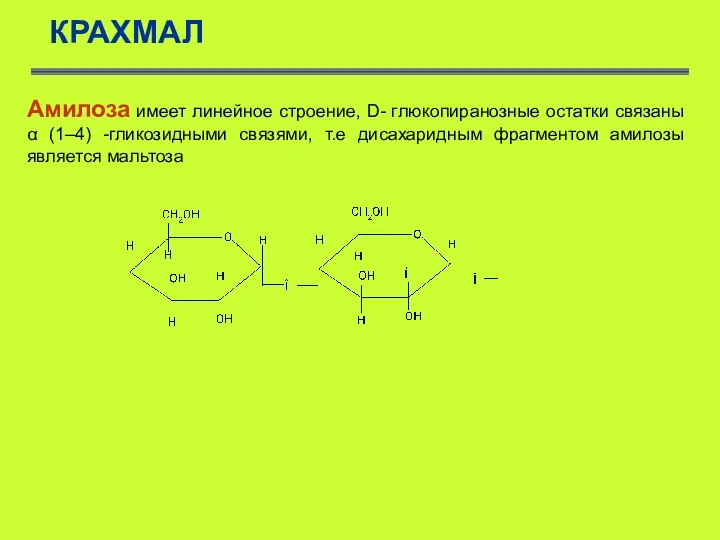
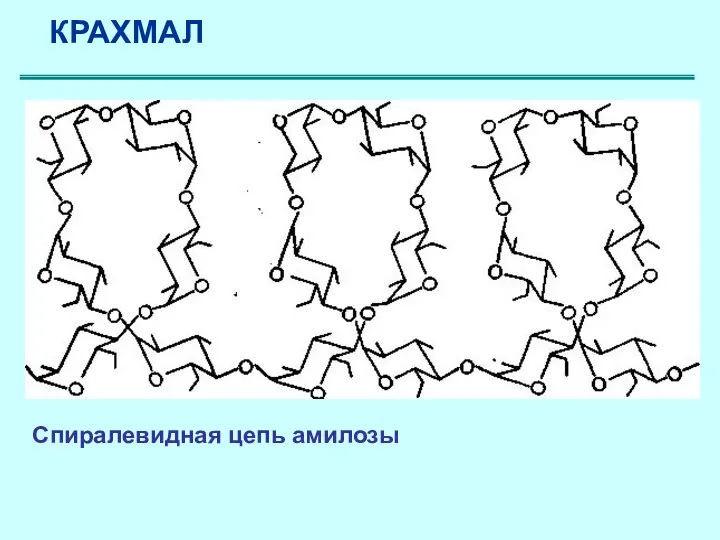
- 48. КРАХМАЛ Амилоза имеет линейное строение, D- глюкопиранозные остатки связаны α (1–4) -гликозидными связями, т.е дисахаридным фрагментом
- 49. Спиралевидная цепь амилозы КРАХМАЛ
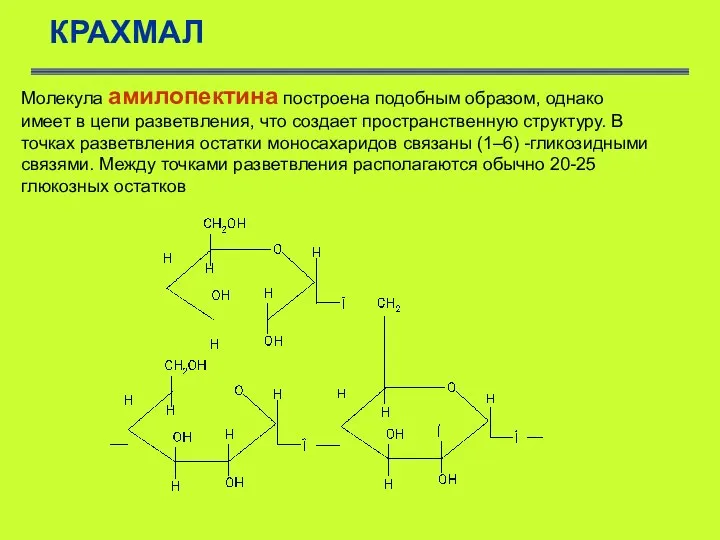
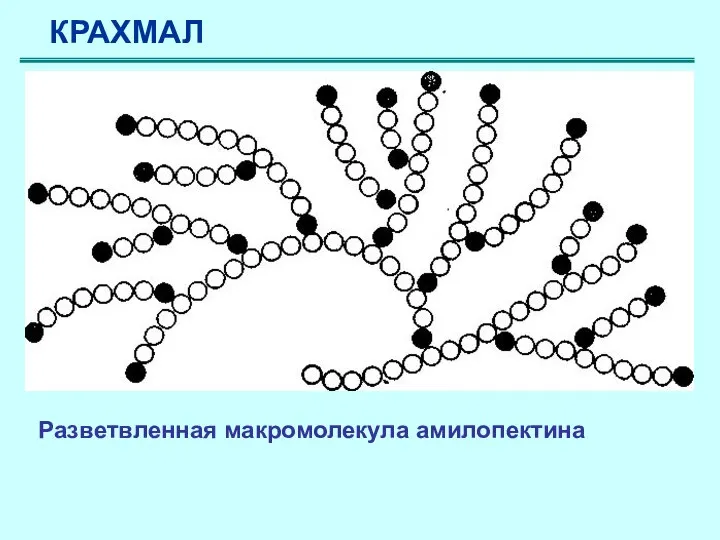
- 50. КРАХМАЛ Молекула амилопектина построена подобным образом, однако имеет в цепи разветвления, что создает пространственную структуру. В
- 51. Разветвленная макромолекула амилопектина КРАХМАЛ
- 52. КРАХМАЛ Крахмал легко подвергается гидролизу: при нагревании в присутствии серной кислоты образуется глюкоза В зависимости от
- 53. КРАХМАЛ Если гидролиз крахмала под действием ферментов или кислоты прервать на промежуточной стадии, то получают сиропообразную
- 54. КРАХМАЛ Качественной реакцией на крахмал является его взаимодействие с йодом – наблюдается интенсивное синее окрашивание. Такое
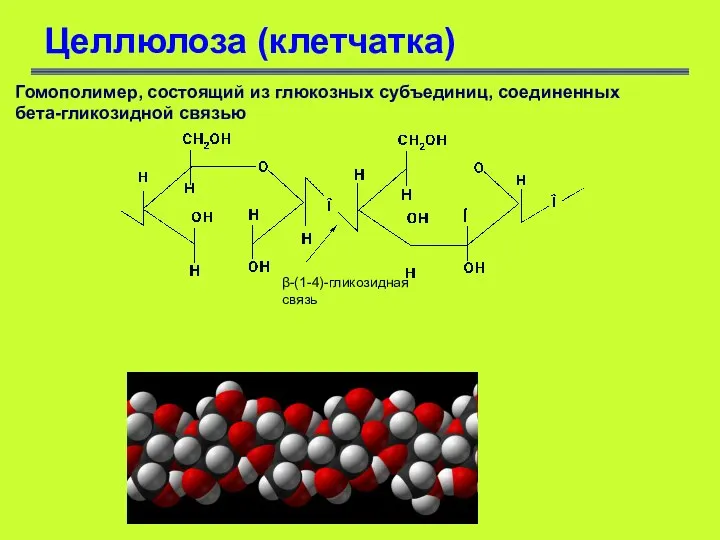
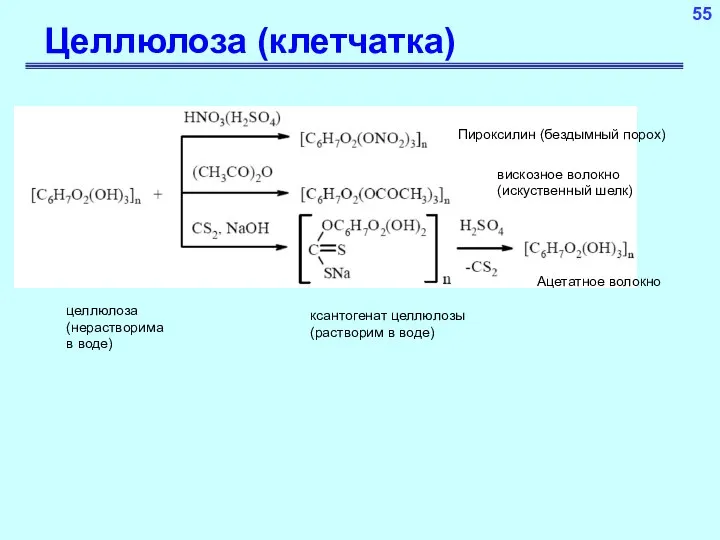
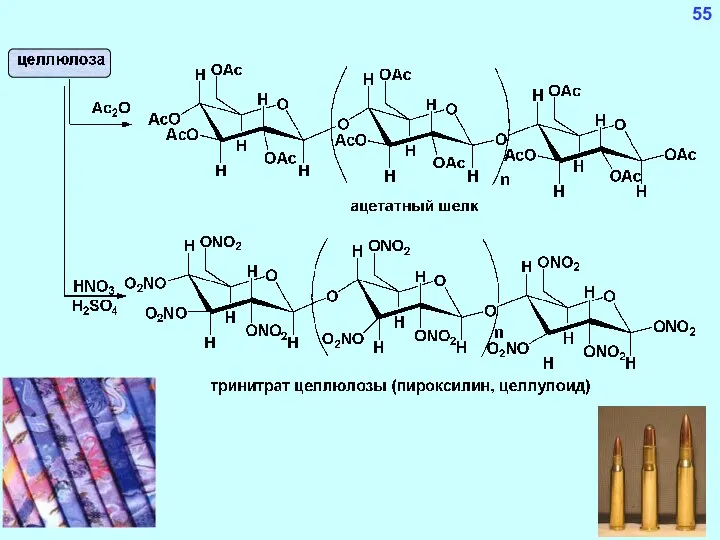
- 55. Целлюлоза (клетчатка) Гомополимер, состоящий из глюкозных субъединиц, соединенных бета-гликозидной связью β-(1-4)-гликозидная связь
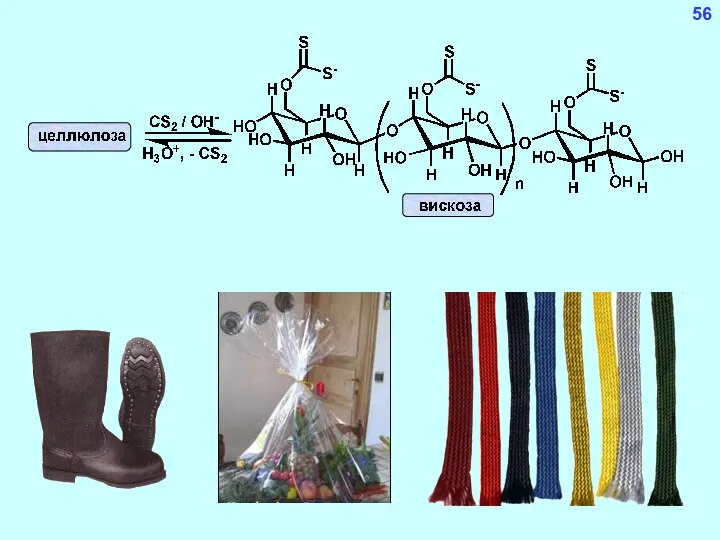
- 56. 55 Целлюлоза (клетчатка) целлюлоза (нерастворима в воде) ксантогенат целлюлозы (растворим в воде) Пироксилин (бездымный порох) Ацетатное
- 57. 55
- 58. 56
- 59. 57
- 60. 57
- 61. 57
- 63. Скачать презентацию




























 Подгруппа углерода
Подгруппа углерода Продвижение в инстаграм
Продвижение в инстаграм Müssen
Müssen Аттестационная работа. Методическая разработка по выполнению проекта «Гимнастическая скакалка»
Аттестационная работа. Методическая разработка по выполнению проекта «Гимнастическая скакалка» Трансформаторы тока и напряжения
Трансформаторы тока и напряжения Усиление металлических конструкций
Усиление металлических конструкций Организация и проведение криминологического исследования
Организация и проведение криминологического исследования Сборная Новосибирской области по рыболовному спорту
Сборная Новосибирской области по рыболовному спорту ЯДЫ и противоядия Ученица 9-А класса Найда Анна
ЯДЫ и противоядия Ученица 9-А класса Найда Анна Общее устройство автомобиля
Общее устройство автомобиля Органы государственной власти РФ
Органы государственной власти РФ ТЕМА 4. ПОНЯТИЕ О РЯДЕ РАСПРЕДЕЛЕНИЯ. ВИДЫ РЯДОВ РАСПРЕДЕЛЕНИЯ
ТЕМА 4. ПОНЯТИЕ О РЯДЕ РАСПРЕДЕЛЕНИЯ. ВИДЫ РЯДОВ РАСПРЕДЕЛЕНИЯ  Презентация Современные демографические проблемы России и пути их решения_
Презентация Современные демографические проблемы России и пути их решения_ Динамика распространения волн в упругой среде . Ур-ие Даламбера
Динамика распространения волн в упругой среде . Ур-ие Даламбера  «Технические проекты Леонардо да Винчи».
«Технические проекты Леонардо да Винчи».  Методы обследования памяти
Методы обследования памяти  Черные дыры презентация
Черные дыры презентация Вологодские художники
Вологодские художники Ортогональные проекции прямой
Ортогональные проекции прямой Экономические методы социальной работы К основным экономическим методам решения этой комплексной социальной задачи можно от
Экономические методы социальной работы К основным экономическим методам решения этой комплексной социальной задачи можно от Презентация Пасты белковые и пастообразные продукты
Презентация Пасты белковые и пастообразные продукты Аускультация сердца Шумы сердца
Аускультация сердца Шумы сердца Зубофрезерные станки
Зубофрезерные станки Доц.д-р Десислава Бошнакова, зам. ректор на НБУ и управител на ROI Communication правим специални събития, а не просто събития? Защо. - презен
Доц.д-р Десислава Бошнакова, зам. ректор на НБУ и управител на ROI Communication правим специални събития, а не просто събития? Защо. - презен Глаза – органы зрения
Глаза – органы зрения  ВКР: Оценочные понятия гражданского права: разумность, добросовестность, существенность
ВКР: Оценочные понятия гражданского права: разумность, добросовестность, существенность Презентация "Карл Брюллов" - скачать презентации по МХК
Презентация "Карл Брюллов" - скачать презентации по МХК Презентация Возможность создания специального налогового режима в Крыму
Презентация Возможность создания специального налогового режима в Крыму