Содержание
- 2. Кинетика − раздел химии, изучающий механизмы химических реакций и скорости их протекания. Скорость − изменение концентрации
- 3. Для реакции в общем виде aA + bB → xX + yY скорость описывается кинетическим уравнением:
- 4. 1. Природа реагирующих веществ: определяется видом частиц (атомы, молекулы, ионы). 2. Концентрация реагирующих веществ: описывается законом
- 5. 3. Температура: описывается правилом Вант-Гоффа Для химических реакций γ = 2-4, для ферментативных γ = 7-9.
- 6. Для эффективного взаимодействия частицы должны: 1. столкнуться; 2. иметь благоприятную ориентацию; 3. обладать достаточной энергией. Основные
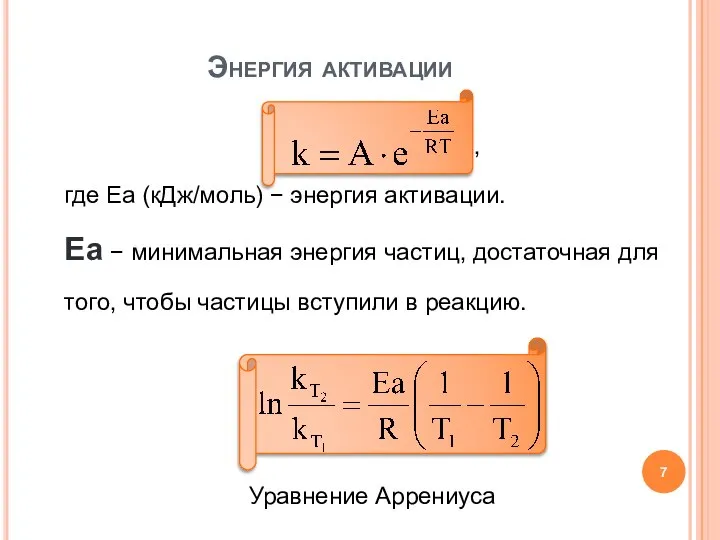
- 7. , где Еа (кДж/моль) − энергия активации. Еа − минимальная энергия частиц, достаточная для того, чтобы
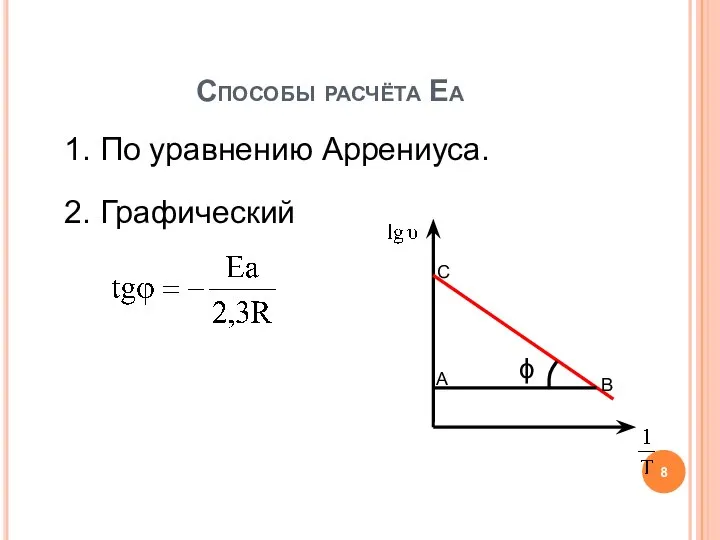
- 8. 1. По уравнению Аррениуса. 2. Графический Способы расчёта Еа ϕ C A B
- 9. Число молекул реагентов, участвующих в простой одностадийной реакции, состоящей из одного элементарного акта, называется МОЛЕКУЛЯРНОСТЬЮ реакции.
- 10. … ∑ всех показателей степеней концентраций реагирующих веществ в ЗДМ. ; П = a + b
- 11. Кинетические уравнения для элементарных реакций 0, I и II порядка
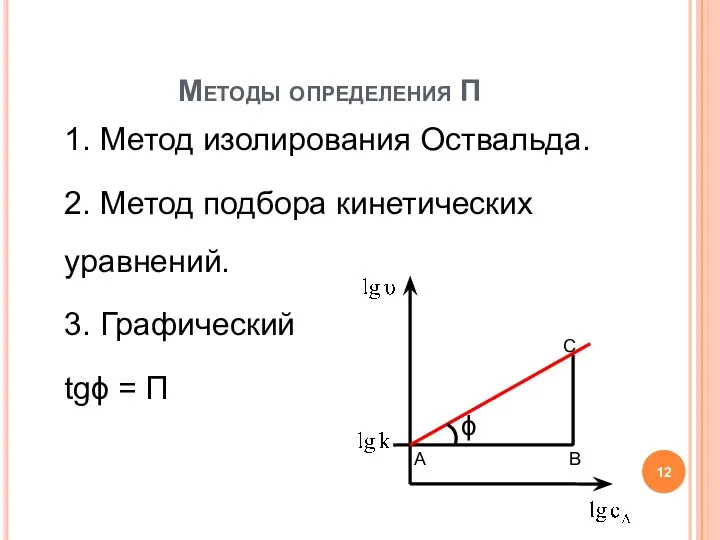
- 12. 1. Метод изолирования Оствальда. 2. Метод подбора кинетических уравнений. 3. Графический tgϕ = П Методы определения
- 13. 4. Ката́лиз (от греч. κατάλυσις, восходит к καταλύειν — разрушение) — явление изменения скорости химической или
- 14. Катализа́тор — … …вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. В отношении катализатора
- 15. 1. Гомогенный катализ – катализатор находится в одной фазе с субстратом. Характерным примером является кислотно-основный катализ,
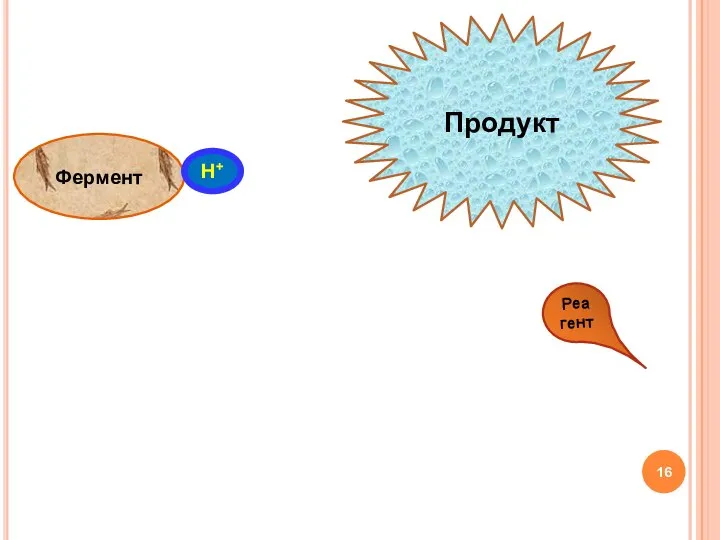
- 16. Фермент Н+ Субстрат Реагент Продукт
- 17. 2. Гетерогенный катализ – катализатор и субстрат находятся в разных фазах. Особенность таких катализаторов − наличие
- 18. 3. Ферментативный катализ (биокатализ) – ускорение биохимических реакций при участии белковых макромолекул, называемых ферментами (энзимами). Этот
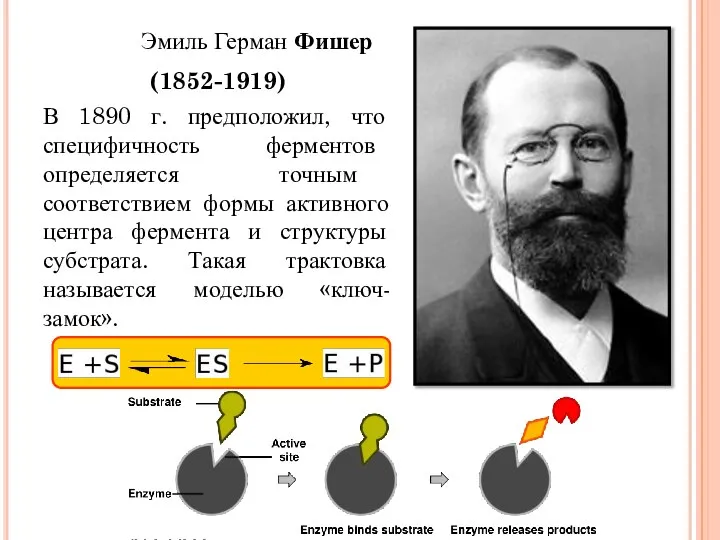
- 19. Эмиль Герман Фишер (1852-1919) В 1890 г. предположил, что специфичность ферментов определяется точным соответствием формы активного
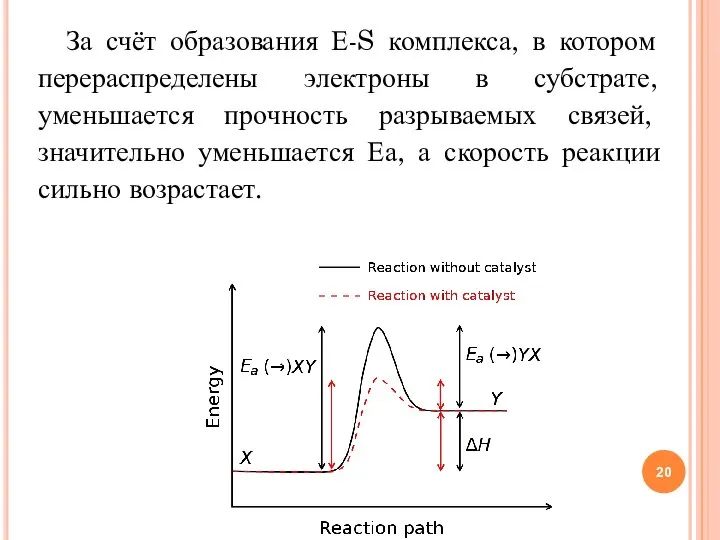
- 20. За счёт образования Е-S комплекса, в котором перераспределены электроны в субстрате, уменьшается прочность разрываемых связей, значительно
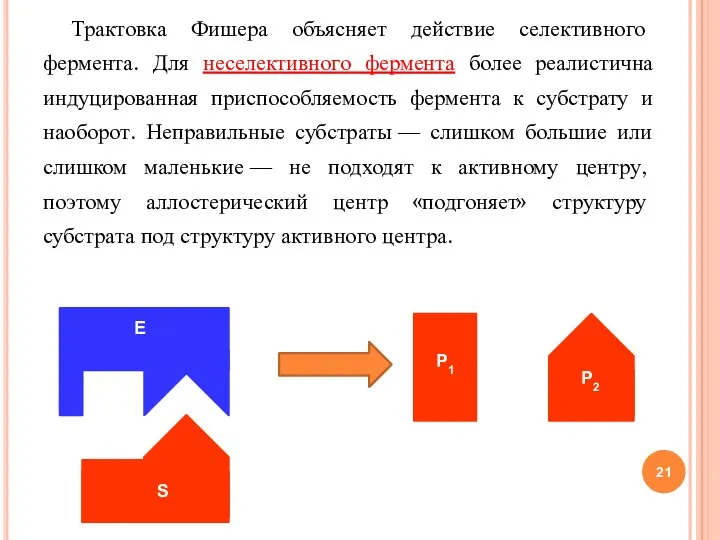
- 21. Трактовка Фишера объясняет действие селективного фермента. Для неселективного фермента более реалистична индуцированная приспособляемость фермента к субстрату
- 22. Уравнение Михаэ́лиса – Ме́нтен — описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента.
- 23. Графическое отображение уравнения Михаэлиса–Ментен При низких [S] − реакция I порядка; V=k[S] При высоких [S] −
- 24. Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее течение различных химических реакций. Ферментативный ингибитор
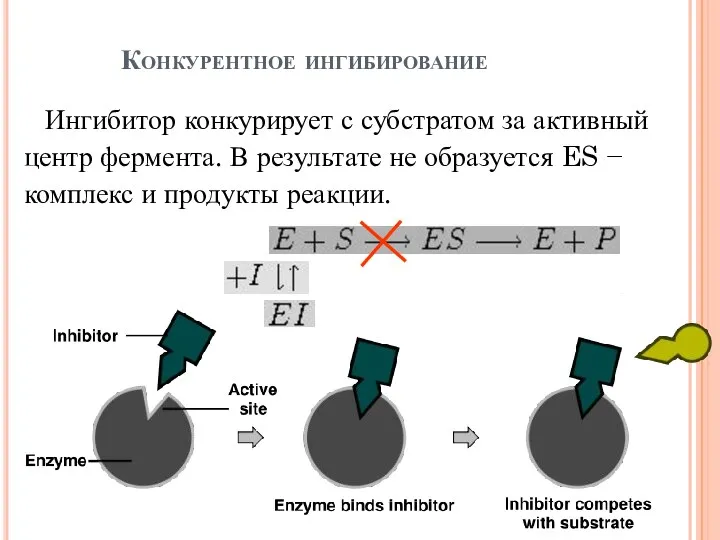
- 25. Конкурентное ингибирование Ингибитор конкурирует с субстратом за активный центр фермента. В результате не образуется ES −
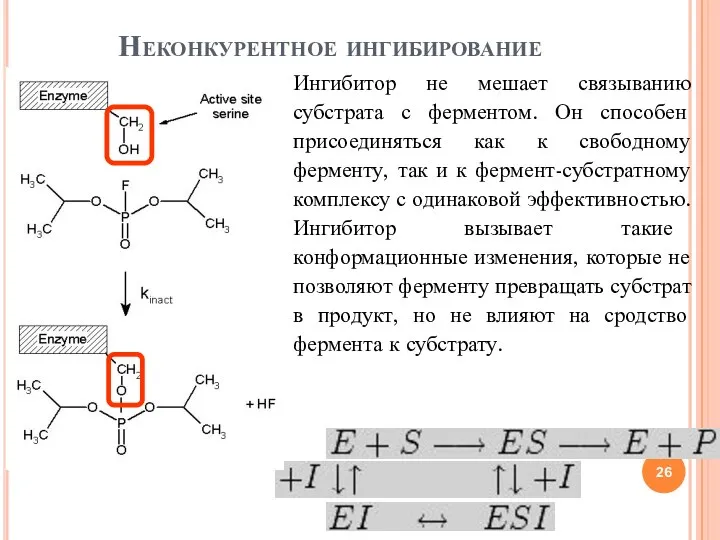
- 26. Неконкурентное ингибирование Ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту,
- 27. E I S E
- 29. Скачать презентацию














![Графическое отображение уравнения Михаэлиса–Ментен При низких [S] − реакция I порядка;](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304797/slide-22.jpg)


 Parametric Linear Programming
Parametric Linear Programming Страшный суд
Страшный суд Презентация на тему "Использование ИКТ на уроках обществознания (область «право»)" - скачать презентации по Педагогике
Презентация на тему "Использование ИКТ на уроках обществознания (область «право»)" - скачать презентации по Педагогике Прямая и плоскость
Прямая и плоскость  Одеський обласний осередок “Демократичного Альянсу”. Звіт про діяльність осередку
Одеський обласний осередок “Демократичного Альянсу”. Звіт про діяльність осередку Культурологическая теория Н.Я. Данилевского
Культурологическая теория Н.Я. Данилевского Открытое занятие «Введение в дополнительную образовательную программу»
Открытое занятие «Введение в дополнительную образовательную программу» Инновационная политика и научные технологии в системе ГРЭ Подготовили студенты гр. Т-091 Шабан К., Корженевский А., Королевич А., Вани
Инновационная политика и научные технологии в системе ГРЭ Подготовили студенты гр. Т-091 Шабан К., Корженевский А., Королевич А., Вани Отчет по производственной практике г. Когалым ПАО “ЛУКОЙЛ". Синхронные электродвигатели привода насосов
Отчет по производственной практике г. Когалым ПАО “ЛУКОЙЛ". Синхронные электродвигатели привода насосов Аттестационная работа. Значимость конструкторской и проектноисследовательской деятельности в учебных программах по робототехни
Аттестационная работа. Значимость конструкторской и проектноисследовательской деятельности в учебных программах по робототехни Город Будущего. Город Взаимозависимости
Город Будущего. Город Взаимозависимости Презентация Металлоизделия
Презентация Металлоизделия Алтернативни извори на енергија Хидроген Сончева енергија Ветер Етанол Биодизел
Алтернативни извори на енергија Хидроген Сончева енергија Ветер Етанол Биодизел Перспектива – вид центральной проекции
Перспектива – вид центральной проекции Буддизм
Буддизм Представления древних людей о вселенной
Представления древних людей о вселенной Презентация Анализ внешней и внутренней среды поставок ГМК "Норильский никель"
Презентация Анализ внешней и внутренней среды поставок ГМК "Норильский никель" Спеціалізована арендна дільниця з ремонту холодильної техніки з розробкою технологічного процесу
Спеціалізована арендна дільниця з ремонту холодильної техніки з розробкою технологічного процесу Принцип работы сканирующих зондовых микроскопов. Пьезокерамические сканеры.
Принцип работы сканирующих зондовых микроскопов. Пьезокерамические сканеры. Развитие гибкости
Развитие гибкости Новгородский областной колледж искусств им. С.В. Рахманинова
Новгородский областной колледж искусств им. С.В. Рахманинова Золотые руки мастеров. Труд на Руси (для дошкольников)
Золотые руки мастеров. Труд на Руси (для дошкольников) викторина животные - презентация для начальной школы
викторина животные - презентация для начальной школы Основы JDBC (Java DataBase Connectivity)
Основы JDBC (Java DataBase Connectivity) Использование информационно-коммуникационных технологий на уроках русского языка как средство развития универсальных умений
Использование информационно-коммуникационных технологий на уроках русского языка как средство развития универсальных умений  Процессы, приводящие к потере автомобилей работоспособности
Процессы, приводящие к потере автомобилей работоспособности Статические модели объектно-ориентированных программных систем
Статические модели объектно-ориентированных программных систем Смертная казнь, как высшая мера наказания
Смертная казнь, как высшая мера наказания