Содержание
- 6. Фтор F2 Э + F2 → Э+νFν–I (ν - высшая возможная степень окисления; Э – все,
- 8. Взаимодействие с металлами Взаимодействие с водородом
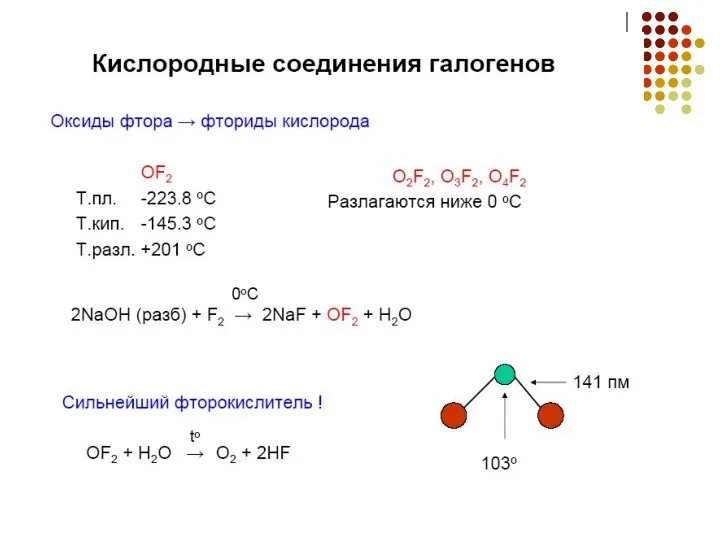
- 12. Соединения фтора. Фтороводород Фтороводород HF : (HF)n т.кип. +19,5 °С, неограниченно растворим в воде Протонодонорные свойства:
- 13. Фтороводород SiO2 + 4HF(г) = SiF4↑ + 2H2O (травление стекла) SiO2 + 6HF (изб.) = =H2[SiF6]
- 29. ИНЕРТНЫЕ ГАЗЫ Значения I1 слишком велики, чтобы затраты энергии на образование катиона Э+ были компенсированы энергией,
- 30. Соединения включения – клатраты (clatratus - греч. закрытый решеткой) Построены по принципу гость - хозяин. Хозяин
- 31. КЛАТРАТЫ Первые клатраты были получены в 1896 г. французским ученым Вийяром. Замораживая воду в присутствии Ar,
- 32. Способность инертных газов к образованию химических соединений открыта сравнительно недавно. В настоящее время лучше изучена химия
- 33. Соединения ксенона Ксенон - первый разрушил миф о химической инертности благородных газов. Первые соединения получены Нилом
- 34. Далее он обратил внимание на то, что потенциал ионизации дикислорода и ксенона очень близки по значению:
- 35. Фториды ксенона На сегодняшний день известны:
- 36. Химические свойства фторидов ксенона Окислительные свойства: сильные окислители XeF2(aq) + 2H+ + 2e = Xe +
- 37. чрезвычайно чувствителен даже к следам воды (например, в воздухе), требуется тщательная защита). Протекает гидролиз, который сопровождается
- 38. Комплексообразование XeF6 + CsF → Cs[XeF7] - бесцв. крист., разлагаются при ~ 50 оС XeF6 +
- 39. Известные соли: Na4XeO6⋅8H2O, Ba2XeO6⋅nH2O Ba2XeO6 + 8H2SO4 → 2BaSO4 + 2H2O + XeO4 перксенат конц. XeO4
- 40. Соединения криптона Соединения криптона менее устойчивы, чем ксенона, например: XeF2 - термод. стабилен ( ). KrF2
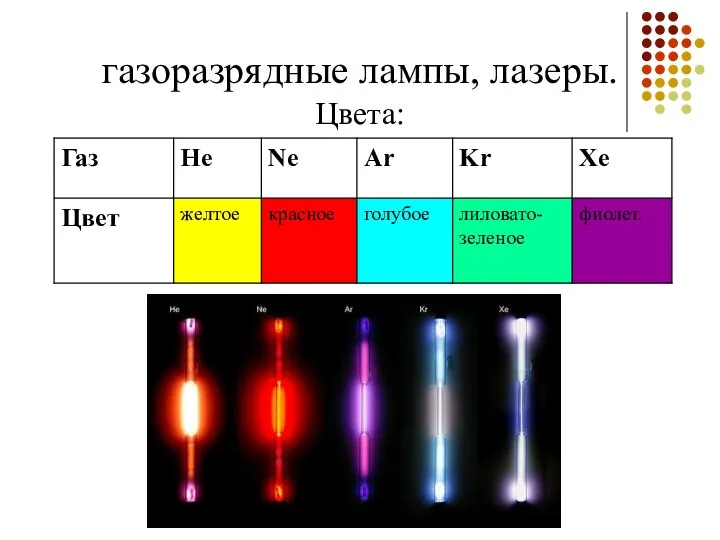
- 41. газоразрядные лампы, лазеры. Цвета:
- 42. гелий-кислородные дыхательные смеси для подводников (гелий в отличие от азота практически не растворяется в плазме крови
- 44. Скачать презентацию























![Комплексообразование XeF6 + CsF → Cs[XeF7] - бесцв. крист., разлагаются при](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1291550/slide-37.jpg)



 Презентация "Луис Комфорт Тиффани" - скачать презентации по МХК
Презентация "Луис Комфорт Тиффани" - скачать презентации по МХК Тепловые машины и КПД
Тепловые машины и КПД  Последствия и значение ВГО
Последствия и значение ВГО Салфетки. Способы складывания салфеток
Салфетки. Способы складывания салфеток Украинская православная церковь
Украинская православная церковь Исследовательская и проектная деятельность школьников Круткова Светлана Анатольевна МОУ «Ашпанская ООШ»
Исследовательская и проектная деятельность школьников Круткова Светлана Анатольевна МОУ «Ашпанская ООШ» Возникновение ислама. Арабский халифат
Возникновение ислама. Арабский халифат Задания по курсу Теория организации и организационное поведение «Анализ деятельности региональной компании»
Задания по курсу Теория организации и организационное поведение «Анализ деятельности региональной компании» Lab view run time installation
Lab view run time installation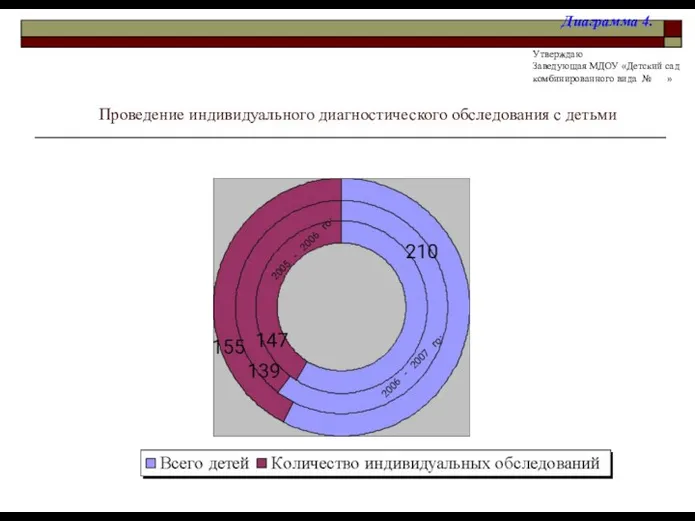 Проведение индивидуального диагностического обследования с детьми
Проведение индивидуального диагностического обследования с детьми  Настройка ПИД-регулятора
Настройка ПИД-регулятора Храм. Внешнее устройство
Храм. Внешнее устройство Христианская апологетика и история
Христианская апологетика и история Лептоспироз Выполнили: Попова Ксения, Столяр Елена, 2 курс фармацевтического факультета, 3 группа, 2011
Лептоспироз Выполнили: Попова Ксения, Столяр Елена, 2 курс фармацевтического факультета, 3 группа, 2011 Музеи, как рекреационные ресурсы познавательного мира
Музеи, как рекреационные ресурсы познавательного мира Develop a web application using the methods of expert analysis
Develop a web application using the methods of expert analysis Cities and attractions in the USA
Cities and attractions in the USA Виды рукавов в одежде
Виды рукавов в одежде Типы рыночных структур Проект по экономике для студентов 1 курса Авторы: Мельник Анастасия, Корякина Любовь
Типы рыночных структур Проект по экономике для студентов 1 курса Авторы: Мельник Анастасия, Корякина Любовь Врачебный контроль в физической культуре
Врачебный контроль в физической культуре Paris. La Capitale De La France
Paris. La Capitale De La France Instrumente und Applikationen WEB 2
Instrumente und Applikationen WEB 2 Алгоритмы и программирование, язык Паскаль (часть 3)
Алгоритмы и программирование, язык Паскаль (часть 3) Мембранная обработка молочного сырья
Мембранная обработка молочного сырья Казанский Базовый Медицинский Колледж ПРЕЗЕНТАЦИЯ Общение с больными на различных этапах медицинской службы. Выполнила
Казанский Базовый Медицинский Колледж ПРЕЗЕНТАЦИЯ Общение с больными на различных этапах медицинской службы. Выполнила Kinetika2
Kinetika2 Спортивная экипировка лыжника
Спортивная экипировка лыжника Простейший карбюратор
Простейший карбюратор