Содержание
- 2. * 1. Классификация химических реакций Химико-технологический процесс (ХТП) –это производственный процесс, при осуществлении которого изменяют химический
- 3. * 1. Классификация химических реакций Цель химической технологии – провести процесс как можно выгоднее, наиболее полно
- 4. * 1. Классификация химических реакций Для анализа хода процесса используются ТЭП: Степень превращения – это отношение
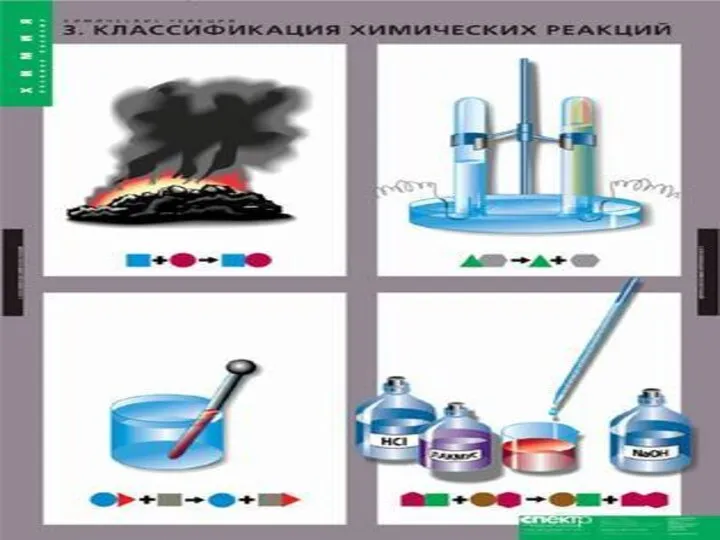
- 5. * 1. Классификация химических реакций В зависимости от фазового состава реагентов и продуктов : гетерогенные и
- 6. *
- 7. *
- 8. *
- 9. *
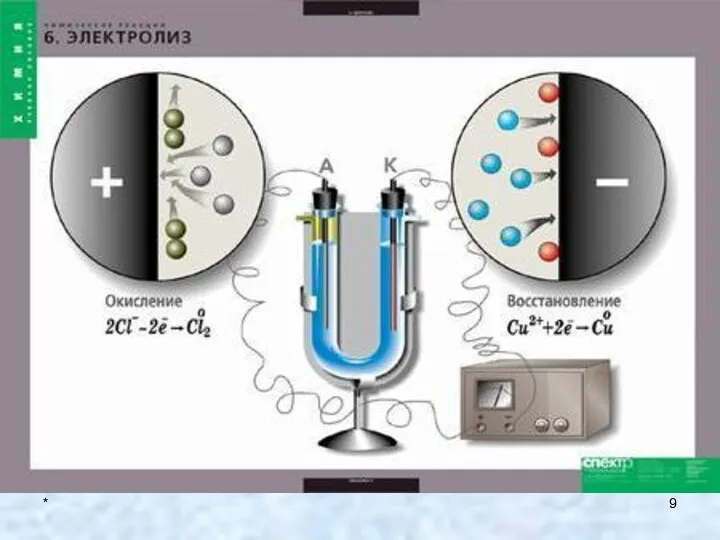
- 10. * 1. Классификация химических реакций Поскольку скорость реакции взаимодействия двух веществ пропорциональна произведению концентраций этих двух
- 11. *
- 12. * 2. Реакционная способность Одной из основных задач химии является установление зависимости между строением молекул, энергетическими
- 13. * 2. Реакционная способность Реакционная способность, характеристика химической активности веществ, учитывающая как разнообразие реакций, возможных для
- 14. * 2. Реакционная способность Количественно Реакционную способность выражают константами скоростей реакций или константами равновесия в случае
- 15. * 2. Реакционная способность Электронные смещения качественно описываются в терминах индуктивных и мезомерных эффектов, количественно —
- 16. * 2. Реакционная способность Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степени равной
- 17. * 2. Реакционная способность Закон действующих масс устанавливает связь между массами реагирующих веществ в химических реакциях
- 18. * 2. Реакционная способность где ai — активности веществ, выраженные через концентрации, парциальные давления либо мольные
- 19. * 2. Реакционная способность На практике в расчётах, не требующих особой точности, значения активности обычно заменяются
- 20. * 2. Реакционная способность Химическое равновесие — состояние химической системы, при котором возможны реакции, идущие с
- 21. * 2. Реакционная способность Все химические реакции, в принципе, обратимы. Это означает, что в реакционной смеси
- 22. * 2. Реакционная способность Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации.
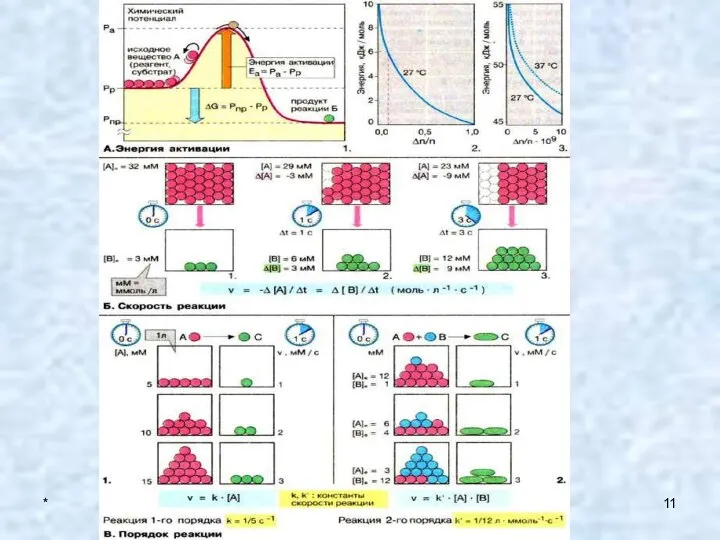
- 23. * 2. Реакционная способность Для того, чтобы совершился элементарный акт химического взаимодействия, реагирующие частицы должны столкнуться
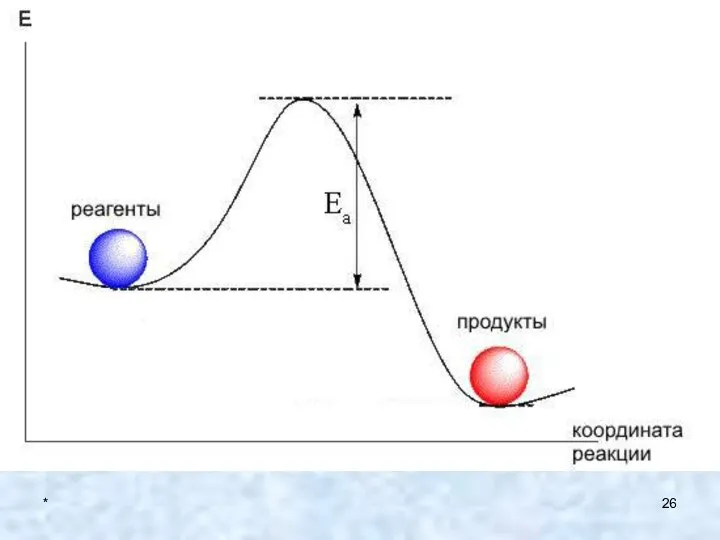
- 24. * 2. Реакционная способность Энергия активации в химии и биологии — минимальное количество энергии, которую требуется
- 25. * 2. Реакционная способность В химической модели, известной как Теория активных соударений, есть три условия, необходимых
- 26. *
- 27. * 2. Реакционная способность При низкой (для определённой реакции) температуре большинство молекул обладают энергией меньшей, чем
- 28. * 2. Реакционная способность r = Gпродукта/(V*t) = (GнА – GкА) / (V*t) =GB / (V*t)
- 29. * P - давление T – температура V – объем Q - теплота U – внутренняя
- 30. * Q>0, ΔH экзотермическая Q 0 - реакция эндотермическая
- 31. * Стандартные условия: t=25°C, T=298K P=1 атм. Стандартная энтальпия образования вещества:
- 32. * Энтропийный фактор: Энергия Гиббса:
- 33. * Энергия Гиббса характеризует динамику, направленность химического процесса: - возможно самопроиз- вольное протекание процесса. - реакция
- 34. * - энтальпия(теплосодержание)
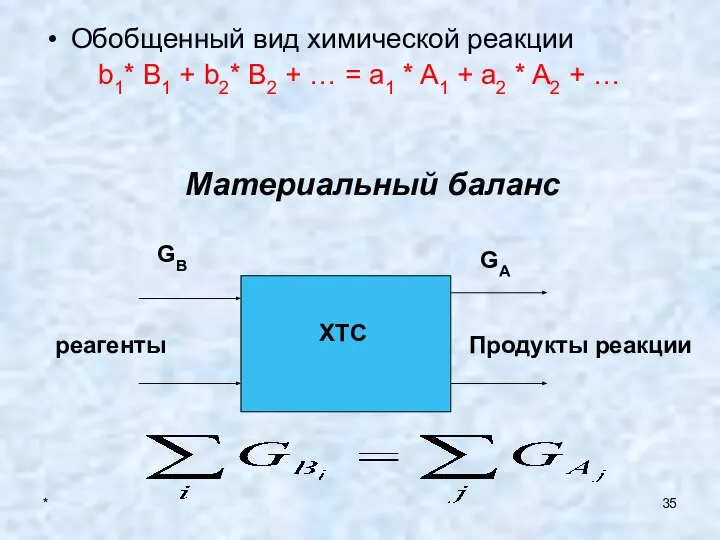
- 35. * Обобщенный вид химической реакции b1* B1 + b2* B2 + … = a1 * A1
- 36. * 3. УСЛОВИЕ ЗАДАЧИ CH4 C + H2 Расход метана = 100 м3 в секунду. Степень
- 37. * Теплофизические данные Атомные массы: водорода = 1, кислород=16, углерод=12.
- 38. * 4. Химическая реакция Определяем молярный объем для продуктов реакции: Vtm = V0m * Tr /
- 39. * 4. Определяем расход метана, подвергаемого пиролизу: Gпирмет = 231.4 * 60 /100 = 138.8 тонн/час:
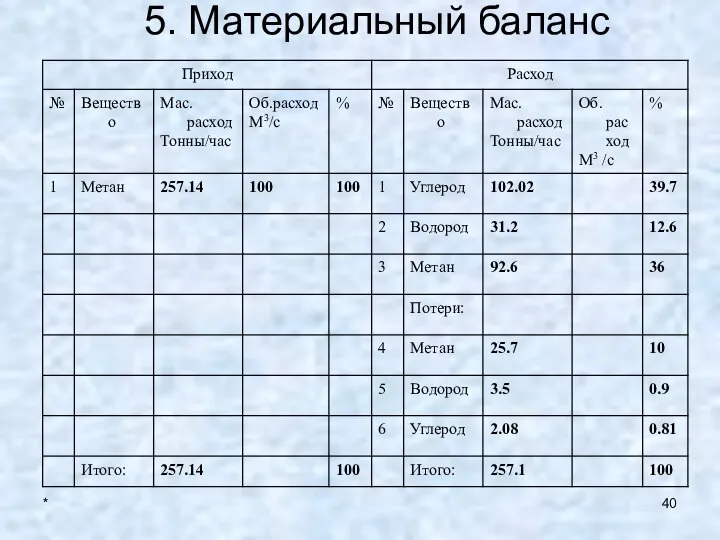
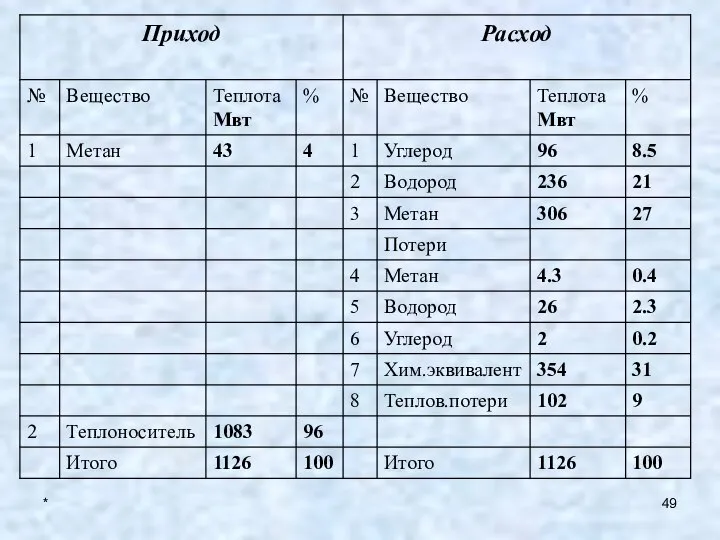
- 40. * 5. Материальный баланс
- 41. * 5. Материальный баланс Определим расходный коэффициент по углероду, Ку: Ку = GM / GKY =
- 42. * 5. Материальный баланс Прореагировало метана 138.8 т/час, тогда из него можно получить углерода согласно следующей
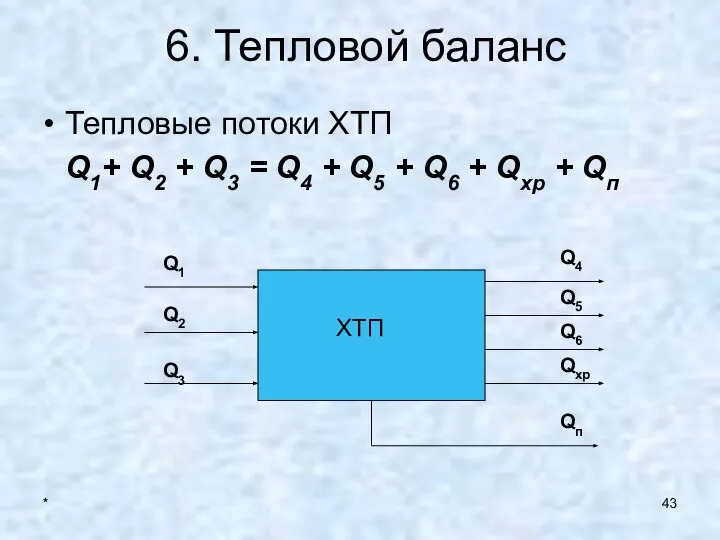
- 43. * 6. Тепловой баланс Тепловые потоки ХТП Q1+ Q2 + Q3 = Q4 + Q5 +
- 44. * Тепловые потоки Q1, Q4– тепловые потоки пропорциональные энтальпии или теплосодержанию и массовому потоку = G*C*T.
- 45. * Тепловой эффект реакции Тепловой эффект реакции при нормальных условиях Изменение теплоемкости в процессе реакции Изменение
- 46. * 12. Определяем нормальный молярный тепловой эффект реакции: 1 * 0 + 2 * 0 -
- 47. * 16. Определяем молярный тепловой эффект при температуре реакции: 75000 + 1400 * 52 = 150
- 48. * 18. Определим энтальпии сырья и продуктов: 257.14 * 2 * 300 / 3.6 = 43
- 49. *
- 50. * Определим массовый расход теплоносителя: Qтн= Gтн*rs Gтн= Qтн/ rs= 1083 Мвт /1000Кдж/кг 1083 кг /
- 52. Скачать презентацию


























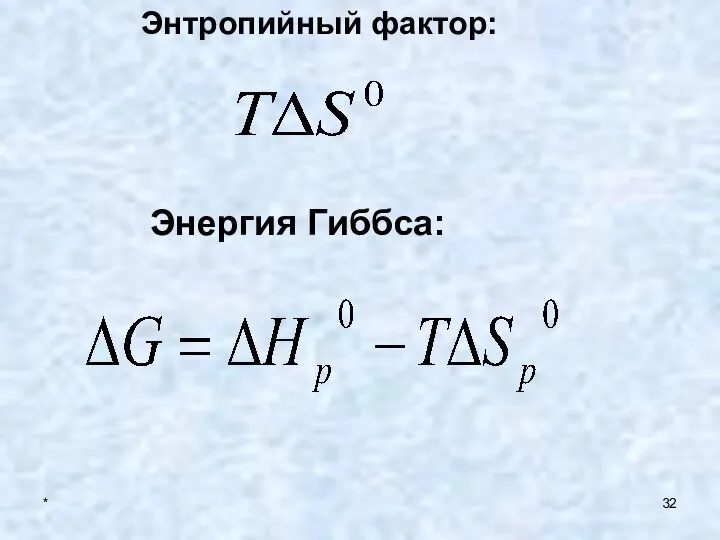














 Прогресс общества. Гендерный аспект
Прогресс общества. Гендерный аспект Презентация на тему "Нравственное воспитание школьников" - скачать презентации по Педагогике
Презентация на тему "Нравственное воспитание школьников" - скачать презентации по Педагогике Олимпиадные задачи. Динамическое программирование
Олимпиадные задачи. Динамическое программирование Модель создания корпоративного имиджа по Б. Джи и ее применение в российских условиях Выполнила: Давыдова Лена, 401 группа Руков
Модель создания корпоративного имиджа по Б. Джи и ее применение в российских условиях Выполнила: Давыдова Лена, 401 группа Руков The 10 most extravagant hats for the Royal Ascot races Royal
The 10 most extravagant hats for the Royal Ascot races Royal Международные экономические организации 1. Международные правительственные (межгосударственные) экономические организации. 2.
Международные экономические организации 1. Международные правительственные (межгосударственные) экономические организации. 2.  Понятие и причины текучести персонала. Понятие абсентеизма, способы снижения абсентеизма на предприятии
Понятие и причины текучести персонала. Понятие абсентеизма, способы снижения абсентеизма на предприятии 1 апреля - день шуток и смеха
1 апреля - день шуток и смеха Саяны
Саяны  Строительство египетских пирамид
Строительство египетских пирамид Имидж современного педагога
Имидж современного педагога Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Продовольственная безопасность России. Горовых А.Е (Т-093)
Продовольственная безопасность России. Горовых А.Е (Т-093)  Halloween. Origins and Traditions
Halloween. Origins and Traditions Недостоверное декларирование: не правильное присвоение кода товара по ЕТН ВЭД ТС Выполнили студентки 3-го курса ФТД группы Т-1209
Недостоверное декларирование: не правильное присвоение кода товара по ЕТН ВЭД ТС Выполнили студентки 3-го курса ФТД группы Т-1209  обмен веществ в эритроцитах
обмен веществ в эритроцитах  Отличие работы одиночной сваи от группы свай ПГС-152 Крупский Глеб
Отличие работы одиночной сваи от группы свай ПГС-152 Крупский Глеб Народ манси
Народ манси Коммерческая тайна. Материал для сотрудников РИЦ. КУП для бюджетных организаций
Коммерческая тайна. Материал для сотрудников РИЦ. КУП для бюджетных организаций Формы поведения
Формы поведения  Экспериментальная и инновационная работа с курсом «Проектная дея
Экспериментальная и инновационная работа с курсом «Проектная дея Презентация1
Презентация1 Чтобы быть хорошим преподавателем, нужно любить то, что преподаешь, и любить тех кому преподаешь. В. Ключевс
Чтобы быть хорошим преподавателем, нужно любить то, что преподаешь, и любить тех кому преподаешь. В. Ключевс Презентация Эмоции
Презентация Эмоции  Технология повышения среднего чека в магазине
Технология повышения среднего чека в магазине События и делегаты
События и делегаты Знать много языков - история моей страны
Знать много языков - история моей страны Раскладные механизмы диванов
Раскладные механизмы диванов