История экспениментального восстановления потенций в ядрах дифференцированных клеток. Клоны животных
Содержание
- 2. Эпигенетические механизмы определяющие и сопровождающие эмбриональную и клеточную дифференцировку метилирование ДНК (цитозин-метилазы и деметилазы, белки- связывающие
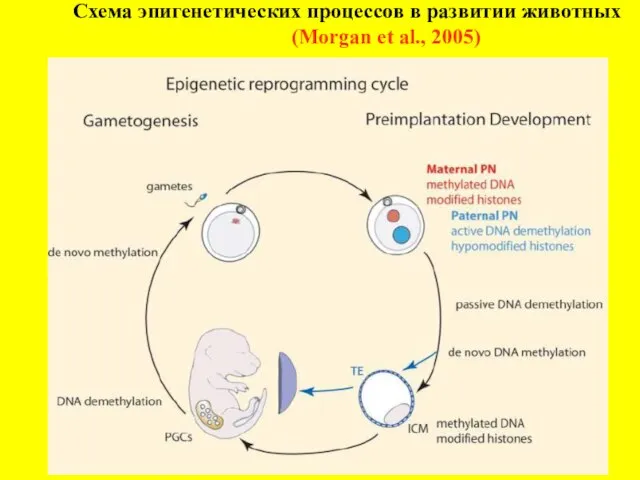
- 3. Схема эпигенетических процессов в развитии животных (Morgan et al., 2005)
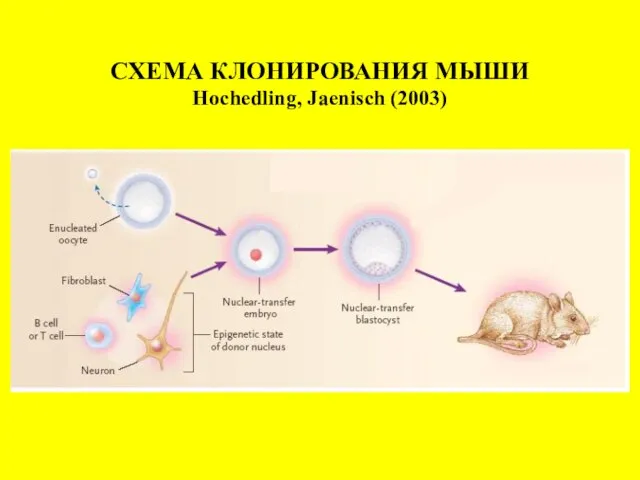
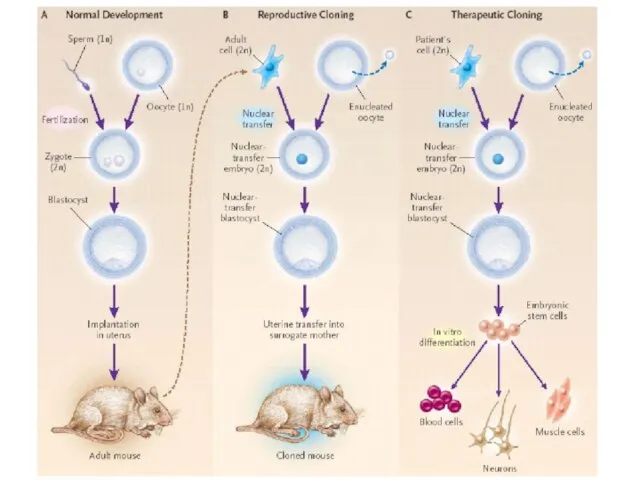
- 4. СХЕМА КЛОНИРОВАНИЯ МЫШИ Hochedling, Jaenisch (2003)
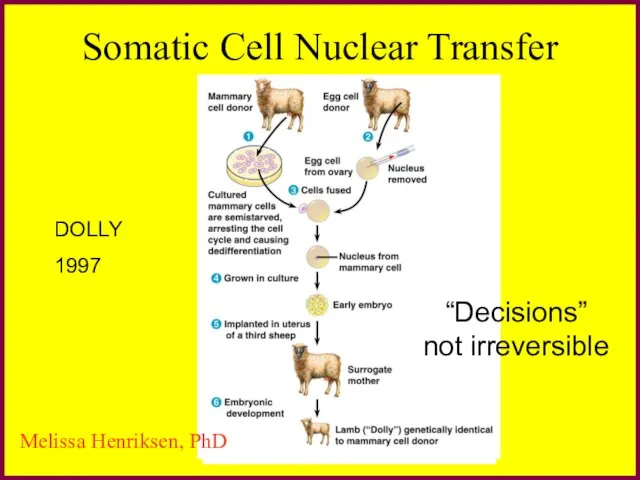
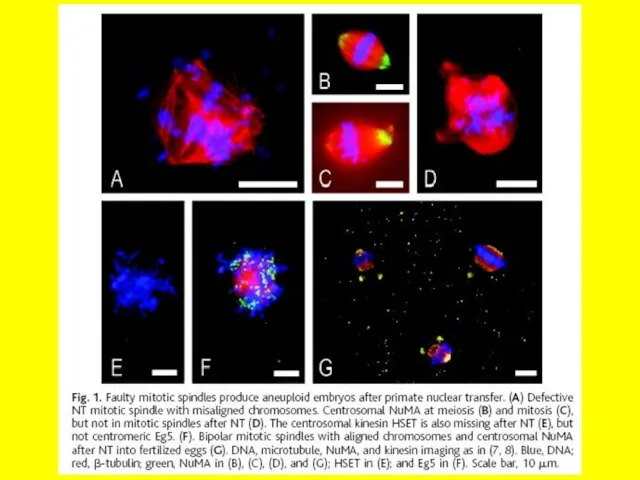
- 5. Somatic Cell Nuclear Transfer DOLLY 1997 “Decisions” not irreversible Melissa Henriksen, PhD
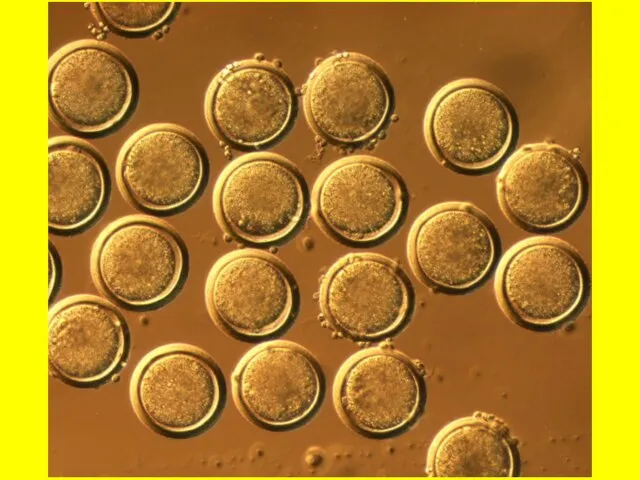
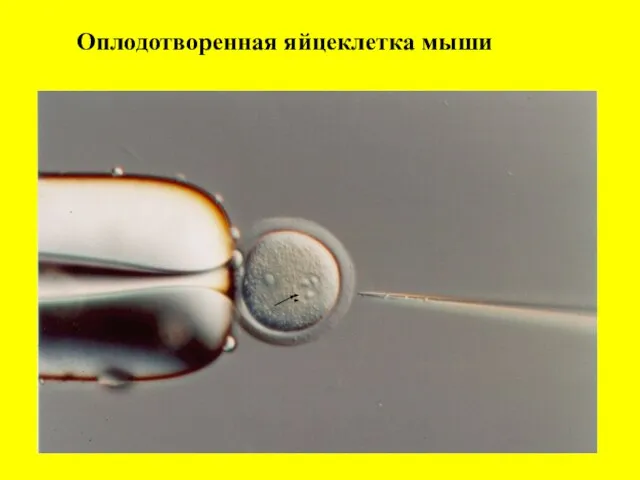
- 7. Оплодотворенная яйцеклетка мыши
- 8. Перечень «клонированных» видов млекопитающих _________________________________________________________________ Вид Клетки Эффективность Ссылки ____________________________________________________________________ Овца эпителий 1/277 (0.4%) Wilmut et
- 9. «Клонированные» животные Melissa Henriksen, PhD
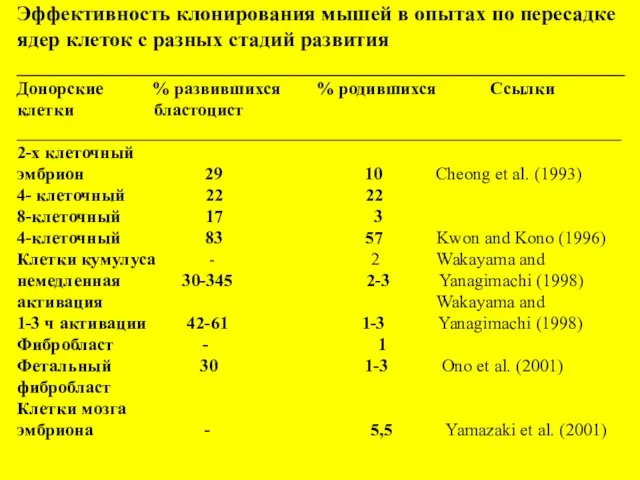
- 10. Эффективность клонирования мышей в опытах по пересадке ядер клеток с разных стадий развития _________________________________________________________ Донорские %
- 11. Nuclear transfer has become almost synonymous with ‘cloning’, although the aims of the two processes differ;
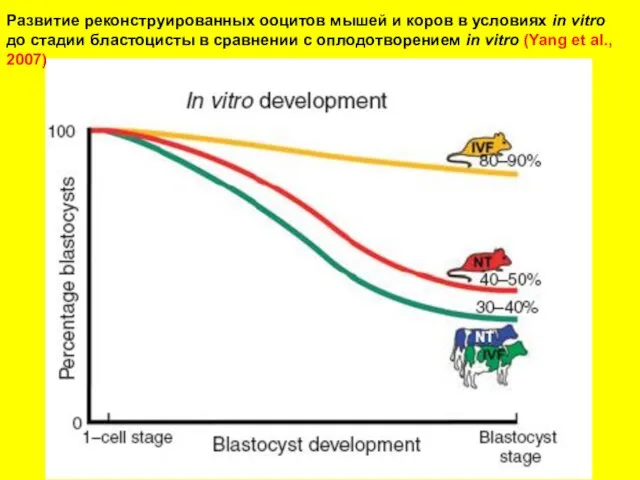
- 12. Развитие реконструированных ооцитов мышей и коров в условиях in vitro до стадии бластоцисты в сравнении с
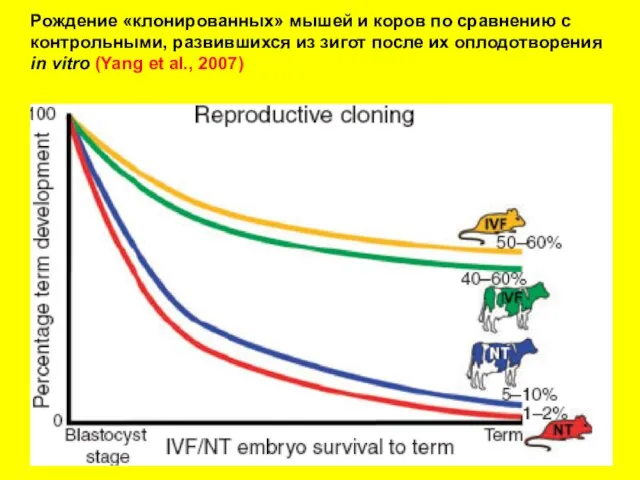
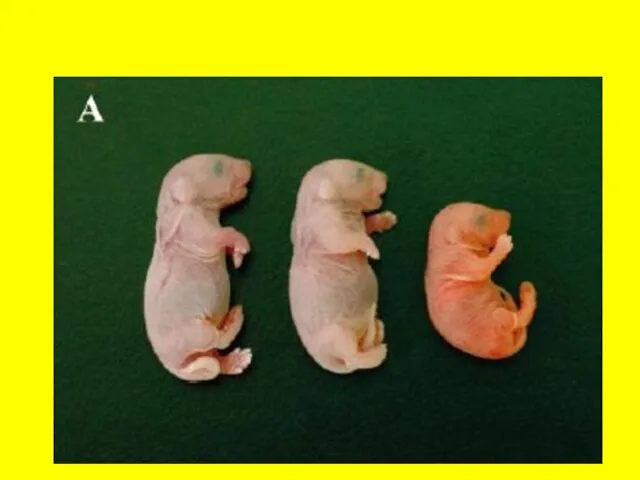
- 13. Рождение «клонированных» мышей и коров по сравнению с контрольными, развившихся из зигот после их оплодотворения in
- 16. Taeyoung Shin et al. A cat cloned by nuclear transplantation. Nature 2002, v.415, 723
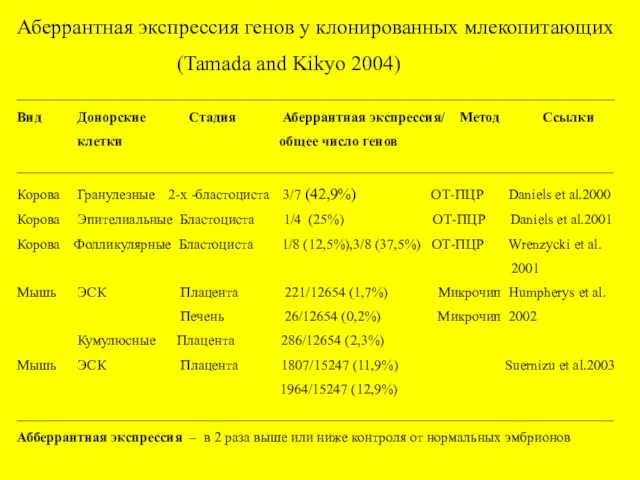
- 17. Аберрантная экспрессия генов у клонированных млекопитающих (Tamada and Kikyo 2004) ________________________________________________________ Вид Донорские Стадия Аберрантная экспрессия/
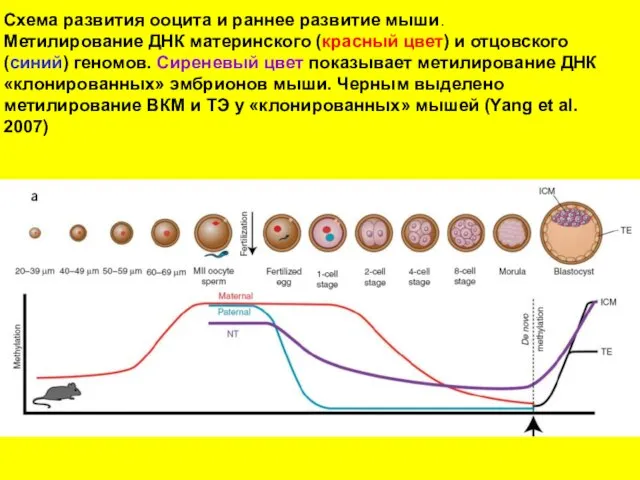
- 18. Схема развития ооцита и раннее развитие мыши. Метилирование ДНК материнского (красный цвет) и отцовского (синий) геномов.
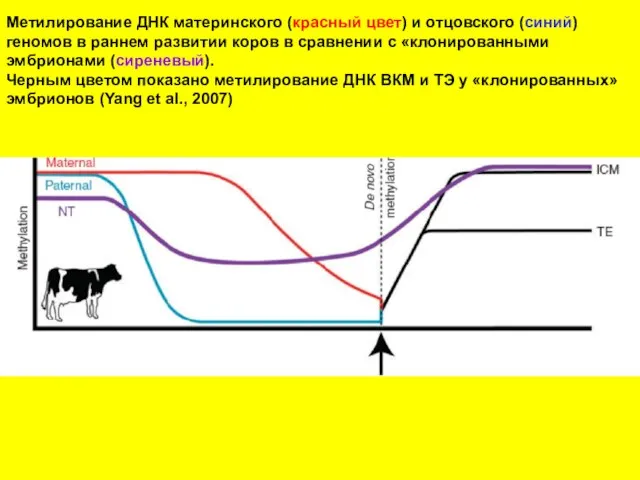
- 19. Метилирование ДНК материнского (красный цвет) и отцовского (синий) геномов в раннем развитии коров в сравнении с
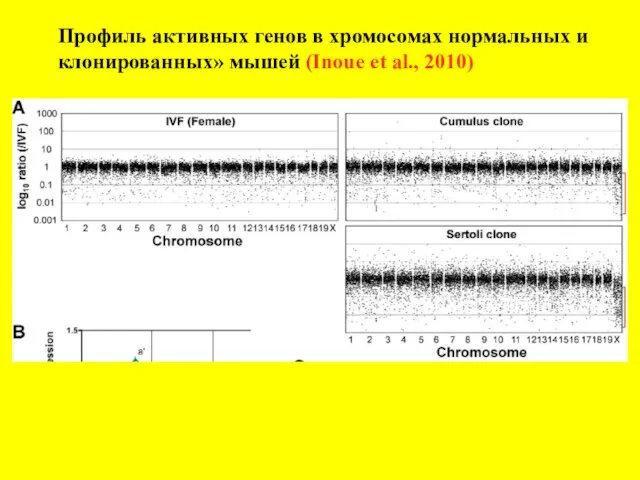
- 20. Профиль активных генов в хромосомах нормальных и клонированных» мышей (Inoue et al., 2010)
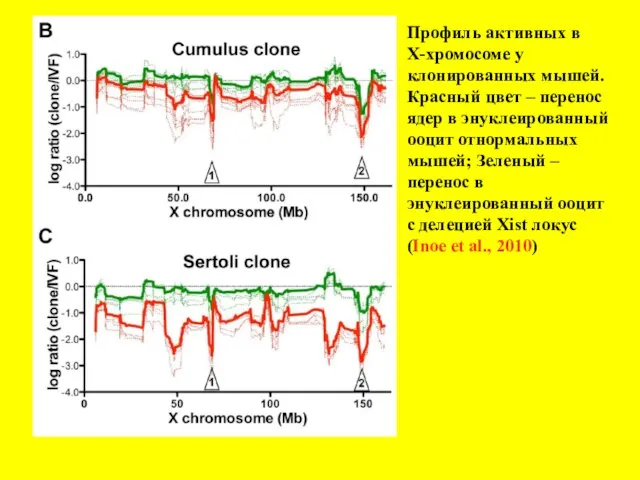
- 21. Профиль активных в Х-хромосоме у клонированных мышей. Красный цвет – перенос ядер в энуклеированный ооцит отнормальных
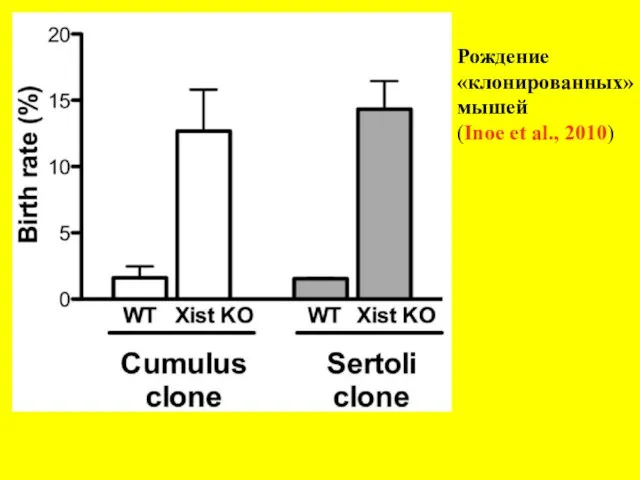
- 22. Рождение «клонированных» мышей (Inoe et al., 2010)
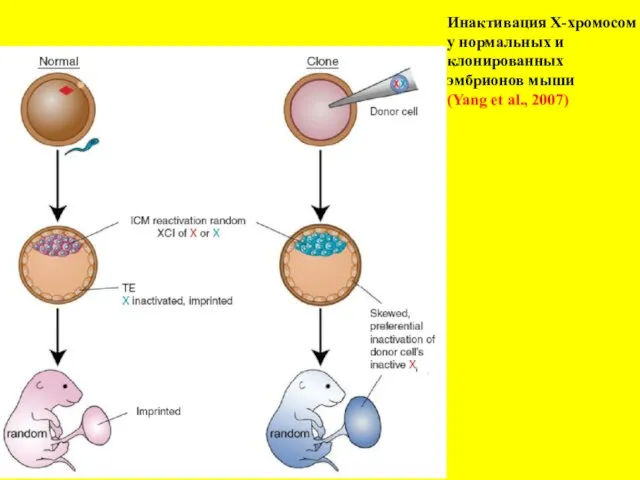
- 23. Инактивация Х-хромосом у нормальных и клонированных эмбрионов мыши (Yang et al., 2007)
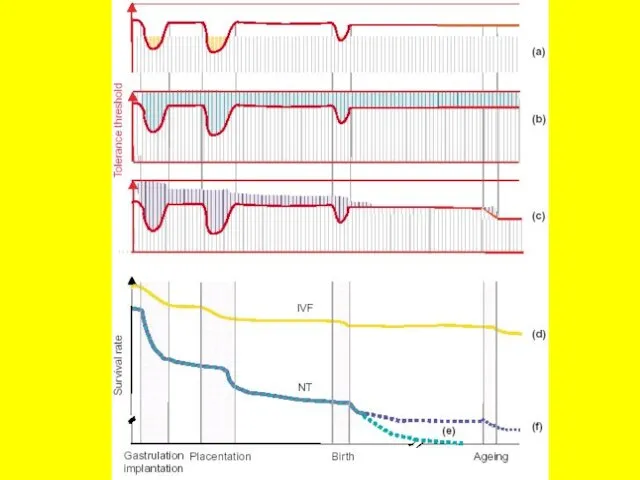
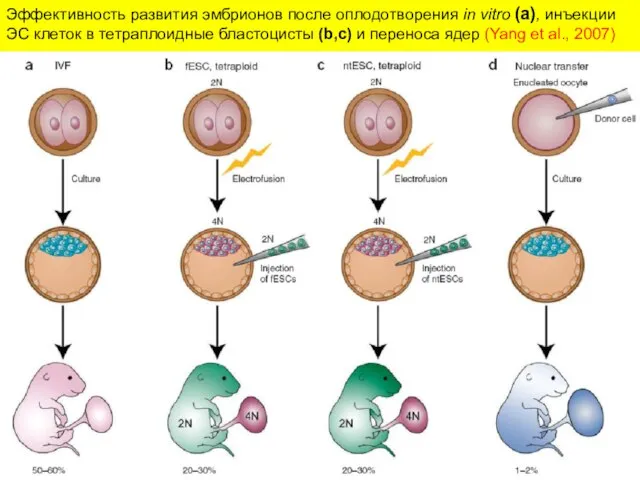
- 24. Эффективность развития эмбрионов после оплодотворения in vitro (a), инъекции ЭС клеток в тетраплоидные бластоцисты (b,c) и
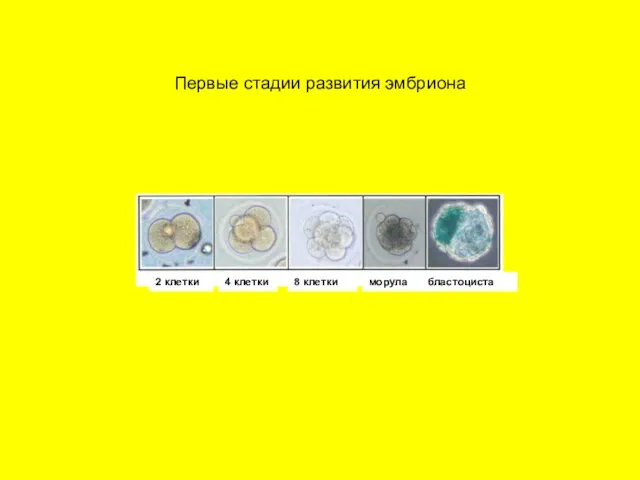
- 25. Первые стадии развития эмбриона 2 клетки 2 клетки 4 клетки 8 клетки морула бластоциста
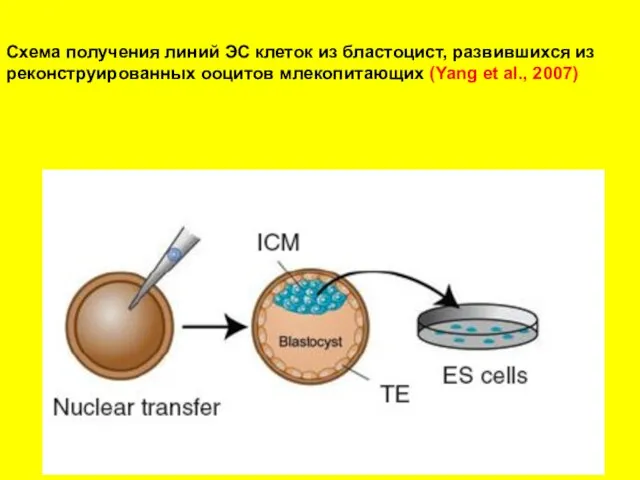
- 26. Схема получения линий ЭС клеток из бластоцист, развившихся из реконструированных ооцитов млекопитающих (Yang et al., 2007)
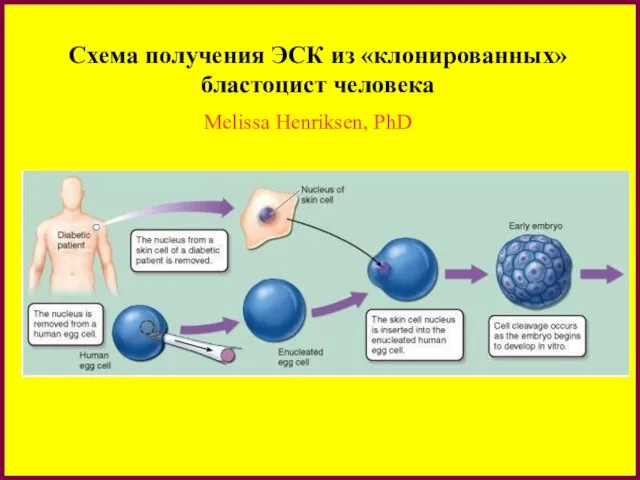
- 27. Схема получения ЭСК из «клонированных» бластоцист человека Melissa Henriksen, PhD
- 33. Скачать презентацию







 Выращивание и уход за цветочным растением Вербена
Выращивание и уход за цветочным растением Вербена Цитоплазма. Строение мембран (лекция 4)
Цитоплазма. Строение мембран (лекция 4) Вплив наркотичних речовин на організм людини
Вплив наркотичних речовин на організм людини  Влияние производных бензохинона на радиационно-индуцированную фрагментацию биомолекул и моделирующих их соединений
Влияние производных бензохинона на радиационно-индуцированную фрагментацию биомолекул и моделирующих их соединений Тип Круглые черви
Тип Круглые черви рост и развитие пшеницы и ржи Работу выполнила студентка 3 курса 4группы Войтешук О. В.
рост и развитие пшеницы и ржи Работу выполнила студентка 3 курса 4группы Войтешук О. В.  Лето. Загадки про явления в природе летом
Лето. Загадки про явления в природе летом Выдающиеся биологи России Работа ученика 11класса Досова Ярослава
Выдающиеся биологи России Работа ученика 11класса Досова Ярослава Зрение
Зрение Изменения в жизни насекомых и других животных весной (человек и мир, 1 класс)
Изменения в жизни насекомых и других животных весной (человек и мир, 1 класс) Картофель. Общие сведения о культуре картофеля
Картофель. Общие сведения о культуре картофеля Метод полимеразной цепной реакции (ПЦР)
Метод полимеразной цепной реакции (ПЦР) Происхождение и эволюция человека
Происхождение и эволюция человека Нейрофизиология. Общая нейрофизиология сенсорных систем. (Лекция 5)
Нейрофизиология. Общая нейрофизиология сенсорных систем. (Лекция 5) ДНҚ. Хромосомдар – жасуша ядросында ақпарат тасушылар, олар ДНҚ молекулаларынан тұрады
ДНҚ. Хромосомдар – жасуша ядросында ақпарат тасушылар, олар ДНҚ молекулаларынан тұрады Генетические заболевания
Генетические заболевания Механизмы нейропротекторного действия уабаина при эксайтотоксическом стрессе в нейронах коры крыс
Механизмы нейропротекторного действия уабаина при эксайтотоксическом стрессе в нейронах коры крыс Весенние цветы легенды и истории (для детей старшего дошкольного возраста)
Весенние цветы легенды и истории (для детей старшего дошкольного возраста) Проект на тему: аквариум и его обитатели
Проект на тему: аквариум и его обитатели ПАСЛЕНОВЫЕ Семейство паслёновых
ПАСЛЕНОВЫЕ Семейство паслёновых  Подготовила:Халикова Г.Г.
Подготовила:Халикова Г.Г.  Электрический ток
Электрический ток Размножение земноводных
Размножение земноводных МЕТАБОЛИЗМ БАКТЕРИЙ
МЕТАБОЛИЗМ БАКТЕРИЙ  Схема вегетативной рефлекторной дуги
Схема вегетативной рефлекторной дуги Методы исследования
Методы исследования Особенности строения и жизнедеятельности рыб
Особенности строения и жизнедеятельности рыб Презентация на тему "Красная книга растений (5 класс)" - скачать бесплатно презентации по Биологии
Презентация на тему "Красная книга растений (5 класс)" - скачать бесплатно презентации по Биологии