Содержание
- 2. ЭНЕРГИЯ, НЕОБХОДИМАЯ ДЛЯ ГОМОЛИТИЧЕСКОГО РАЗРЫВА СВЯЗИ НАЗЫВАЕТСЯ ЭНЕРГИЕЙ ДИССОЦИАЦИИ (ОНА ОТЛИЧНА ОТ ЭНЕРГИИ СВЯЗИ) Например: Эн
- 3. ТЕРМИЧЕСКАЯ СТАБИЛЬНОСТЬ УГЛЕВОДОРОДОВ Определяется энергией Гиббса образования углеводородов из простых веществ (кДж/моль) Зависимость от температуры: Коэффициенты
- 4. Например: Зная уравнение зависимости энергии Гиббса реакции крекинга какого-либо углеводорода от температуры можно найти Т при
- 5. Химизм и механизм термических превращений углеводородов и других компонентов нефти и газа ОСНОВНЫЕ ПРОЦЕССЫ ТЕРМИЧЕСКОЙ ПЕРЕРАБОТКИ
- 6. Легкий крекинг гудрона (висбрекинг) Т 450-480оС Р 0.2 МПа малое время контакта – получение Небольшого кол-ва
- 7. К о к с о в а н и е Процессы коксования нефтяных остатков Получение Электродного
- 8. П И Р О Л И З Сырье: бензин прямой перегонки Керосино-газойлевые фракции, Природные и попутные
- 9. ТЕРМИЧЕСКИЕ ПРЕВРАЩЕНИЯ УГЛЕВОДОРОДОВ Алканы Расщепляются по связям С-С и С-Н При крекинге ( расщепление С-С) из
- 10. При С-Н распаде идет реакция дегидрирования Для низших алканов дегидрирование доминирует Для высших алканов преобладает реакция
- 11. Начиная с пентана расщепление по С-С становится преобладающим Относительная скорость крекинга: Число ат С V 5
- 12. Термический крекинг большинства УВ протекает по радикально-цепному механизму (Райс) А) зарождение цепи Б) продолжение цепи В)обрыв
- 13. Изомеризация радикалов Первичные изомеризуются в более стабильные вторичные. Внутримолекулярная миграция ат Н Реакции радикалов с молекулами
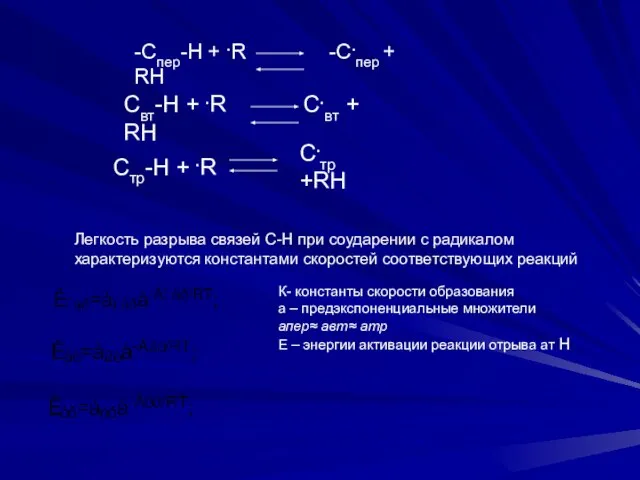
- 14. -Cпер-Н + .R -C.пер + RH Cвт-Н + .R C.вт + RH Cтр-H + .R C.тр
- 15. Энергии активации можно вычислить по ур-ю Семенова-Поляни для экзотермических еакций Е=11,5-0,25Q Q - тепловой эффект реакции
- 16. Расчитанные по формуле Семенова-Поляни значения энергий активации: Находим отношения констант скоростей реакции, которые равны отношению скоростей
- 17. Зная относительные скорости отрыва различных атомов водорода можно рассчитать относительные вероятности их отрыва и, следовательно относительные
- 18. В) Обрыв цепи Происходит при столкновении радикалов, когда их концентрация в системе становится значительной. Рекомбинация либо
- 19. Зарождение цепи: Столкновение свободных радикалов с молекулами бутана – развитие цепи
- 20. Первичный бутил распадается с образованием этилена и этана Вторичный бутил распадается с образованием пропилена и метана
- 21. Соотношение между продуктами распада бутила и втор-бутила определяется соотношением вероятностей их образования Из 14 мол бутана
- 22. Радикальный механизм термического расщепления углеводородов Распад радикалов по бета-связи) объясняет преобладание этилена в газообразных продуктах пиролиза
- 23. Термические превращения алкенов
- 25. Скачать презентацию





















 Нагревание проводников электрическим током. Закон Джоуля-Ленца
Нагревание проводников электрическим током. Закон Джоуля-Ленца The mechanics in biomechanics
The mechanics in biomechanics Общие свойства ионизирующих излучений ядерного взрыва
Общие свойства ионизирующих излучений ядерного взрыва Кулачковая опора для шагающего механизма П.Л. Чебышева
Кулачковая опора для шагающего механизма П.Л. Чебышева Построение и применение комплексов радиорелейной, тропосферной, спутниковой связи
Построение и применение комплексов радиорелейной, тропосферной, спутниковой связи Теория относительности. (Лекция 5)
Теория относительности. (Лекция 5) Закон Био-Савара-Лапласа и его применения
Закон Био-Савара-Лапласа и его применения Радиоактивтілік. Сәуле шығару. Элементар бөлшектерді тіркеу мен бақылау әдістері
Радиоактивтілік. Сәуле шығару. Элементар бөлшектерді тіркеу мен бақылау әдістері Аттестационная работа. Образовательная рабочая программа Подготовка к ОГЭ по физике. (10 класс)
Аттестационная работа. Образовательная рабочая программа Подготовка к ОГЭ по физике. (10 класс) Кристаллические и аморфные тела в современном мире Выполнила: Попова Людмила Леонасовна, учитель физики МБОУ «СОШ № 14» имени А.М.
Кристаллические и аморфные тела в современном мире Выполнила: Попова Людмила Леонасовна, учитель физики МБОУ «СОШ № 14» имени А.М. Технология компрессии изображений «Smart Compression of Images»
Технология компрессии изображений «Smart Compression of Images» Применение материалов в кабельных изделиях
Применение материалов в кабельных изделиях Відкриття електромагнітних хвиль Презентація 11-А класу швеця максима і пивоварчука вадима
Відкриття електромагнітних хвиль Презентація 11-А класу швеця максима і пивоварчука вадима  Плоское потенциальное движение. Использование вихревой теории в расчетах турбомашин
Плоское потенциальное движение. Использование вихревой теории в расчетах турбомашин Нахождение удельной теплоты льда в опытах по плавлению льда водой
Нахождение удельной теплоты льда в опытах по плавлению льда водой Сила трения. Виды трения. Способы изменения трения
Сила трения. Виды трения. Способы изменения трения Гидростатика. Гидростатическое давление и его свойства
Гидростатика. Гидростатическое давление и его свойства Влияние радиации на человека Презентация ученицы 11 класса «Б» ГОУ ЦО №548 «Царицыно» Корсаковой Маргариты
Влияние радиации на человека Презентация ученицы 11 класса «Б» ГОУ ЦО №548 «Царицыно» Корсаковой Маргариты  Постулаты общей теории относительности. (Часть 3)
Постулаты общей теории относительности. (Часть 3) Подсчет запасов и анализ неопределенности
Подсчет запасов и анализ неопределенности Космическая динамика. Законы Кеплера
Космическая динамика. Законы Кеплера Использование энергии Солнца на Земле Презентация Свиридова Тимофея 8-В класс
Использование энергии Солнца на Земле Презентация Свиридова Тимофея 8-В класс  Плавание тел
Плавание тел Тест по теме: линии магнитного полня, однородное, неоднородное поле, правило правой руки
Тест по теме: линии магнитного полня, однородное, неоднородное поле, правило правой руки Современные проблемы физики наноструктурных материалов. Механические свойства и механизмы деформации наноматериалов
Современные проблемы физики наноструктурных материалов. Механические свойства и механизмы деформации наноматериалов Специальная теория относительности. (Часть 2)
Специальная теория относительности. (Часть 2) Кулон заңы
Кулон заңы Электронная подсистема. Вырожденный электронный газ (лекция 16)
Электронная подсистема. Вырожденный электронный газ (лекция 16)