Основные положения молекулярно-кинетической теории. Взаимодействие молекул и агрегатные состояние. Законы термодинамики
Содержание
- 2. Молекулярно-кинетическая теория. Большинство природных явлений так или иначе связаны с передачей тепла между разными телами или
- 3. Основные положения молекулярно-кинетической теории (МКТ). 1. Вещество состоит из мелких частиц: молекул или атомов; да, именно
- 4. Основные уравнения молекулярно-кинетической теории. Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа
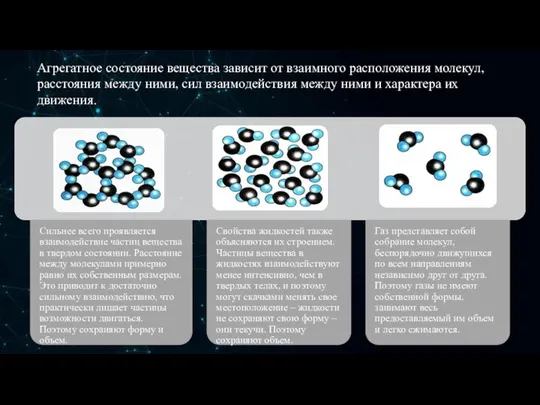
- 5. Три агрегатных состояния. Вещества могут находиться в трёх агрегатных состояниях: в твёрдом, жидком и газообразном. Свойства
- 6. Агрегатное состояние вещества зависит от взаимного расположения молекул, расстояния между ними, сил взаимодействия между ними и
- 7. Уравнение идеального газа. Основным уравнением, описывающим поведение идеального газа, является уравнение Менделеева-Клапейрона (уравнение состояния идеального газа)
- 8. Законы термодинамики. Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы -
- 9. Работа газа. . Работа газа - это результат взаимодействия системы с внешними объектами (например, поршнями), в
- 10. Второй закон термодинамики - тепло более горячей системы переходит только в сторону более холодной. Это необратимый
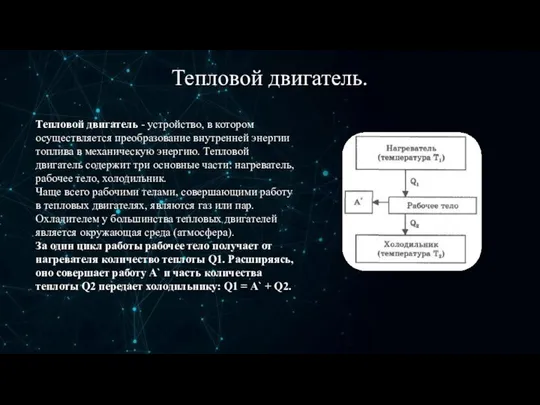
- 11. Тепловой двигатель. Тепловой двигатель - устройство, в котором осуществляется преобразование внутренней энергии топлива в механическую энергию.
- 13. Скачать презентацию








 Силовая установка для электрического самолёта
Силовая установка для электрического самолёта Конструкции высоковольтных электрических аппаратов. Разъединители. (Лекция 8)
Конструкции высоковольтных электрических аппаратов. Разъединители. (Лекция 8) Дифракція світла. Принцип Гюйгенса-Френеля. Дифракційні картини
Дифракція світла. Принцип Гюйгенса-Френеля. Дифракційні картини Презентация "Излучение"
Презентация "Излучение" Построение схемы посадки Ф45 H7/js6
Построение схемы посадки Ф45 H7/js6 Радиоволны. Диапазон
Радиоволны. Диапазон Давление. Единицы давления
Давление. Единицы давления Закон сохранения импульса
Закон сохранения импульса  Кристаллические тела
Кристаллические тела Реактивное движение. Ракеты
Реактивное движение. Ракеты Дифракция в сходящихся лучах (дифракция Френеля)
Дифракция в сходящихся лучах (дифракция Френеля) Измерение расхода и количества вещества
Измерение расхода и количества вещества Закон радиоактивного распада. Единицы радиоактивности
Закон радиоактивного распада. Единицы радиоактивности Графики плавления и отвердевания кристаллических тел
Графики плавления и отвердевания кристаллических тел Исследование скважин. Метод высокочастотного индукционноого каротажного изопараметрического зондирования
Исследование скважин. Метод высокочастотного индукционноого каротажного изопараметрического зондирования Полигармонические колебания
Полигармонические колебания Дорожный водоотвод. Система сооружений поверхностного и подземного водоотвода
Дорожный водоотвод. Система сооружений поверхностного и подземного водоотвода Термодинамика как наука. Основные понятия термодинамики
Термодинамика как наука. Основные понятия термодинамики Энергия. Кинетическая энергия
Энергия. Кинетическая энергия Расчет констант равновесия статистическим методом. Лекция 23
Расчет констант равновесия статистическим методом. Лекция 23 Формулы на движение
Формулы на движение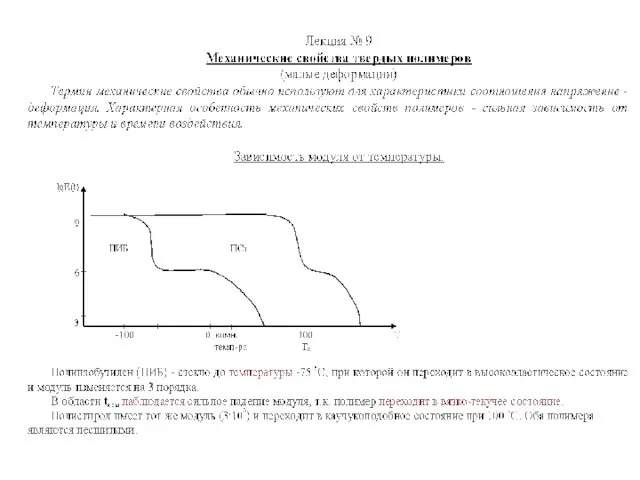 Механические свойства твердых полимеров, малые деформации. (Лекция 9)
Механические свойства твердых полимеров, малые деформации. (Лекция 9) Физика туралы ғылым
Физика туралы ғылым Живой свет свечи
Живой свет свечи Фізіка з асновамі геафізікі
Фізіка з асновамі геафізікі Метод эквивалентного генератора
Метод эквивалентного генератора Магнит өрісінің тогы бар өткізгішке әрекеті. Электрқозғалтқыштар. Электр өлшеуіш аспаптар
Магнит өрісінің тогы бар өткізгішке әрекеті. Электрқозғалтқыштар. Электр өлшеуіш аспаптар Электрическое сопротивление человека Авторы: Исаева Мария, ученица 7 класса, Руководитель: Семке Андрей Иванович, учитель физи
Электрическое сопротивление человека Авторы: Исаева Мария, ученица 7 класса, Руководитель: Семке Андрей Иванович, учитель физи