Содержание
- 2. Самостоятельная работа: Сообщение на тему «Использование низких температур» Сроки 1713 – с 16.01.2017 по 20.01.2017 1714
- 3. 5. Теплоемкость. Удельная теплоемкость. Уравнение теплового баланса. ОСНОВЫ ТЕРМОДИНАМИКИ СОДЕРЖАНИЕ 1. Основные понятия и определения. 2.
- 4. Себе стихию покорил – огонь он трением добыл 19.01.2017
- 5. 1. Основные понятия и определения Термодинамическая система – совокупность тел, способных энергетически взаимодействовать между с собой
- 6. Термодинамическим процессом называется переход системы из начального состояния в конечное, через последовательность промежуточных состояний. Процессы бывают
- 7. Любой процесс, сопровождаемый трением или теплопередачей от нагретого тела к холодному, является необратимым. Примером необратимого процесса
- 8. 2. Внутренняя энергия системы Термодинамическая система как совокупность множества атомов и молекул обладает внутренней энергией. Её
- 9. 3. Внутренняя энергия идеального газа Так как в идеальном газе можно пренебречь силами молекулярного взаимодействия, то
- 10. Для газа, молекулы которого состоят из трёх и более атомов: Тогда внутренняя энергия для одного моля
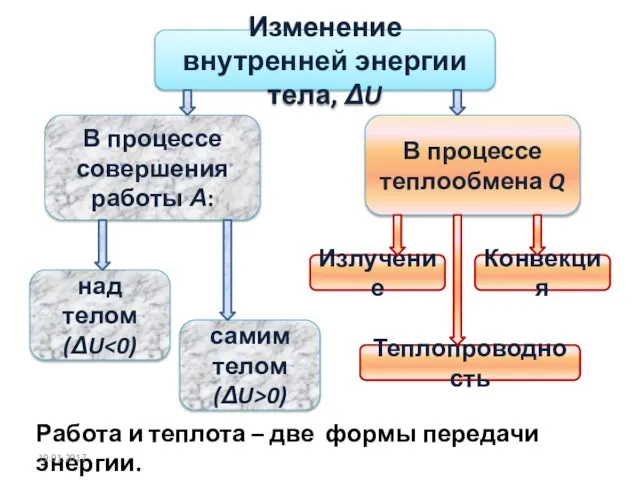
- 11. Для практики важно знать не саму внутреннюю энергию, а её изменение ΔU. Изменение внутренней энергии ΔU
- 12. Изменение внутренней энергии тела, ΔU В процессе совершения работы А: В процессе теплообмена Q Излучение Конвекция
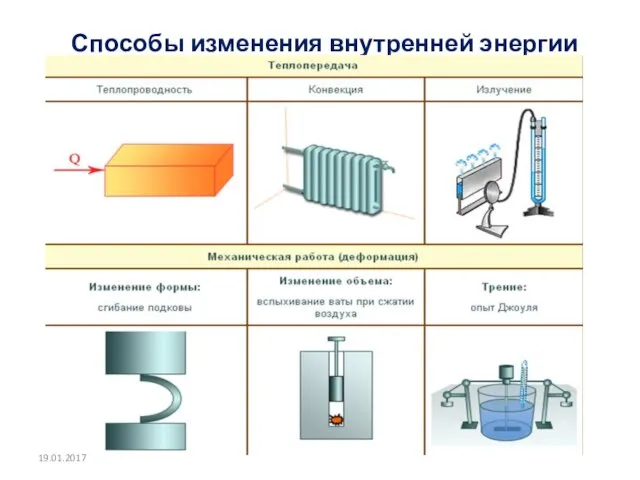
- 13. Способы изменения внутренней энергии тела 19.01.2017
- 14. 4. Первое начало термодинамики В изолированной термодинамической системе внутренняя энергия не изменяется при любых взаимодействиях внутри
- 15. Если считать работу А, совершаемую телом над окружающими телами, за положительную, а над телом со стороны
- 16. Отсюда следует, что любая машина может совершать работу А над внешними телами только за счёт уменьшения
- 17. ΔU=Q+A' 1 закон термодинамики имеет и другую формулировку и математическую запись : Приращение внутренней энергии тела
- 18. 5. Теплоёмкость. Удельная теплоёмкость. Уравнение теплового баланса. Теплоёмкостью тела называют отношение количества теплоты Q , необходимого
- 19. Величина, равная отношению теплоёмкости тела к его массе, называется удельной теплоёмкостью: Отсюда: Если в теплообмене участвуют
- 21. Скачать презентацию
















 Вес тела. Связь между массой тела и силой тяжести
Вес тела. Связь между массой тела и силой тяжести Mechanika płynów
Mechanika płynów Колебательный контур. Свободные и вынужденные электромагнитные колебания
Колебательный контур. Свободные и вынужденные электромагнитные колебания Die Entdeckung von Heinrich Hertz
Die Entdeckung von Heinrich Hertz Вплив домішок на товщину збідненої області p-n переходу
Вплив домішок на товщину збідненої області p-n переходу Второй закон термодинамики. Энтропия. (Лекция 3)
Второй закон термодинамики. Энтропия. (Лекция 3) Выбор агента расклинивания при ГРП
Выбор агента расклинивания при ГРП Движение тела по наклонной плоскости
Движение тела по наклонной плоскости Источники электроэнергии
Источники электроэнергии Наносистемы и физические основы нанотехнологии
Наносистемы и физические основы нанотехнологии Эксперименты по физике
Эксперименты по физике Газовые законы
Газовые законы Количество вещества, молярная масса
Количество вещества, молярная масса Аттестационная работа. Проектная деятельность на уроках физики
Аттестационная работа. Проектная деятельность на уроках физики Механическая работа. Единицы работы. 7 класс
Механическая работа. Единицы работы. 7 класс Шум. Образование дискретного шума
Шум. Образование дискретного шума Электростатика. Электрические заряды
Электростатика. Электрические заряды Последовательное и параллельное соединение проводников
Последовательное и параллельное соединение проводников Термический анализ. Лекция №3
Термический анализ. Лекция №3 Презентация Строение и свойства вещества Цель урока: выяснить как влияет строение веществ на их свойства.
Презентация Строение и свойства вещества Цель урока: выяснить как влияет строение веществ на их свойства. Теплотехника Техническая термодинамика и теплопередача
Теплотехника Техническая термодинамика и теплопередача Проектирование троллейбусной сети в зоне высоковольтной линии электропередач
Проектирование троллейбусной сети в зоне высоковольтной линии электропередач Aerodynamics I
Aerodynamics I Теплопроводность. Нестационарная теплопроводность. (Тема 4. Лекции 16,17)
Теплопроводность. Нестационарная теплопроводность. (Тема 4. Лекции 16,17) Академия Транспортных Технологий
Академия Транспортных Технологий Датчики давления
Датчики давления Электромагнитное поле
Электромагнитное поле Тепловые явления, внутренняя энергия
Тепловые явления, внутренняя энергия