Содержание
- 2. A вн = -A г Вторая формулировка закона: Количество теплоты, подведенное к системе, идет на изменение
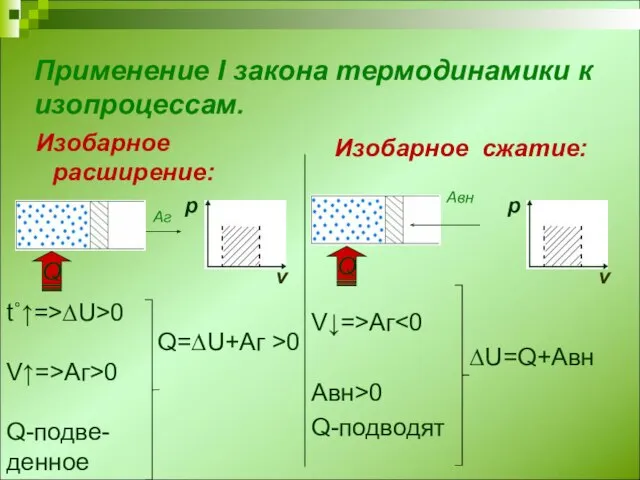
- 3. Применение I закона термодинамики к изопроцессам. Изобарное расширение: Изобарное сжатие: V↓=>Аг ∆U=Q+Авн Авн>0 Q-подводят t˚↑=>∆U>0 Q=∆U+Аг
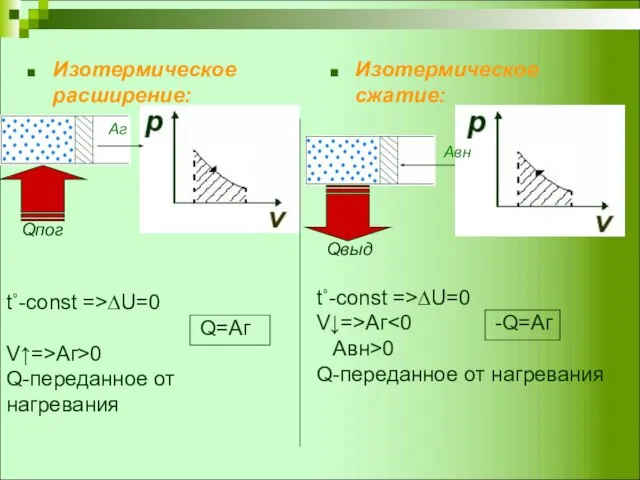
- 4. Изотермическое расширение: Изотермическое сжатие: t˚-const =>∆U=0 Q=Аг V↑=>Аг>0 Q-переданное от нагревания t˚-const =>∆U=0 V↓=>Аг Aвн>0 Q-переданное
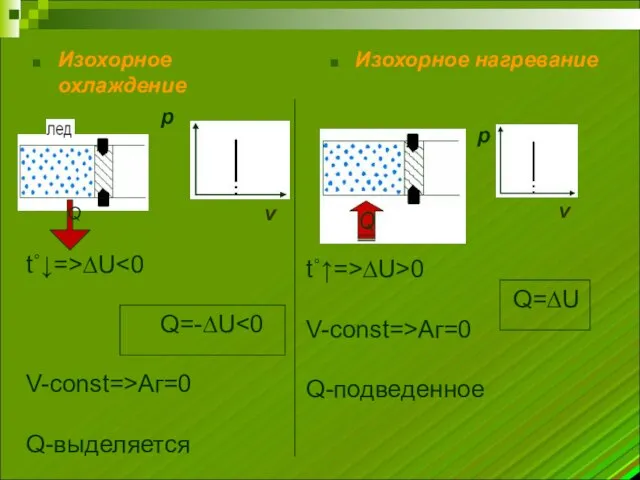
- 5. Изохорное охлаждение Изохорное нагревание t˚↓=>∆U Q=-∆U V-const=>Аг=0 Q-выделяется t˚↑=>∆U>0 Q=∆U V-const=>Аг=0 Q-подведенное Q
- 6. Адиабатный процесс– это модель термодинамического процесса, происходящего в системе без теплообмена с окружающей средой. В адиабатическом
- 7. Применение I закона термодинамики. Изотермический процесс ( Т – const, ∆T=O) ∆U = 0, Q =
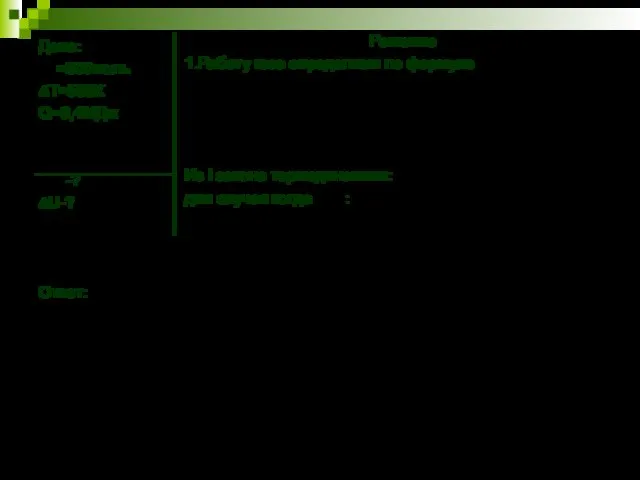
- 8. Пример решения задач: Для изобарного нагревания газа в количестве 800 моль на 500 К ему сообщили
- 9. Дано: =800моль ∆Т=500К Q=9,4МДж -? ∆U-? Ответ: Решение 1.Работу газа определяем по формуле Из I закона
- 11. Скачать презентацию




 Статическое электричество
Статическое электричество Петр Леонидович Капица
Петр Леонидович Капица Увеличительные приборы
Увеличительные приборы Механические колебания. (9 класс)
Механические колебания. (9 класс) Технологический колледж сервиса Государственное образовательное учреждение высшего профессионального образования Южно-Уральс
Технологический колледж сервиса Государственное образовательное учреждение высшего профессионального образования Южно-Уральс Домашнее задание по физике
Домашнее задание по физике Водяное охлаждение. Сфера применения
Водяное охлаждение. Сфера применения Материалы и технологии изготовления нано- и микро-электромеханических систем НЭМС/МЭМС
Материалы и технологии изготовления нано- и микро-электромеханических систем НЭМС/МЭМС Витая пара
Витая пара От порядка к хаосу. Сценарии перехода к хаосу
От порядка к хаосу. Сценарии перехода к хаосу Аккумуляторная батарея 42нк-125
Аккумуляторная батарея 42нк-125 Электромагнитная совместимость в электроэнергетике
Электромагнитная совместимость в электроэнергетике ФИЗИКА, 8,10 класс ГАПОНЕНКО ЖАННА АЛЕКСАНДРОВНА, учитель физики МБУОШИ «Ляминская средняя общеобразовательная школа - интернат»
ФИЗИКА, 8,10 класс ГАПОНЕНКО ЖАННА АЛЕКСАНДРОВНА, учитель физики МБУОШИ «Ляминская средняя общеобразовательная школа - интернат» Фотоэлементы
Фотоэлементы Что изучает физика
Что изучает физика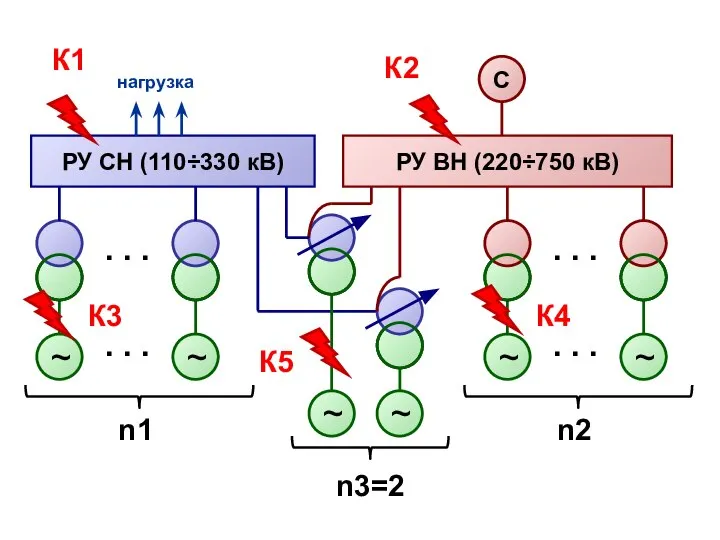 Расчёт ТКЗ схемы замещения
Расчёт ТКЗ схемы замещения Automaty a regularní výrazy. (Lekce 3)
Automaty a regularní výrazy. (Lekce 3) Устройство системы смазки автомобиля К 740. 11
Устройство системы смазки автомобиля К 740. 11 Термоядерные реакции
Термоядерные реакции Динамика вращательного движения. Момент силы
Динамика вращательного движения. Момент силы Контактные явления
Контактные явления Энергия. Кинетическая и потенциальная энергия. Вывод закона сохранения механической энергии
Энергия. Кинетическая и потенциальная энергия. Вывод закона сохранения механической энергии Электрометр и электроскоп Составила: Фомичёва Оксана
Электрометр и электроскоп Составила: Фомичёва Оксана Аттестационная работа. Программа элективного курса по физике «Шагаем в мир электротехники»
Аттестационная работа. Программа элективного курса по физике «Шагаем в мир электротехники»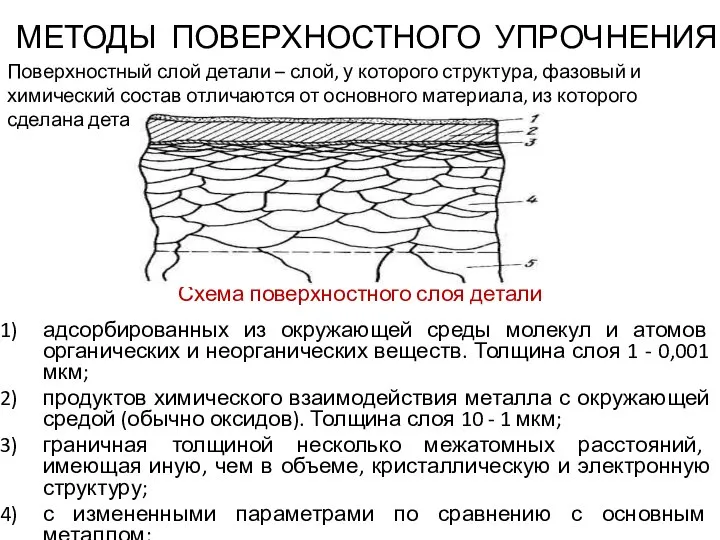 Методы поверхностного упрочнения
Методы поверхностного упрочнения Модель вязкой жидкости
Модель вязкой жидкости Электр жүктемелерінің графиктері
Электр жүктемелерінің графиктері Подготовка к ЕГЭ по физике
Подготовка к ЕГЭ по физике