Первое начало термодинамики. Внутренняя энергия. Работа и теплота. Теплоемкость идеального газа. (Лекция 7)
Содержание
- 2. Внутренняя энергия. Работа и теплота Наряду с механической энергией любое тело (или система) обладает внутренней энергией.
- 3. В термодинамике важно знать не абсолютное значение внутренней энергии, а её изменение. В термодинамических процессах изменяется
- 4. Внутренняя энергия U одного моля идеального газа равна: или Таким образом, внутренняя энергия зависит только от
- 5. В общем случае термодинамическая система может обладать как внутренней, так и механической энергией и разные системы
- 6. Количество теплоты, сообщаемой телу, идёт на увеличение внутренней энергии тела и на совершение телом работы: –
- 7. В дифференциальном виде первое начало термодинамики будем иметь : U – функция состояния системы; dU –
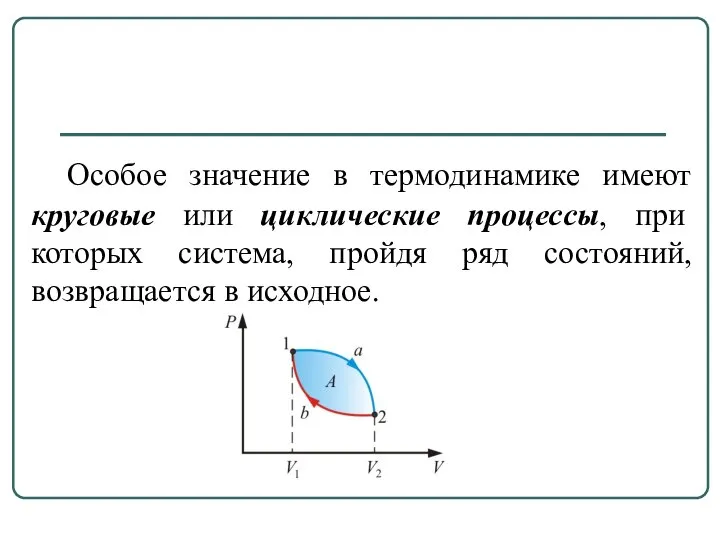
- 8. Особое значение в термодинамике имеют круговые или циклические процессы, при которых система, пройдя ряд состояний, возвращается
- 9. Для цикла из первого начала термодинамики Следовательно, нельзя построить периодически действующий двигатель, который совершал бы бóльшую
- 10. Теплоёмкость идеального газа. Уравнение Майера Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на
- 11. Для газов удобно пользоваться молярной теплоемкостью Сμ − количество теплоты, необходимое для нагревания 1 моля газа
- 12. Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании. Если газ нагревать при
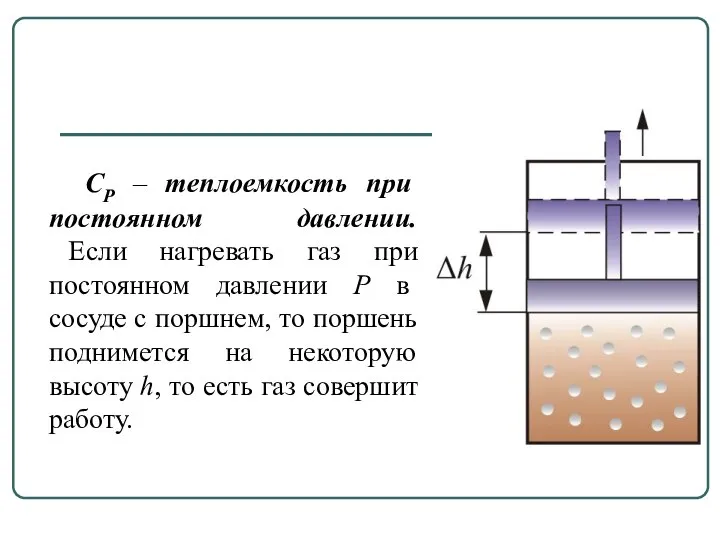
- 13. СР – теплоемкость при постоянном давлении. Если нагревать газ при постоянном давлении Р в сосуде с
- 14. Следовательно, подводимое тепло затрачивается и на нагревание и на совершение работы. Отсюда ясно, что Величины СР
- 15. При нагревании одного моля идеального газа при постоянном объёме, первое начало термодинамики запишется в виде: Теплоемкость
- 16. В общем случае так как U может зависеть не только от температуры. В случае идеального газа
- 17. Внутренняя энергия идеального газа является только функцией температуры (и не зависит от V, Р), поэтому формула
- 18. При изобарическом процессе кроме увеличения внутренней энергии происходит совершение работы газом: Из уравнения Клапейрона-Менделеева Подставив полученный
- 19. Это уравнение Майера для одного моля газа. Из него следует физический смысл универсальной газовой постоянной .
- 20. Теплоёмкости одноатомных и многоатомных газов Внутренняя энергия одного моля идеального газа равна
- 21. Теплоёмкости одноатомных газов Теплоемкость при постоянном объеме СV – величина постоянная, от температуры не зависит.
- 22. Из уравнения Майера Тогда, теплоемкость при постоянном давлении для одноатомных газов:
- 23. Полезно знать отношение: где γ − коэффициент Пуассона
- 24. Так как Тогда . Из этого следует, что Кроме того где i – число степеней свободы
- 25. Подставив в выражение для внутренней энергии, получим: а так как , то внутреннюю энергию можно найти
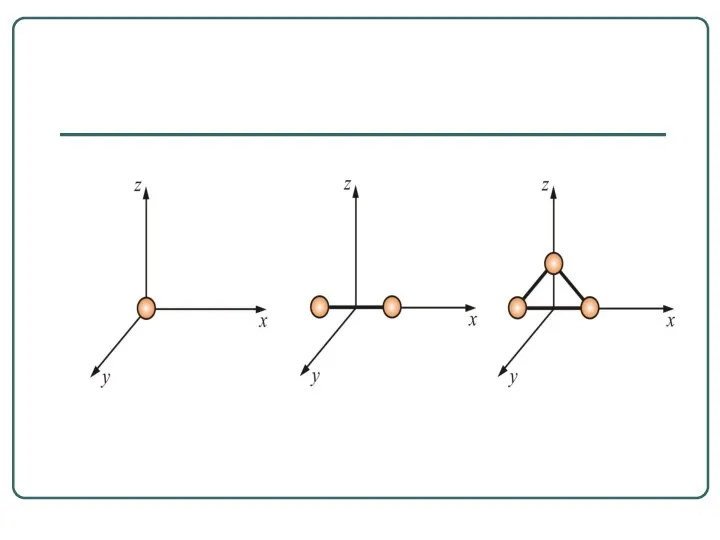
- 26. Необходимо учитывать вращательное и колебательное движение молекул. Число степеней свободы таких молекул Молекулы многоатомных газов нельзя
- 27. Числом степени свободы называется число независимых переменных, определяющих положение тела в пространстве и обозначается i Как
- 28. Многоатомная молекула может ещё и вращаться. Например, у двухатомных молекул вращательное движение можно разложить на два
- 31. У двухатомных жестких молекул пять степеней свободы (i = 5), а у трёхатомных шесть степеней свободы
- 32. Больцман доказал, что, средняя энергия, приходящаяся на одну степень свободы равна Закон о равномерном распределении энергии
- 33. На среднюю кинетическую энергию молекулы, имеющей i-степеней свободы приходится Это и есть закон Больцмана о равномерном
- 34. В общем случае, для молярной массы газа
- 35. Для произвольного количества газов: ,
- 36. Применение первого начала термодинамики к изопроцессам Используем I начало термодинамики или закон сохранения энергии в термодинамике
- 37. Изотермический процесс Изохорический процесс
- 38. Изобарический процесс Адиабатный процесс
- 39. Рассмотрим политропный процесс – такой процесс, при котором изменяются все основные параметры системы, кроме теплоемкости, т.е.
- 40. С помощью показателя n можно легко описать любой изопроцесс: 1. Изобарный процесс Р = const, n
- 41. Изохорный процесс Адиабатический процесс ΔQ = 0, n = γ, Сад = 0.
- 42. Во всех этих процессах работу можно вычислить по одной формуле:
- 44. Скачать презентацию





































 Течение воды через песок и трубки
Течение воды через песок и трубки Устный журнал
Устный журнал Презентация по физике "Виды электростанций" - скачать
Презентация по физике "Виды электростанций" - скачать  Электромагнетизм
Электромагнетизм Электрические схемы. Элементы и параметры электрических цепей
Электрические схемы. Элементы и параметры электрических цепей Аттестационная работа. Образовательная программа внеурочной деятельности по физике для 5-х классов
Аттестационная работа. Образовательная программа внеурочной деятельности по физике для 5-х классов Роботу виконала учениця 11-А класу Мельніченко Юлія
Роботу виконала учениця 11-А класу Мельніченко Юлія  Презентация по физике "Свойства электромагнитных волн" - скачать
Презентация по физике "Свойства электромагнитных волн" - скачать  Материалы и технологии изготовления нано- и микро-электромеханических систем НЭМС/МЭМС
Материалы и технологии изготовления нано- и микро-электромеханических систем НЭМС/МЭМС Аттестационная работа. Интеграция как способ формирования метапредметных компетенций при обучении физике
Аттестационная работа. Интеграция как способ формирования метапредметных компетенций при обучении физике Работа и мощность
Работа и мощность Презентация по физике "Физика за чашкой чая" - скачать
Презентация по физике "Физика за чашкой чая" - скачать  Імітаційна модель виміру параметрів сигналів частотної маніпуляції
Імітаційна модель виміру параметрів сигналів частотної маніпуляції Развитие средств связи. Радиолокация
Развитие средств связи. Радиолокация Момент силы относительно точки
Момент силы относительно точки Паровая машина. История изобретения паровой машины
Паровая машина. История изобретения паровой машины Количество теплоты. Удельная теплоемкость
Количество теплоты. Удельная теплоемкость Презентация по теме «Термометр»
Презентация по теме «Термометр» Схемы многокорпусных выпарных установок
Схемы многокорпусных выпарных установок Поляризация света
Поляризация света Магнетизм. Структурно-логическая схема
Магнетизм. Структурно-логическая схема Презентация по физике "Знатоки физики и техники" - скачать
Презентация по физике "Знатоки физики и техники" - скачать  Энергия? Карпова Лариса Борисовна Учитель физики ЗОШ№ 3
Энергия? Карпова Лариса Борисовна Учитель физики ЗОШ№ 3 Қатты дененің динамикасы
Қатты дененің динамикасы Теплопроводность. Основные положения теории теплопроводности. (Тема 4. Лекции 14,15)
Теплопроводность. Основные положения теории теплопроводности. (Тема 4. Лекции 14,15) Показатели качества регулирования. Точность регулирования
Показатели качества регулирования. Точность регулирования Примесные полупроводники
Примесные полупроводники Direct Shift Gearbox
Direct Shift Gearbox