Содержание
- 2. ВВЕДЕНИЕ Термодинамика– наука о превращениях различных видов энергии из одного в другой, о наиболее общих макроскопи-ческих
- 3. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ
- 5. Температура – физическая величина, являющаяся параметром состояния системы (тела). Внутри гомогенной системы при термическом равновесии она
- 6. Термометр представляет собой систему, обла-дающую легко и точно измеримыми свойствами, которые однозначно изменяются в зависимости от
- 20. Тема: «Газовые законы. 1. Изопроцессы в газах 2. Газовые законы -Бойля – Мариотта - Гей-Люссака -Шарля
- 21. Газовый закон –количественная зависимость между двумя термодинамическими параметрами газа при фиксированном значении третьего. Газовых закона, как
- 22. Изопроцессы в газах Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами. Рассмотрим следующие изопроцессы:
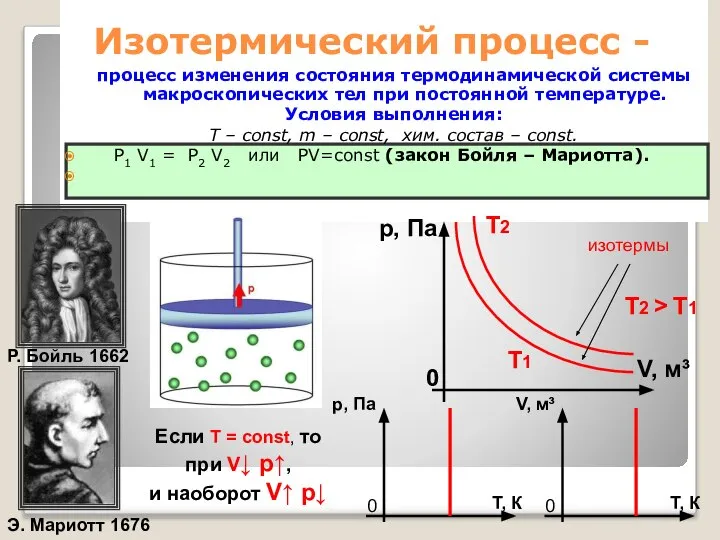
- 23. Изотермический процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре. Условия выполнения: Т
- 24. Закон Бойля-Мариотта справедлив для любых газов, а так же и для их смесей, например, для воздуха.
- 25. Применение закона Бойля-Мариотта Газовые законы активно работают не только в технике, но и в живой природе,
- 26. При дыхании межреберные мышцы и диафрагма периодически изменяют объем грудной клетки. Когда грудная клетка расширяется, давление
- 27. Применение закона Бойля-Мариотта Другими словами воздух идет из окружающей среды в легкие самотеком до тех пор,
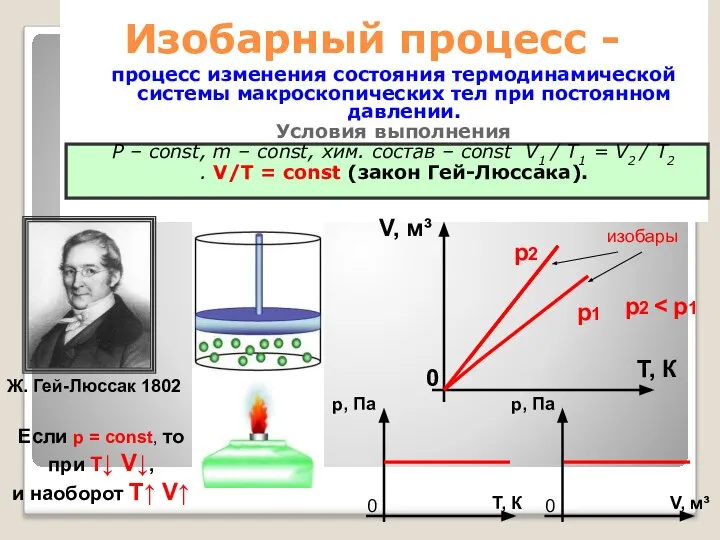
- 28. Изобарный процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении. Условия выполнения Р
- 29. Пример проявления Расширение газа в цилиндре с подвижным поршнем при нагревании цилиндра
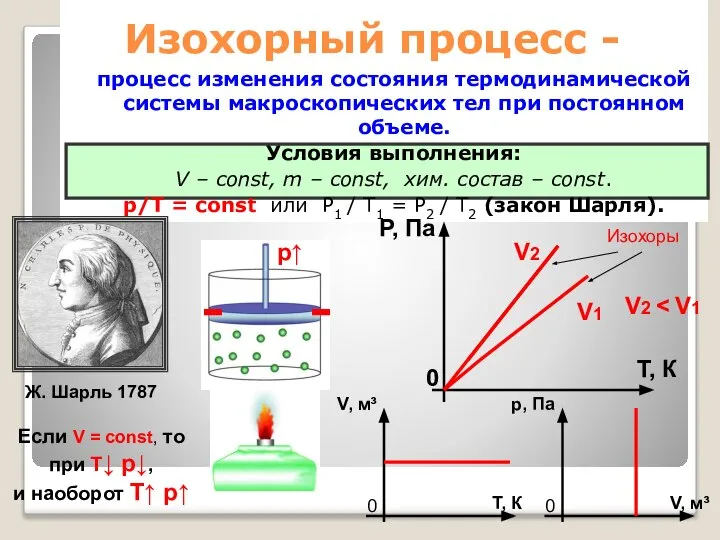
- 30. Изохорный процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме. Условия выполнения: V
- 31. Пример проявления Нагревание газа любой закрытой емкости, например в электрической лампочке при ее включении.
- 32. 1834г. Французский физик Клапейрон, работавший длительное время в Петербурге, вывел уравнение состояния идеального газа при постоянной
- 33. Если взять произвольную массу газа m при любых условиях, то уравнение Клапейрона примет вид: PV =
- 34. Особенность газообразного состояния 1. В свойствах газов: - Управление давлением газа - Большая сжимаемость - Зависимость
- 35. Использование свойств газов в технике Газы в технике, применяются главным образом в качестве топлива; сырья для
- 36. Использование свойств газов в технике В огнестрельном оружии для выталкивания пули из ствола. В качестве теплоносителей;
- 37. Обобщение PV = m/M·RT P1V1 = P2V2 V = const T = const P = const
- 38. (Название процесса)
- 39. (Название процесса)
- 40. (Название процесса)
- 42. Скачать презентацию




































 Физические основы механики
Физические основы механики Изучение капиллярных явлений, обусловленных поверхностным натяжением жидкости
Изучение капиллярных явлений, обусловленных поверхностным натяжением жидкости ПРЕЗЕНТАЦИЯ по теме: «Фотоэффект»
ПРЕЗЕНТАЦИЯ по теме: «Фотоэффект»  Закон Джоуля - Ленца
Закон Джоуля - Ленца Молекулярная физика. Молекулярно-кинетическая теория идеальных газов
Молекулярная физика. Молекулярно-кинетическая теория идеальных газов Оптика полупроводников
Оптика полупроводников ДВИГАТЕЛЬ ВНУТРЕННЕГО СГОРАНИЯ ИСТОРИЯ СОЗДАНИЯ
ДВИГАТЕЛЬ ВНУТРЕННЕГО СГОРАНИЯ ИСТОРИЯ СОЗДАНИЯ Основы теории подобия
Основы теории подобия Сушка в кипящем слое
Сушка в кипящем слое Машины постоянного тока (МПТ)
Машины постоянного тока (МПТ) Зямны магнетызм
Зямны магнетызм Дифференциальные защиты шин, ошиновок, трансформаторов. Алгоритм работы. Взаимодействие с устройствами РЗА
Дифференциальные защиты шин, ошиновок, трансформаторов. Алгоритм работы. Взаимодействие с устройствами РЗА Влияние механических и тепловых воздействий на механические свойства материалов (прочность и пластичность)
Влияние механических и тепловых воздействий на механические свойства материалов (прочность и пластичность) Жарық дисперсиясы және поляризациясы
Жарық дисперсиясы және поляризациясы Модели атомов. Опыт Резерфорда. _
Модели атомов. Опыт Резерфорда. _ Электризация в природе и в жизни
Электризация в природе и в жизни ГИА тренировочные задания № 24 и 25 МОСКВА 2010 ЭКСМО Диагностика 2013
ГИА тренировочные задания № 24 и 25 МОСКВА 2010 ЭКСМО Диагностика 2013 Плавание судов. Воздухоплавание
Плавание судов. Воздухоплавание Теория автоматического управления
Теория автоматического управления Презентация по физике "Электроемкость и конденсаторы" - скачать бесплатно
Презентация по физике "Электроемкость и конденсаторы" - скачать бесплатно Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Жарық кванттары туралы. Планк гипотезасы. Планк формуласы
Жарық кванттары туралы. Планк гипотезасы. Планк формуласы Динаамика. Вращательное движение. Энергия. (Лекция 3)
Динаамика. Вращательное движение. Энергия. (Лекция 3) Презентация Сварочные трансформаторы
Презентация Сварочные трансформаторы 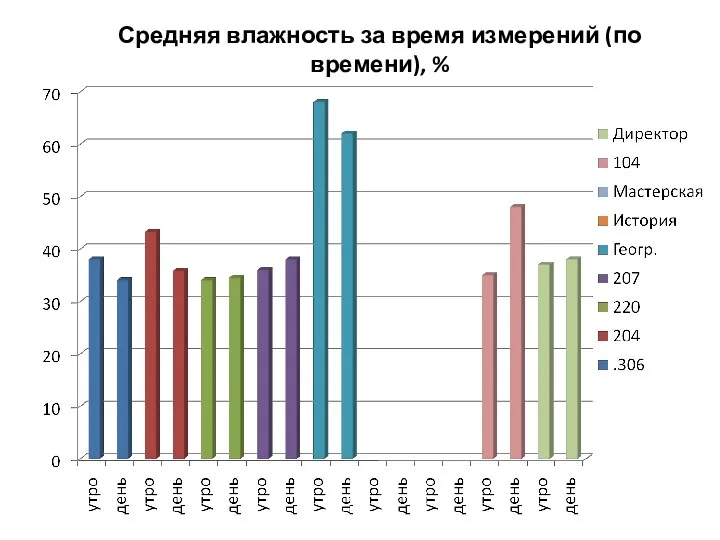 Таблицы. Средняя влажность за время измерений (по времени), %
Таблицы. Средняя влажность за время измерений (по времени), % Применение технологии интерактивного обучения на уроках физики
Применение технологии интерактивного обучения на уроках физики Структурные превращения в деформированных кристаллах. Движущие силы рекристаллизации
Структурные превращения в деформированных кристаллах. Движущие силы рекристаллизации Деформація тіл
Деформація тіл