Содержание
- 2. Содержание: Определение. Внутренняя энергия. Теплоемкость. Первый закон термодинамики. Работа в термодинамике. Количество теплоты. Уравнение теплового баланса.
- 3. Определение: Термодинамика – это раздел физики, в котором изучаются общие свойства макроскопических систем, находящихся в состоянии
- 4. Внутренняя энергия. Внутренняя энергия - это энергия движения и взаимодействия частиц, из которых состоит тело. U=Kвсех
- 5. На каждую степень свободы приходится энергия Для идеального газа: =
- 6. Способы изменения внутренней энергии: Теплопроводность – это вид теплопередачи, осуществляющийся за счёт движения и взаимодействия частиц,
- 7. Теплоемкости Теплоемкость : Удельная теплоемкость: Молярная теплоемкость: Cвязь между молярной теплоемкостью и удельной: Физический смысл :
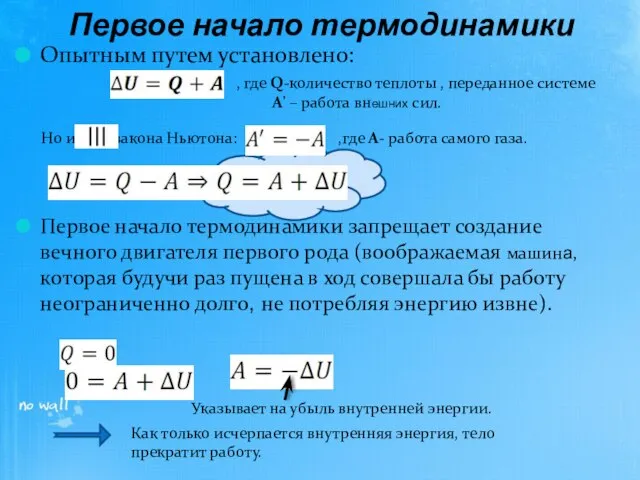
- 8. Опытным путем установлено: Первое начало термодинамики запрещает создание вечного двигателя первого рода (воображаемая машина, которая будучи
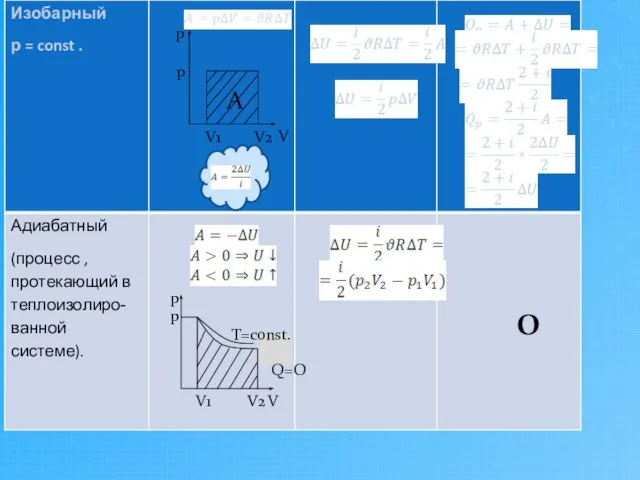
- 9. Применение первого начала термодинамики к изопроцессам
- 10. О
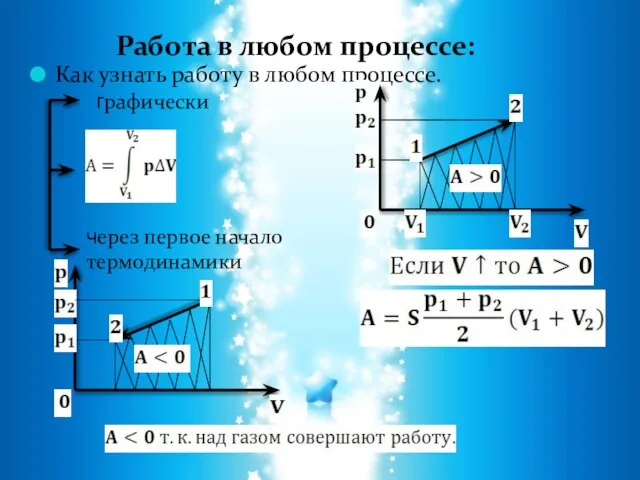
- 11. Работа в термодинамике: Необходимым условием совершения работы является перемещение тела под действием силы. А - есть
- 12. Работа газа в изобарном процессе.
- 13. Как узнать работу в любом процессе. Работа в любом процессе: графически через первое начало термодинамики
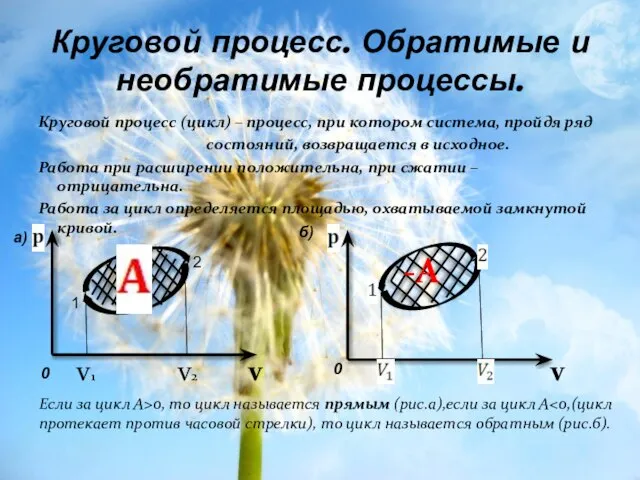
- 14. Работа в круговом процессе: Круговой процесс – это процесс, в результате которого газ, выйдя из какого-либо
- 15. Количество теплоты. Количество теплоты есть функция процесса. Результатом передачи количества теплоты является только изменение внутренней энергии
- 16. Уравнение теплового баланса. Т Ж Г 1) Условия необходимые для процесса плавления: (аналогичные условия необходимы для
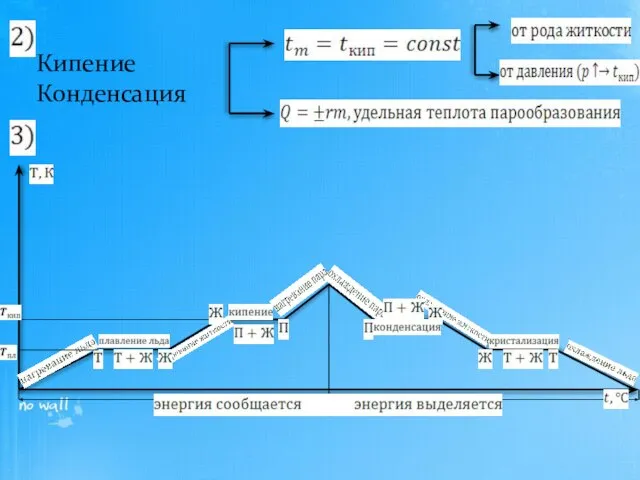
- 17. Кипение Конденсация
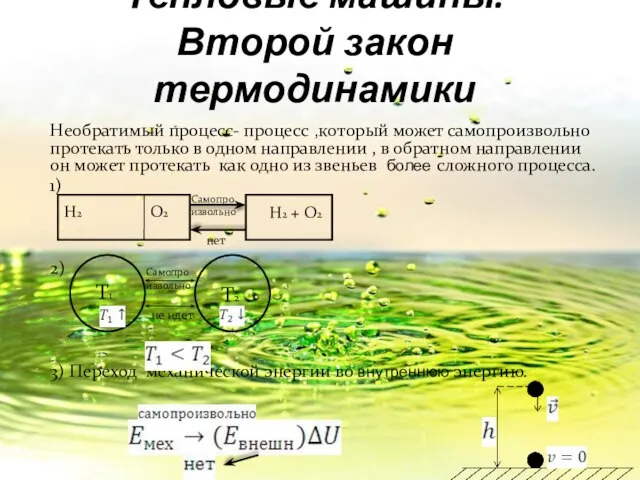
- 18. Тепловые машины. Второй закон термодинамики Необратимый процесс- процесс ,который может самопроизвольно протекать только в одном направлении
- 19. Второй закон термодинамики (формулировка Р. Клаузиуса): невозможен круговой процесс, единственным результатом которого была бы передача энергии
- 20. Третий закон термодинамики: Рассматривает поведение термодинамической системы при . Из третьего закона термодинамики вытекает недостижимость .
- 21. Круговой процесс. Обратимые и необратимые процессы. Круговой процесс (цикл) – процесс, при котором система, пройдя ряд
- 22. Обратимые и необратимые процессы Обратимый процесс- процесс, при котором система, пройдя через ряд состояний, возвращается в
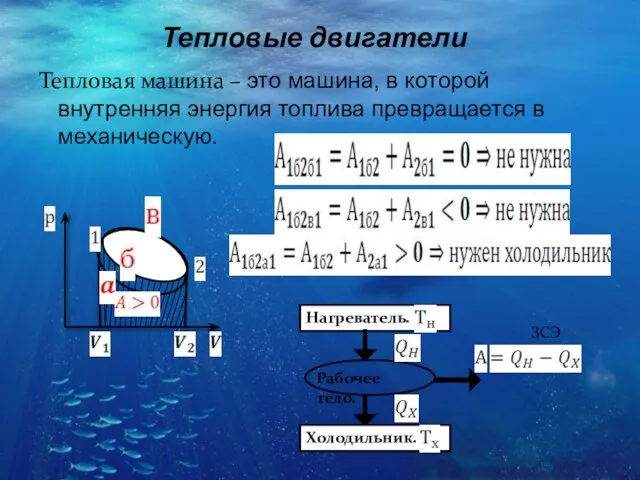
- 23. Тепловые двигатели Тепловая машина – это машина, в которой внутренняя энергия топлива превращается в механическую.
- 24. КПД: Для любой тепловой машины , реальной и идеальной. Машина идеальная, т.к. при заданных температурах нагревателя
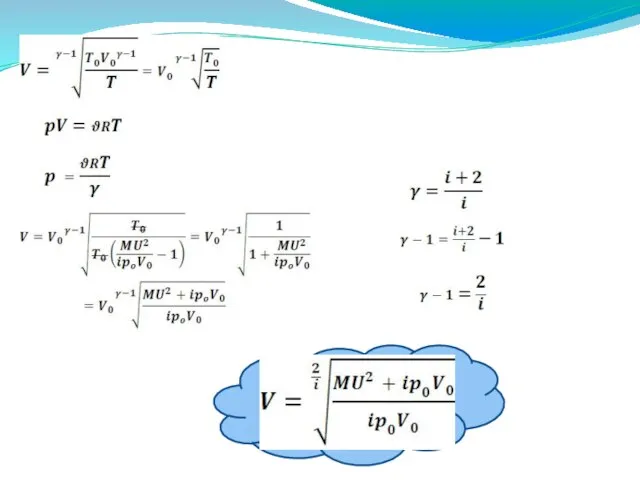
- 25. Задачи: Идеальный одноатомный газ, взятый в количестве n моль , нагревают при постоянно давлении . Какое
- 26. Один моль идеального газа находится в цилиндре под поршнем при температуре T1 . Газ при постоянном
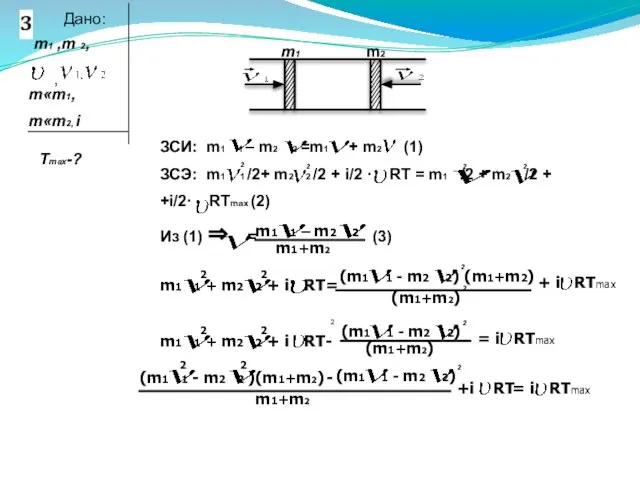
- 27. 2
- 30. 2
- 31. m1 1+m1m2 1 + m1m2 2 + m2 2 – m1 1+ 2m1 1m2 2–m2 2
- 33. T4
- 38. Скачать презентацию


























 Ультразвуковые колебания. Ультразвук и инфразвук
Ультразвуковые колебания. Ультразвук и инфразвук Характеристика волн. Величины, характеризующие волну
Характеристика волн. Величины, характеризующие волну Линзы
Линзы Теплопроводность
Теплопроводность Превращение энергии при гармонических колебаниях. Физика. 11 класс
Превращение энергии при гармонических колебаниях. Физика. 11 класс Обработка экспериментальных данных. Часть 2
Обработка экспериментальных данных. Часть 2 Электризация тел при соприкосновении. Взаимодействие заряженных тел. Урок физики в 8 классе
Электризация тел при соприкосновении. Взаимодействие заряженных тел. Урок физики в 8 классе Приборы для измерения давления и их применения
Приборы для измерения давления и их применения The possibility of modifying the elements of the metal powder assembly with nanoparticles in order to reduce the friction
The possibility of modifying the elements of the metal powder assembly with nanoparticles in order to reduce the friction Идентификация и моделирование CW–crds спектра поглощения молекулы двуокиси азота в области 6000 – 6400 см -1
Идентификация и моделирование CW–crds спектра поглощения молекулы двуокиси азота в области 6000 – 6400 см -1 Наноматериалы: физические свойства и получение
Наноматериалы: физические свойства и получение Поляризация диэлектриков
Поляризация диэлектриков Шкала электромагнтных излучений
Шкала электромагнтных излучений Электрические свойства дисперсных систем. (Лекция 5)
Электрические свойства дисперсных систем. (Лекция 5) Институт физики, нанотехнологий и телекоммуникаций СПбГПУ Владимир Юрьевич Сергеев проф., д.ф.м.н., кафедра физики плазмы
Институт физики, нанотехнологий и телекоммуникаций СПбГПУ Владимир Юрьевич Сергеев проф., д.ф.м.н., кафедра физики плазмы  Ток кескіш. Токтың сатылы қорғанысы
Ток кескіш. Токтың сатылы қорғанысы Влияние солнечных рентгеновских вспышек на изменения атмосферного электрического поля и прохождение волн СДВ диапазона
Влияние солнечных рентгеновских вспышек на изменения атмосферного электрического поля и прохождение волн СДВ диапазона Презентация по физике "Ломоносов" - скачать бесплатно
Презентация по физике "Ломоносов" - скачать бесплатно Физическая химия дисперсных систем. Коллоидные растворы
Физическая химия дисперсных систем. Коллоидные растворы Закон сохранения импульса
Закон сохранения импульса Виды энергии. Кинетическая энергия
Виды энергии. Кинетическая энергия Звук. Джерела звуків
Звук. Джерела звуків Презентация Физика вокруг нас. Урок физики. 8 класс.
Презентация Физика вокруг нас. Урок физики. 8 класс. Виды и назначение токарных резцов (7 класс)
Виды и назначение токарных резцов (7 класс) Тепловые явления § 1. Тепловое движение. Температура. Тепловые явления – явления, связанные с нагреванием или охлаждением тел, с изменением температуры. (нагревание и охлаждение воздуха, таяние льда, плавление металлов ….)
Тепловые явления § 1. Тепловое движение. Температура. Тепловые явления – явления, связанные с нагреванием или охлаждением тел, с изменением температуры. (нагревание и охлаждение воздуха, таяние льда, плавление металлов ….) энергосберегающие источники света
энергосберегающие источники света Коллоидты химия. Беттік керілу. Беттік керілу ұғымы. Беттік керілу, оны анықтау әдістері
Коллоидты химия. Беттік керілу. Беттік керілу ұғымы. Беттік керілу, оны анықтау әдістері Презентация по физике "Скорость. Единицы скорости" - скачать
Презентация по физике "Скорость. Единицы скорости" - скачать