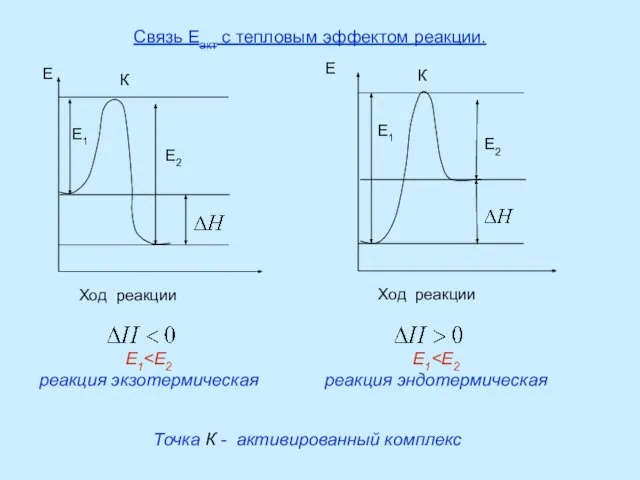
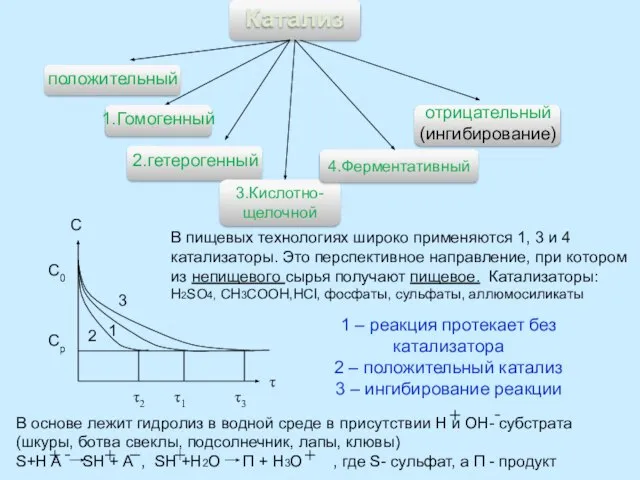
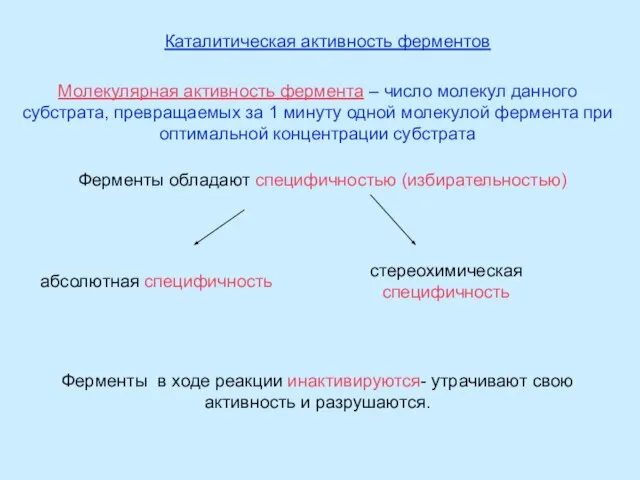
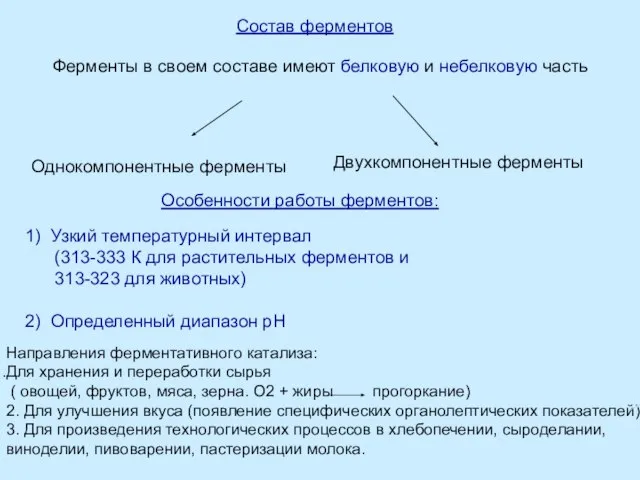
Ферментативный катализ.
Ферменты – биологические катализаторы – превосходят по активности химические катализаторы.
Это продукты жизнедеятельности живых организмов. Известно 2 тысячи ферментов. Они бывают двух типов : протее (белки) и сложные(белок+небелковые вещества)
1 моль фермента сахарозы за 1 с способен расщепить 1 000 молей свекольного сахара
1 г кристаллов пепсина расщепляет 50 кг яичного белка, он разлагает белки, но не влияет на скорость окислительных процессов. Фермент катализа разлагает перокстид водорода, но не действует на белки
1 г кристаллов ренина свертывает 72 т молока
Название субстрата(вещества, подвергающиеся превращению под действием фермента) + «аза»
Ферменты протеазы расщепляют протеины (белки)
Ферменты липазы расщепляют липиды (жиры)
Количественно кинетика ферментативных реакций описывается уравнением Михаэлиса.









 Линии влияния. Лекция 3. Расчёт сооружений на действие подвижных и других временных нагрузок
Линии влияния. Лекция 3. Расчёт сооружений на действие подвижных и других временных нагрузок Плазмалық технологиялардың физикалық негіздері
Плазмалық технологиялардың физикалық негіздері ЭЛЕКТРОСТАНЦИИ
ЭЛЕКТРОСТАНЦИИ Электрические цепи переменного тока. Тема 2-5
Электрические цепи переменного тока. Тема 2-5 Диагностика и ремонт тормозной системы легкового автомобиля
Диагностика и ремонт тормозной системы легкового автомобиля Презентация по физике "Кинематика материальной точки." - скачать _
Презентация по физике "Кинематика материальной точки." - скачать _ Задачи метрологии
Задачи метрологии Погрешности средств измерений. Классы точности средств измерений
Погрешности средств измерений. Классы точности средств измерений გალვანიზაცია
გალვანიზაცია Сопротивление материалов. Курс лекций
Сопротивление материалов. Курс лекций Датчики давления
Датчики давления Интерференция света
Интерференция света Сұйықтықтарды айдау
Сұйықтықтарды айдау Ременные передачи
Ременные передачи Методы наблюдения и регистрации элементарных частиц
Методы наблюдения и регистрации элементарных частиц Электрическое поле в вакууме. Электромагнитное поле - материальный носитель электромагнитного взаимодействия
Электрическое поле в вакууме. Электромагнитное поле - материальный носитель электромагнитного взаимодействия МОУ «СОШ № 30 г.Белово»
МОУ «СОШ № 30 г.Белово» Spektroskopische speziation von actiniden mittels synchrotronstrahlung
Spektroskopische speziation von actiniden mittels synchrotronstrahlung Термодинамика силикатов и оксидных соединений. Теплоёмкость и закон Кирхгофа. (Тема 2)
Термодинамика силикатов и оксидных соединений. Теплоёмкость и закон Кирхгофа. (Тема 2) Презентация к уроку
Презентация к уроку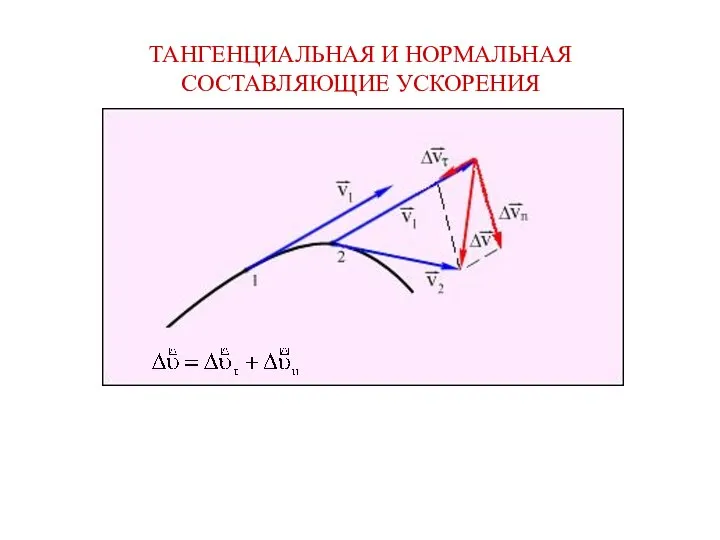 Тангенциальная и нормальная составляющие ускорения
Тангенциальная и нормальная составляющие ускорения Плотность вещества. Урок физики в 7 классе
Плотность вещества. Урок физики в 7 классе Циклы углов и первый импульс как пророк. Циклы по цене и цели
Циклы углов и первый импульс как пророк. Циклы по цене и цели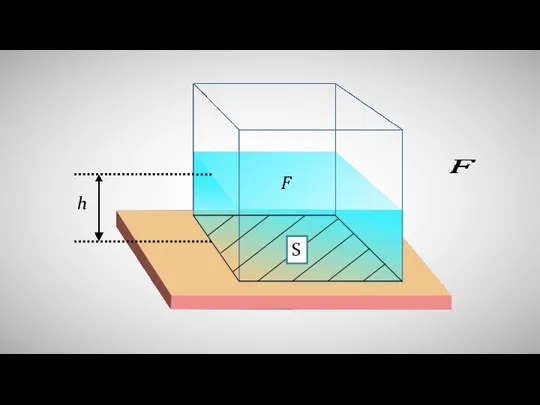 Расчёт давления жидкости на дно и стенки сосуда
Расчёт давления жидкости на дно и стенки сосуда Презентация по физике "Устройство и принцип действия двигателя внутреннего сгорания" -
Презентация по физике "Устройство и принцип действия двигателя внутреннего сгорания" -  Макс Планк 23.05.1858-4.10.1947
Макс Планк 23.05.1858-4.10.1947  Свободное падение
Свободное падение Учебный курс
Учебный курс