Содержание
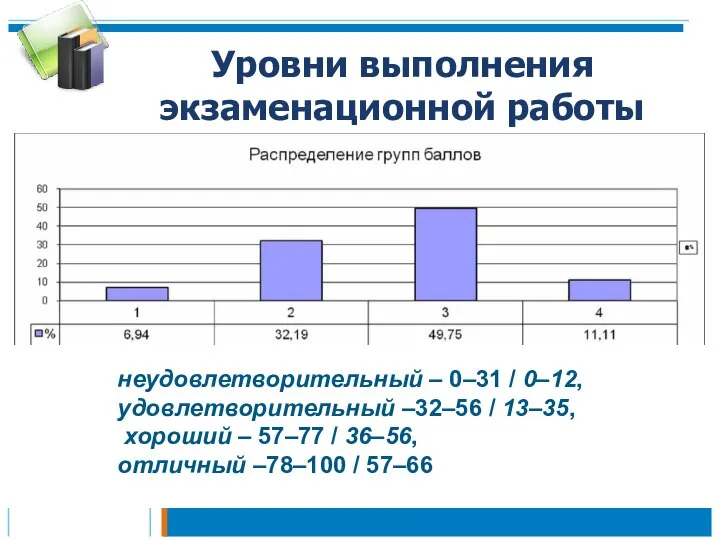
- 2. Уровни выполнения экзаменационной работы неудовлетворительный – 0–31 / 0–12, удовлетворительный –32–56 / 13–35, хороший – 57–77
- 3. Результаты выполнения заданий, проверяющих усвоение содержания блока «Теоретические основы химии» Строение электронных оболочек атомов элементов первых
- 4. 8. Вещества молекулярного и немолекулярного строения. Зависимость свойств веществ от особенностей их кристаллической решетки - 71,2%
- 5. Пример 1 Верны ли следующие суждения о металлах и их соединениях? А. Высшие оксиды всех элементов
- 6. Пример 2 Скорость реакции омыления сложного эфира CH3COOC2H5 + OH → CH3COO + C2H5OH не зависит
- 7. Пример 3 Химическое равновесие в системе С2Н5ОН + СН3СООН → СН3СООС2Н5 + Н2О – Q смещается
- 8. Пример 4 Взаимодействие 2-метилпропана и брома при комнатной температуре на свету 1) относится к реакциям замещения
- 9. Блок «Неорганическая химия» Классификация и номенклатура неорганических веществ - 85,4% Характерные химические свойства простых веществ –
- 10. Пример 5 Карбонат бария реагирует с водным раствором каждого из двух веществ: 1) H2SO4 и NaOH
- 11. Пример 6 В схеме превращений ZnO → X1 → X2 → Zn(OH)2 веществами Х1 и Х2
- 12. Блок «Органическая химия» Теория строения органических соединений. Изомерия структурная и пространственная. Гомологи и гомологический ряд -
- 13. Пример 7 С раствором гидроксида натрия реагирует 1) CH2 = CH2 (16%) 2) CH3 – O
- 14. Пример 8 С 2-аминопропановой кислотой реагируют 1) этан 2) сульфат натрия 3) пропанол-1 4) толуол 5)
- 15. Пример 9 В схеме превращений HC ≡ CH → X → CH3COOH веществом Х является 1)
- 16. Пример 10 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: X1→бензол С2Н4, Н +
- 17. Блок «Методы познания веществ и химических реакций» Раздел «Экспериментальные основы химии» Правила работы в лаборатории. Лабораторная
- 18. Раздел «Расчеты по химическим формулам и уравнениям реакций» Вычисление массы растворенного вещества, содержащегося в определенной массе
- 19. Пример 11 Верны ли следующие суждения о правилах техники безопасности? А. Пробирку с бензолом запрещается нагревать
- 20. Пример 12 Синтез-газ, используемый в производстве метанола, представляет собой смесь 1) CH4 и CO2 (22%) 2)
- 21. Пример 13 В 15%-ном растворе серной кислоты массой 300 г растворили карбид алюминия. Выделившийся при этом
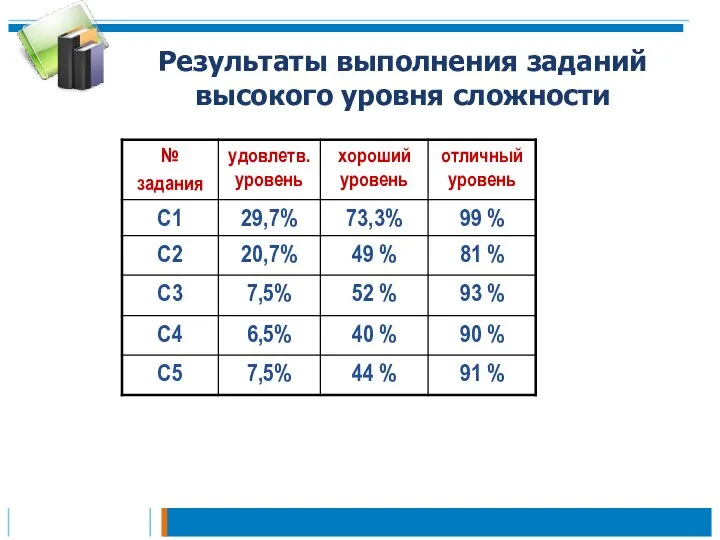
- 22. Результаты выполнения заданий высокого уровня сложности
- 23. Общая характеристика уровня подготовки Минимальный уровень: тестовый балл – 0–31; первичный балл – 0–12; процент выпускников
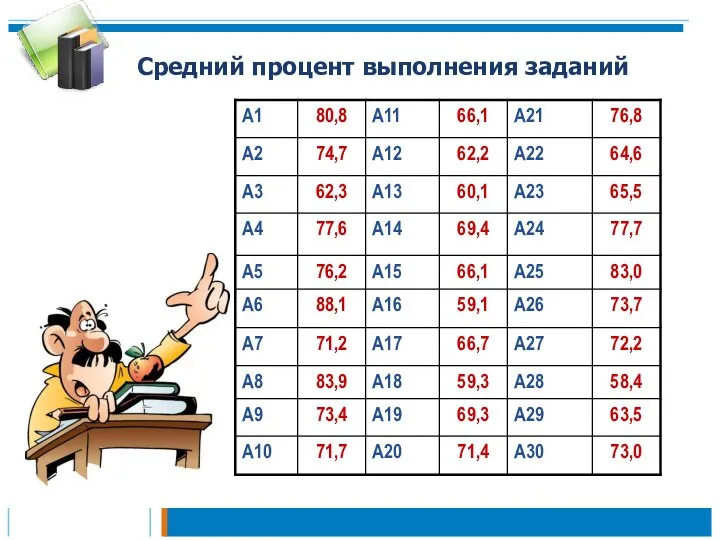
- 24. Средний процент выполнения заданий
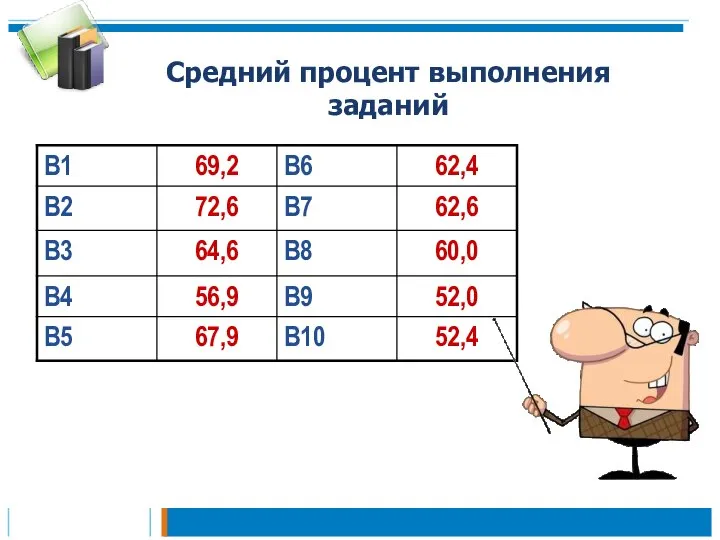
- 25. Средний процент выполнения заданий
- 27. Скачать презентацию




















 Факторы почвообразования
Факторы почвообразования Дикарбоновые кислоты
Дикарбоновые кислоты Алкени
Алкени Тема: “ Природные источники углеводородов. Нефть.”
Тема: “ Природные источники углеводородов. Нефть.” Циклоалканы. Строение, изомерия, получение и свойства
Циклоалканы. Строение, изомерия, получение и свойства Дозиметрия ионизирующих излучений. Влияние радиации на организм человека
Дозиметрия ионизирующих излучений. Влияние радиации на организм человека Производство серной кислоты
Производство серной кислоты Органика из аптеки
Органика из аптеки Способы перегонки
Способы перегонки Спирты. Классификация спиртов
Спирты. Классификация спиртов Дисперсные системы: общая характеристика и классификация
Дисперсные системы: общая характеристика и классификация Атом – сложная частица 11 класс
Атом – сложная частица 11 класс 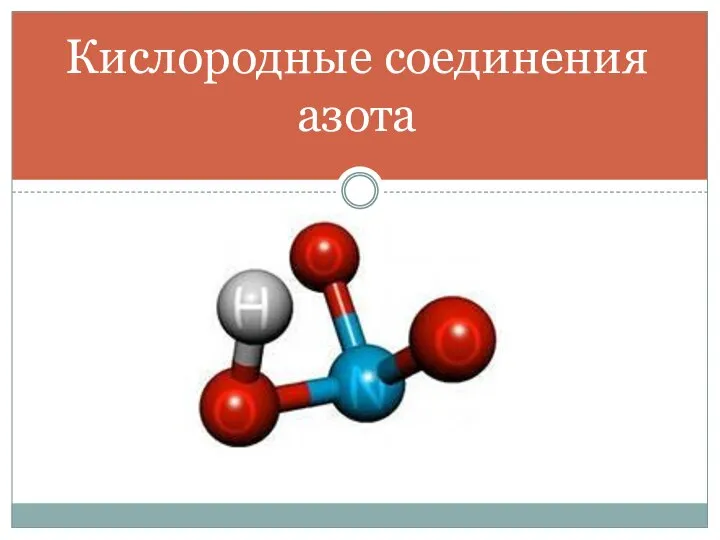 Кислородные соединения азота
Кислородные соединения азота Презентация по Химии "Полімери" - скачать смотреть бесплатно
Презентация по Химии "Полімери" - скачать смотреть бесплатно Ацетилен и его гомологи
Ацетилен и его гомологи Фосфор. Открытие фосфора
Фосфор. Открытие фосфора Презентация по Химии "Витамин C" - скачать смотреть
Презентация по Химии "Витамин C" - скачать смотреть  Органическая химия. Глицерин
Органическая химия. Глицерин Минералы. Определение минералов
Минералы. Определение минералов Виртуальный урок по химии тема: Химические реакции Практическое занятие Подготовил: Учитель химии МОУ «МЛ №1
Виртуальный урок по химии тема: Химические реакции Практическое занятие Подготовил: Учитель химии МОУ «МЛ №1 Получение этилена и изучение его свойств
Получение этилена и изучение его свойств Виды контроля коррозии
Виды контроля коррозии Химическая технология неорганических веществ
Химическая технология неорганических веществ Типы изомерии 1.Историческая справка 2.Изомерия. Изомеры. 3.Типы изомерии. Классификация изомеров.
Типы изомерии 1.Историческая справка 2.Изомерия. Изомеры. 3.Типы изомерии. Классификация изомеров.  Способы разделения смесей
Способы разделения смесей Поверхностные явления и дисперсные системы
Поверхностные явления и дисперсные системы Полезные ископаемые. Золото
Полезные ископаемые. Золото Презентация по Химии "Симметрия в мире химии: кристаллы" - скачать смотреть
Презентация по Химии "Симметрия в мире химии: кристаллы" - скачать смотреть