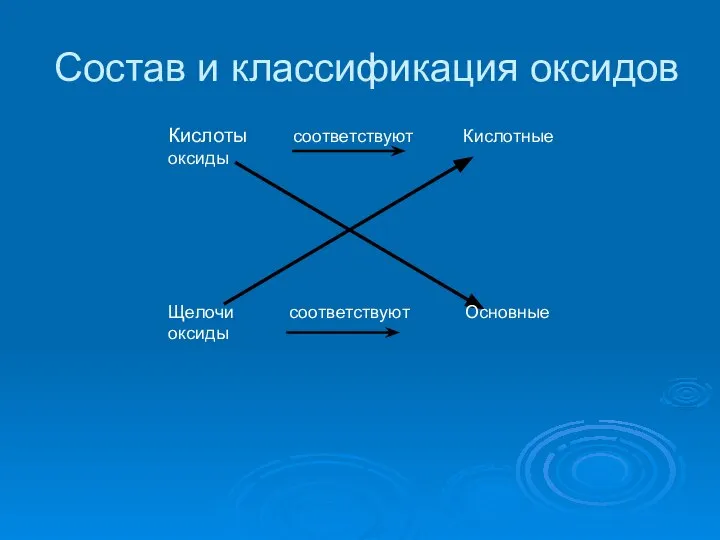
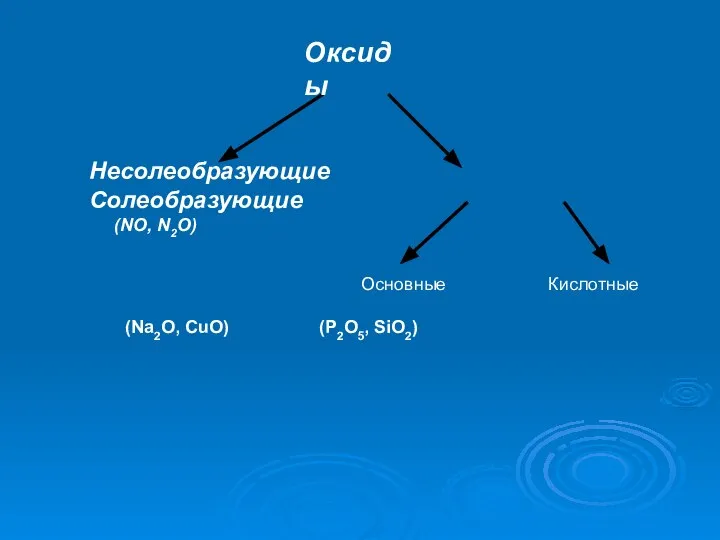
Слайд 3
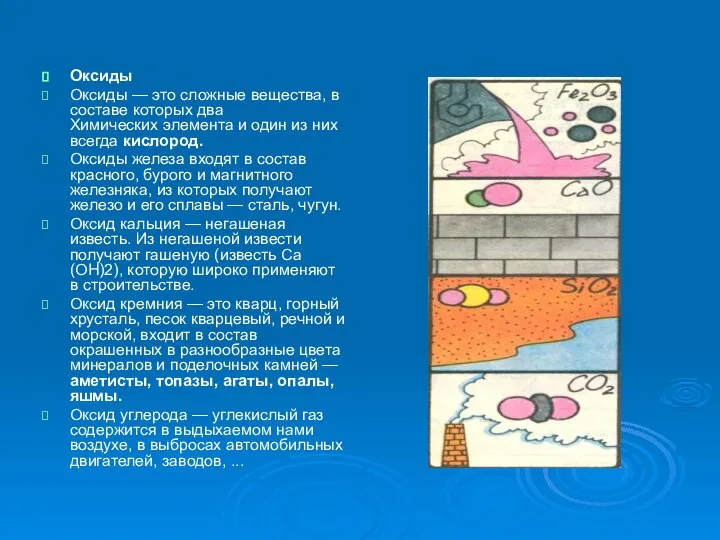
Оксиды
Оксиды — это сложные вещества, в составе которых два Химических элемента
и один из них всегда кислород.
Оксиды железа входят в состав красного, бурого и магнитного железняка, из которых получают железо и его сплавы — сталь, чугун.
Оксид кальция — негашеная известь. Из негашеной извести получают гашеную (известь Са(ОН)2), которую широко применяют в строительстве.
Оксид кремния — это кварц, горный хрусталь, песок кварцевый, речной и морской, входит в состав окрашенных в разнообразные цвета минералов и поделочных камней — аметисты, топазы, агаты, опалы, яшмы.
Оксид углерода — углекислый газ содержится в выдыхаемом нами воздухе, в выбросах автомобильных двигателей, заводов, ...




 Теория гибридизации. (Лекция 3)
Теория гибридизации. (Лекция 3) Эквиваленты веществ. Жидкое состояние, растворы
Эквиваленты веществ. Жидкое состояние, растворы Презентация по Химии "Интегрированный урок" - скачать смотреть
Презентация по Химии "Интегрированный урок" - скачать смотреть  ИЗВЕСТНЫЕ УЧЕНЫЕ – ХИМИКИ Немного из истории химии
ИЗВЕСТНЫЕ УЧЕНЫЕ – ХИМИКИ Немного из истории химии Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ №2»
Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ №2»  Radiation dosimetry
Radiation dosimetry Кислород. Происхождение слова Кислород
Кислород. Происхождение слова Кислород Формы выделения минералов
Формы выделения минералов Харчові добавки
Харчові добавки  Соединения щелочных металлов
Соединения щелочных металлов Галогены. Способы получения, применение
Галогены. Способы получения, применение Липидтер. Стероидтар. Терпеноидтар. Қорытынды. Пайдаланылған әдебиеттер
Липидтер. Стероидтар. Терпеноидтар. Қорытынды. Пайдаланылған әдебиеттер Сложные эфиры. Жиры. Мыла. (10 класс)
Сложные эфиры. Жиры. Мыла. (10 класс) Введение в органическую химию
Введение в органическую химию The ideal gas equation
The ideal gas equation Классификация основных пород
Классификация основных пород Свойства океанической воды
Свойства океанической воды Реакции ионного обмена
Реакции ионного обмена Такой разный песок Выполнила: Гайдукова Екатерина, 10 класс
Такой разный песок Выполнила: Гайдукова Екатерина, 10 класс  Тема: Ионные уравнения реакции Вспомним реакцию нейтрализации.
Тема: Ионные уравнения реакции Вспомним реакцию нейтрализации.  Презентация по Химии "Презентация Аммиак" - скачать смотреть
Презентация по Химии "Презентация Аммиак" - скачать смотреть  Полисульфидные каучуки
Полисульфидные каучуки Основы теории сплавов. Типы сплавов. Диаграммы состояния сплавов, принцип их построения. (Лекция 2)
Основы теории сплавов. Типы сплавов. Диаграммы состояния сплавов, принцип их построения. (Лекция 2) Химическая кинетика
Химическая кинетика Серебро
Серебро Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Характеристика органических соединений
Характеристика органических соединений Сплавы, растворы, смеси
Сплавы, растворы, смеси