Содержание
- 2. Теория гибридизации Лайнус Полинг Лаунус Полинг – американский химик, физик (1901-1994 гг) Первые исследования по применению
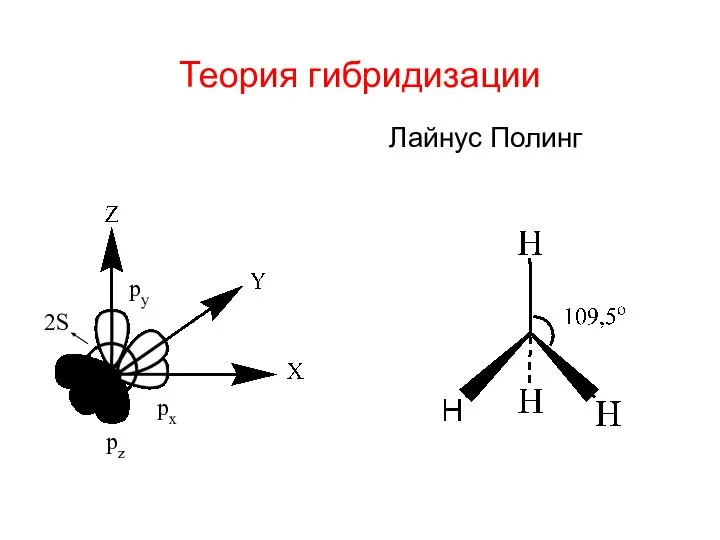
- 3. Теория гибридизации Лайнус Полинг 2S pz px py
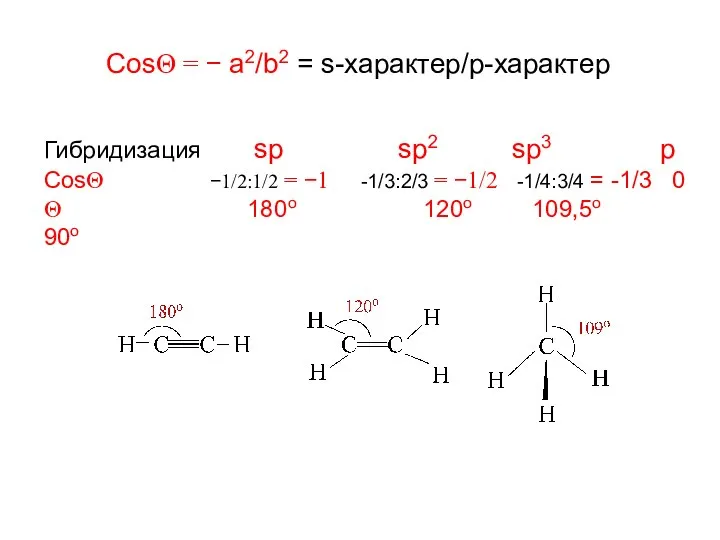
- 5. CosΘ = − a2/b2 = s-характер/p-характер Гибридизация sp sp2 sp3 p CosΘ −1/2:1/2 = −1 -1/3:2/3
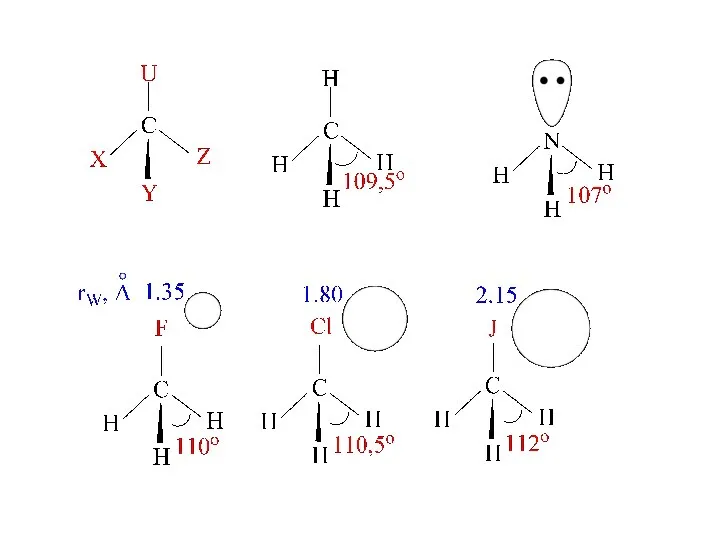
- 7. Правило Бента: В соединениях углерода и некоторых других элементов 2-ого периода s-характер концентрируется преимущест-венно в направлении
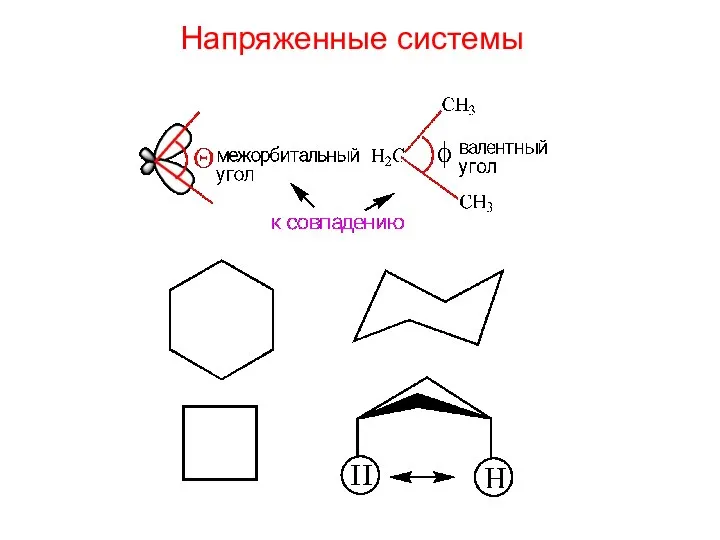
- 8. Напряженные системы
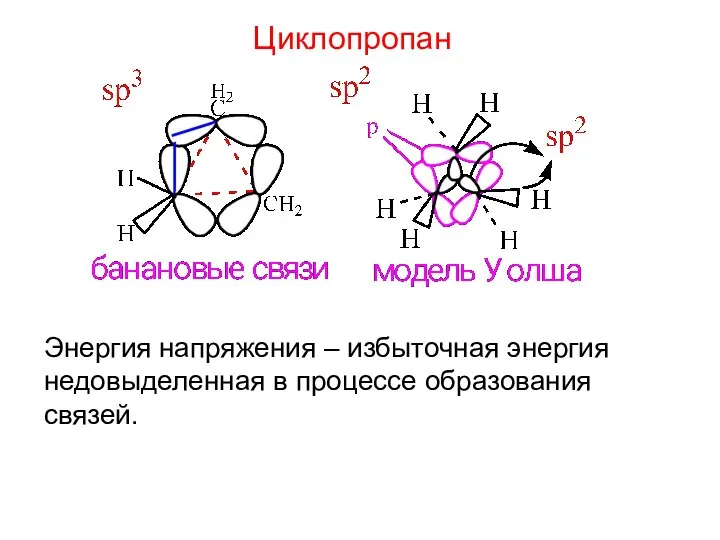
- 9. Циклопропан Энергия напряжения – избыточная энергия недовыделенная в процессе образования связей.
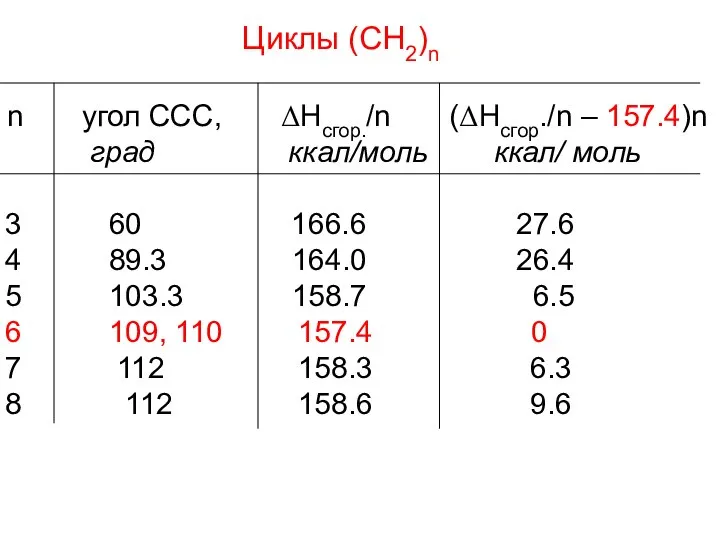
- 10. Циклы (СН2)n n угол ССС, ΔHсгор./n (ΔHсгор./n – 157.4)n град ккал/моль ккал/ моль 60 166.6 27.6
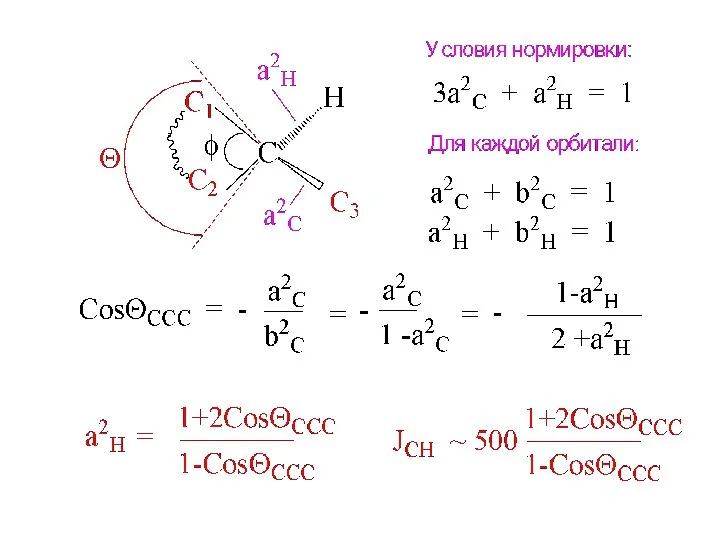
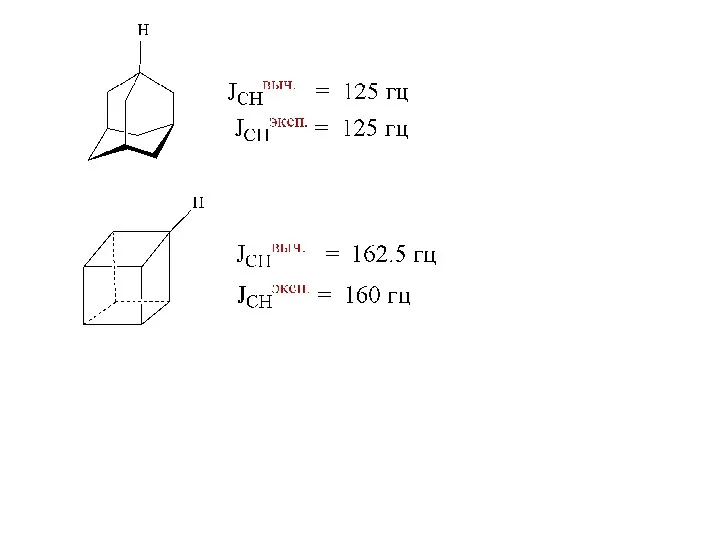
- 11. JC13 ~ (Bh2/ΔE) a2H ~ 500a2H h2 - полярность связи С-Н ΔE - энергия возбуждения связи
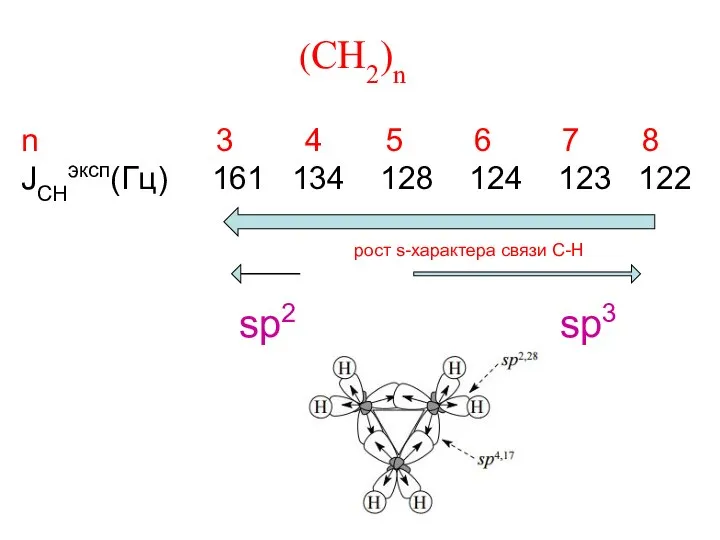
- 12. (CH2)n n 3 4 5 6 7 8 JCHэксп(Гц) 161 134 128 124 123 122 рост
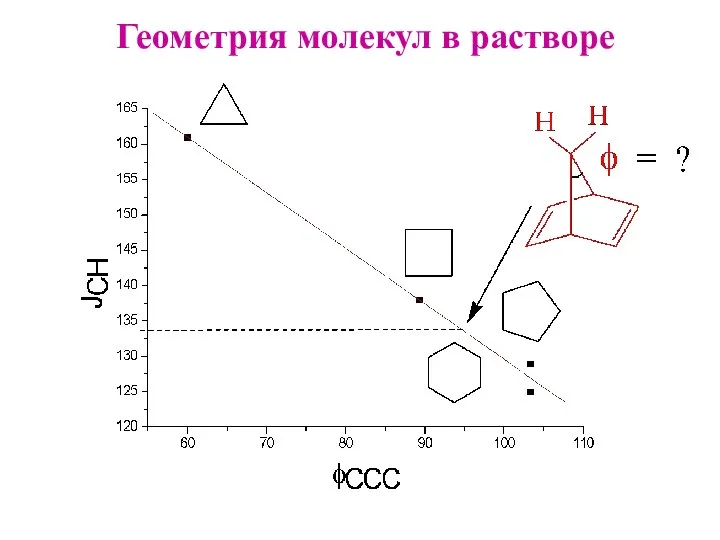
- 13. Геометрия молекул в растворе
- 16. Метод Молекулярных Орбиталей Хюккеля
- 17. МО ЛКАО в варианте Хюккеля был разработан для расчета ненасыщенных углеводородов, обладающих системой сопряженных двойных связей.
- 18. Метод Хюккеля допускает следующие приближения: 1. Интегралы перекрывания для АО, относящихся к соседним атомам, считаются равными
- 19. Резонансный интеграл – это отрицательная величина, равная энергии заряда, распределенного с плотностью φμφν в поле ядер,
- 20. Решая уравнения, полученные при раскрытии детерминанта , получим значений для энергии, выше и ниже нулевого значения.
- 21. Коэффициенты «С» определим из условия нормировки:
- 22. Функция ψ1 характеризуется более низкой энергией электрона, чем в изолированном атоме углерода ( величина α в
- 23. Для молекулы бутадиена в приближении Хюккеля получим вековое уравнение 4-ого порядка: Разложив детерминант по минорам, получим
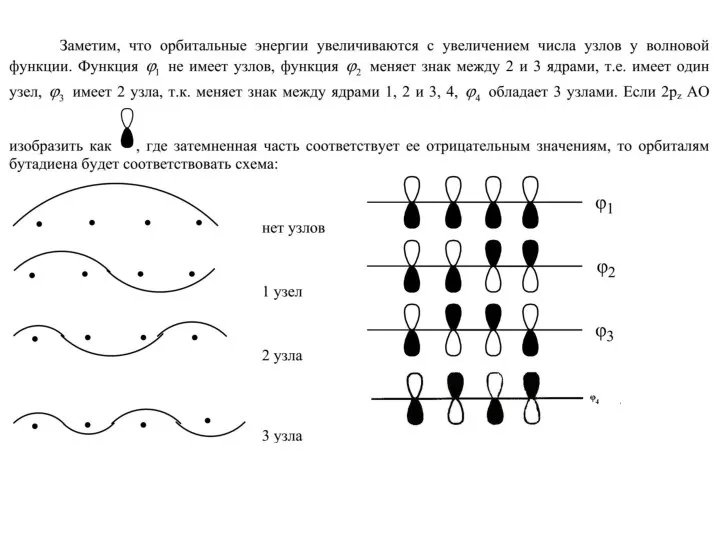
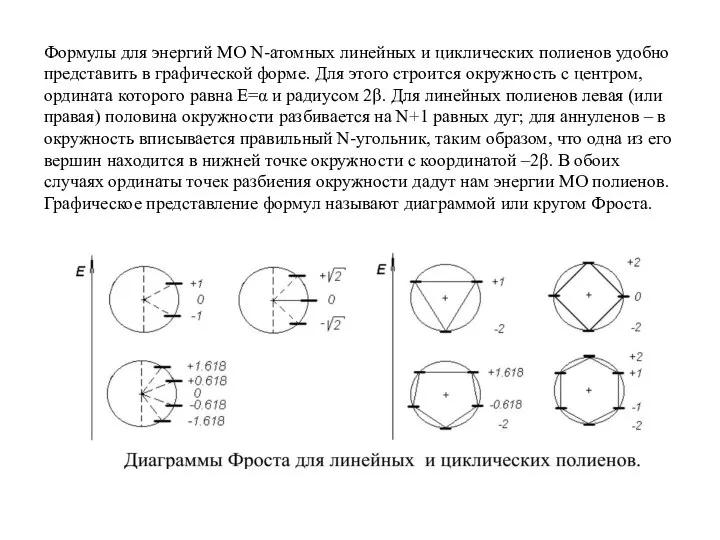
- 25. Формулы для энергий МО N-атомных линейных и циклических полиенов удобно представить в графической форме. Для этого
- 26. В приближении МО ЛКАО распределение электронной плотности вблизи ядер характеризуется электронной плотностью (зарядом) на атоме, а
- 28. Скачать презентацию









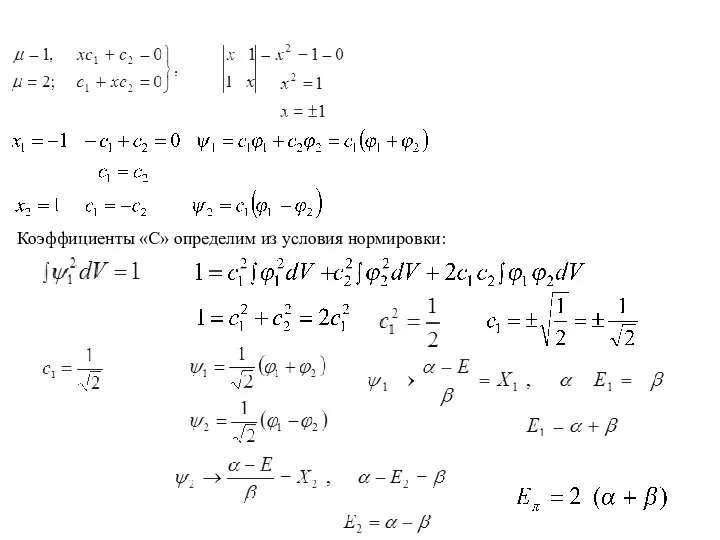



 Пилинг фруктовыми кислотами
Пилинг фруктовыми кислотами Химическое равновесие
Химическое равновесие Основные понятия и законы химии
Основные понятия и законы химии Место антацидов в современных схемах лечения кислотозависимых заболеваний
Место антацидов в современных схемах лечения кислотозависимых заболеваний Витамины алифатического ряда, пангамовая и пантотеновая кислоты. Витамины алициклического ряда, витамины А и D. (Тема 3)
Витамины алифатического ряда, пангамовая и пантотеновая кислоты. Витамины алициклического ряда, витамины А и D. (Тема 3) Презентация по Химии "Викторина для любителей и знатков химии" - скачать смотреть
Презентация по Химии "Викторина для любителей и знатков химии" - скачать смотреть  Горечи. Лекция 3
Горечи. Лекция 3 Зачем нам нужно стекло
Зачем нам нужно стекло Химическая связь и строение молекул
Химическая связь и строение молекул Презентация по Химии "Химия элементов VIB подгруппы Cr, Mo, W" - скачать смотреть
Презентация по Химии "Химия элементов VIB подгруппы Cr, Mo, W" - скачать смотреть 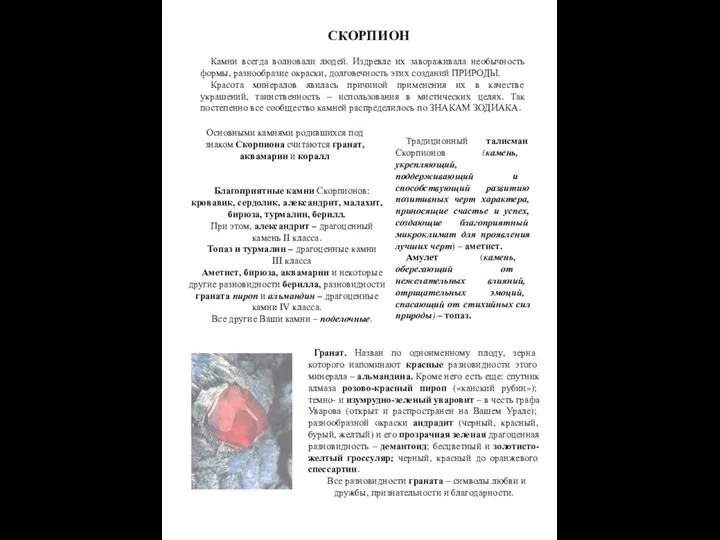 Камни и Скорпион
Камни и Скорпион Презентация по Химии "Вплив побутової хімії на здоров'я людини" - скачать смотреть бесплатно
Презентация по Химии "Вплив побутової хімії на здоров'я людини" - скачать смотреть бесплатно Строение, свойства, биологическая роль нуклеотидов. (Лекция 5)
Строение, свойства, биологическая роль нуклеотидов. (Лекция 5) Виды пластика, что производят и что можно переработать
Виды пластика, что производят и что можно переработать Презентация по Химии "Строение атома" - скачать смотреть
Презентация по Химии "Строение атома" - скачать смотреть  Презентация по Химии "Водорастворимый упаковочный материал" - скачать смотреть
Презентация по Химии "Водорастворимый упаковочный материал" - скачать смотреть  Электрохимия. Физико –химические свойства ионных систем. (Лекция 13)
Электрохимия. Физико –химические свойства ионных систем. (Лекция 13) Органические вещества
Органические вещества Woda jako rozpuszczalnik
Woda jako rozpuszczalnik Тема 10: Комплексные соединения Занятие 1: Комплексные соединения
Тема 10: Комплексные соединения Занятие 1: Комплексные соединения Металлы в нашей жизни
Металлы в нашей жизни Испытания на подлинность препаратов органической природы
Испытания на подлинность препаратов органической природы Углеводы. Классификация
Углеводы. Классификация Крахмал и целлюлоза
Крахмал и целлюлоза Аттестационная работа. Групповой урочный проект Кислородсодержащие органические вещества
Аттестационная работа. Групповой урочный проект Кислородсодержащие органические вещества Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные
Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные Химическая термодинамика
Химическая термодинамика Основы кристаллографии
Основы кристаллографии