Содержание
- 3. Более плотная фаза (определяющая форму поверхности) называется адсорбентым (обычно адсорбент это твердая или жидкая фаза) Вещество
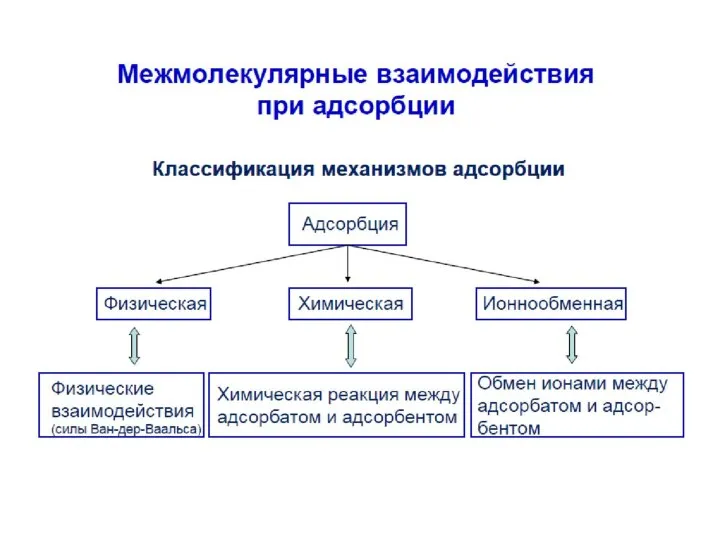
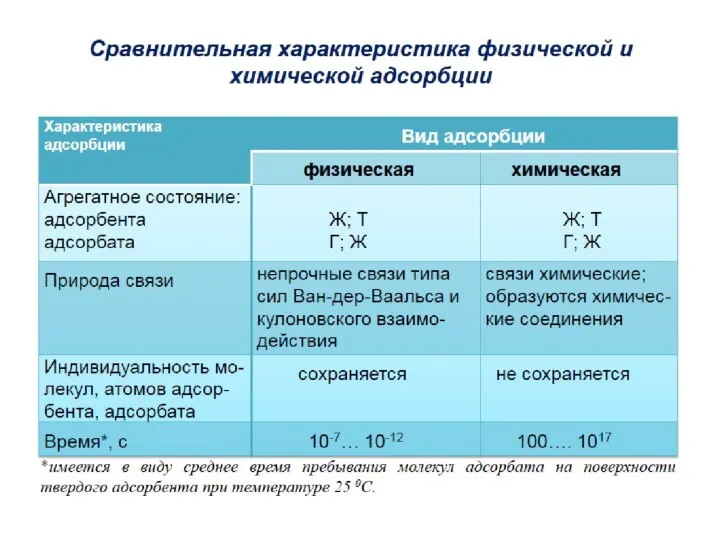
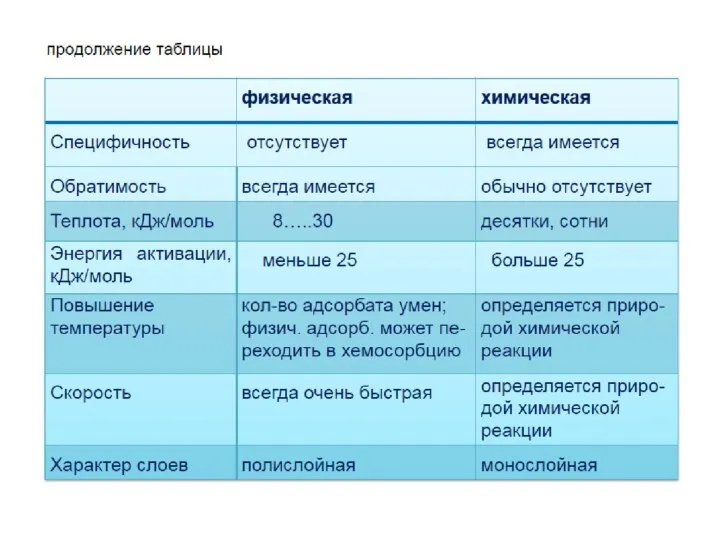
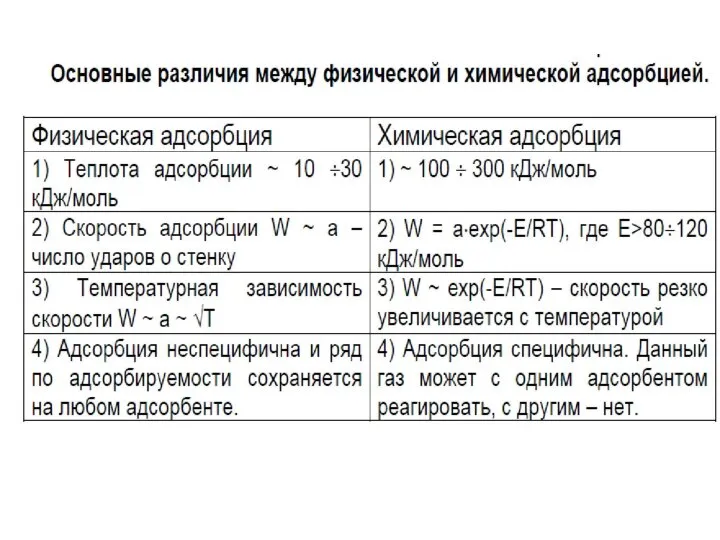
- 4. Адсорбция может происходить на любой поверхности раздела между фазами. В зависимости от агрегатного состояния смежных фаз
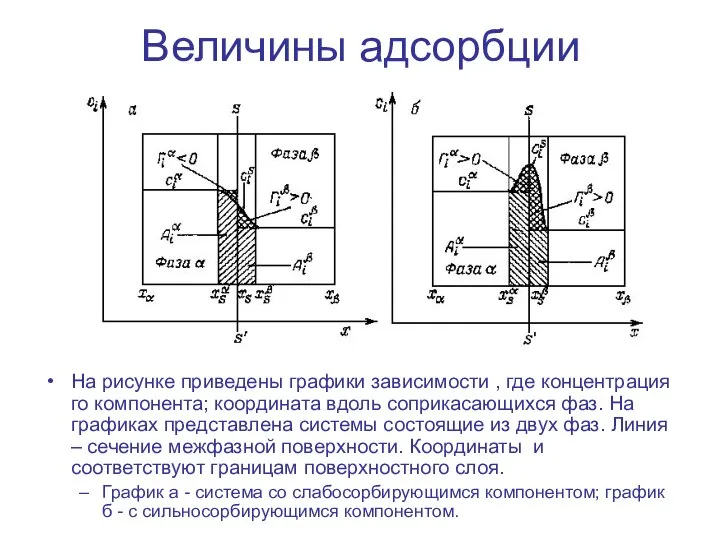
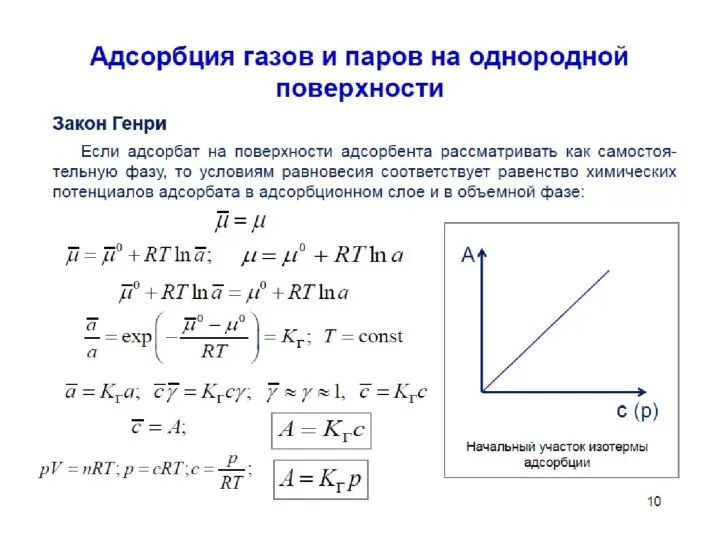
- 11. Величины адсорбции На рисунке приведены графики зависимости , где концентрация го компонента; координата вдоль соприкасающихся фаз.
- 12. Рассмотрим объединенное уравнение I и II законов термодинамики в открытой системе с учетом энергии поверхностного натяжения
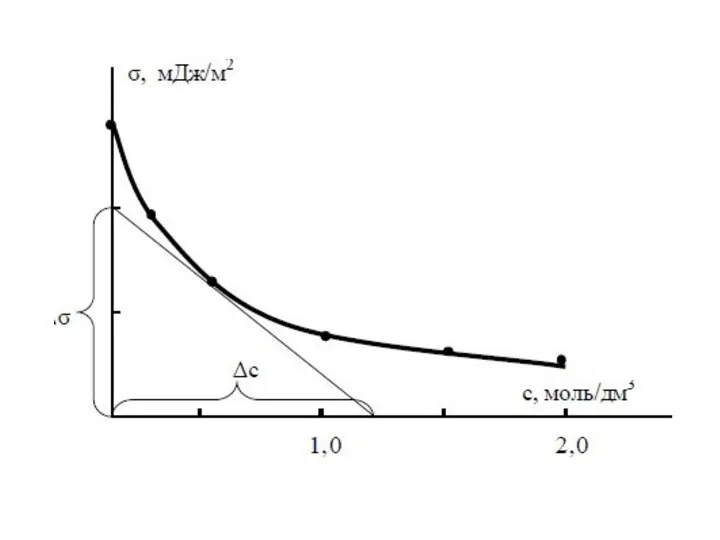
- 13. В случае получим выражение Учитывая, что Получим фундаментальное адсорбционное уравнение Гиббса: Зависимость поверхностного натяжения от адсорбции
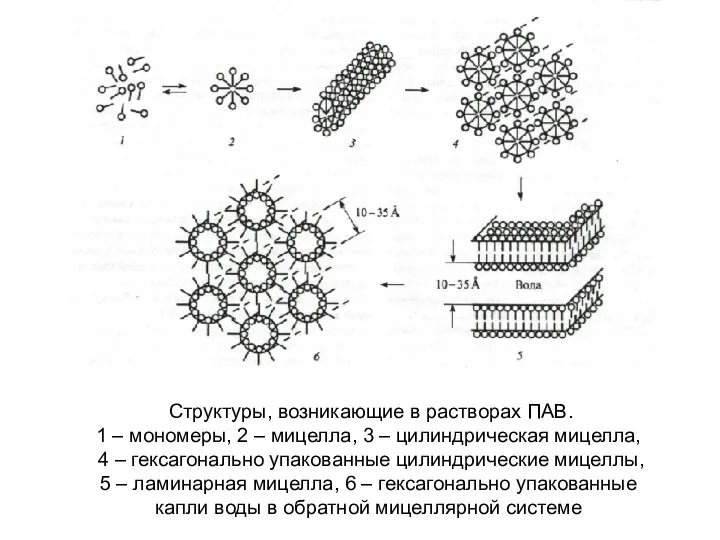
- 27. Структуры, возникающие в растворах ПАВ. 1 – мономеры, 2 – мицелла, 3 – цилиндрическая мицелла, 4
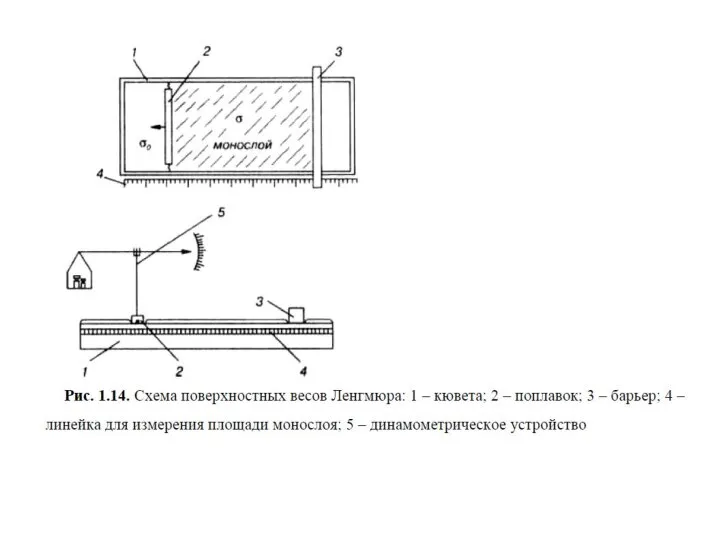
- 28. Весы Ленгмюра
- 32. При адсорбции или растекании вещества на поверхности образуется поверхностная (адсорбционная) пленка этого вещества. Уравнение изотермы поверхностного
- 33. Введем обозначения: или если разделить на число Авогадро площадь приходящаяся в поверхностном слое на одну молекулу
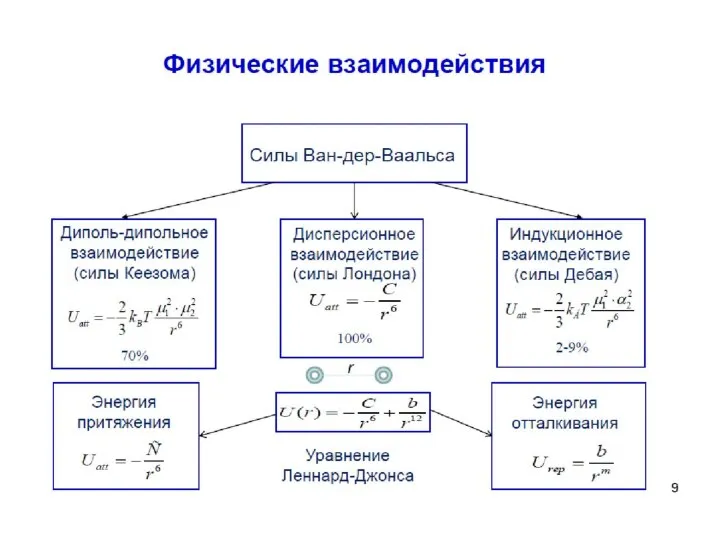
- 34. В ряде случаев можно применять уравнение аналогичное уравнению Ван-дер-Ваальса В котором константа а характеризует силы взаимного
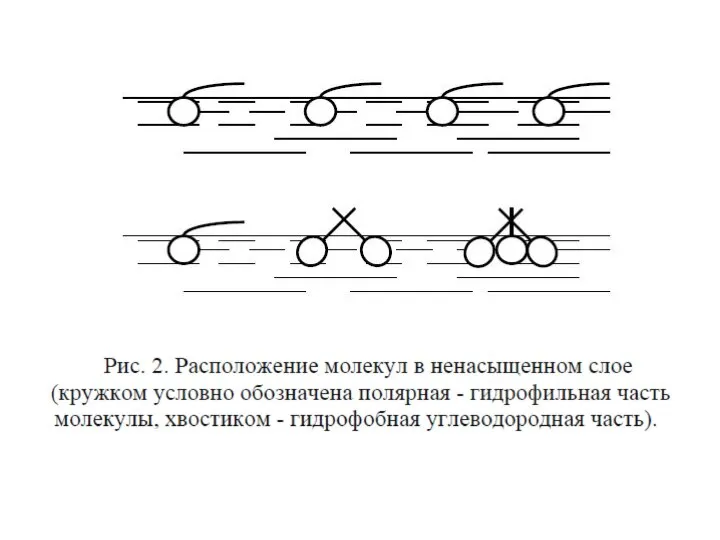
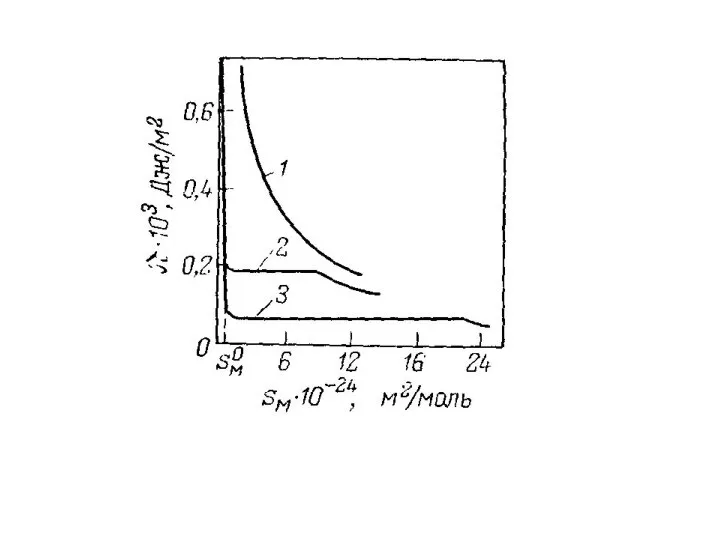
- 35. При небольшой концентрации амфифильного соединения мономолекулярный слой на поверхности не является сплошным. Молекулы практически не взаимодействуют
- 36. При уменьшении площади с помощью плавучего барьера молекулы сблизятся, но будут все еще хаотически ориентированы. Такую
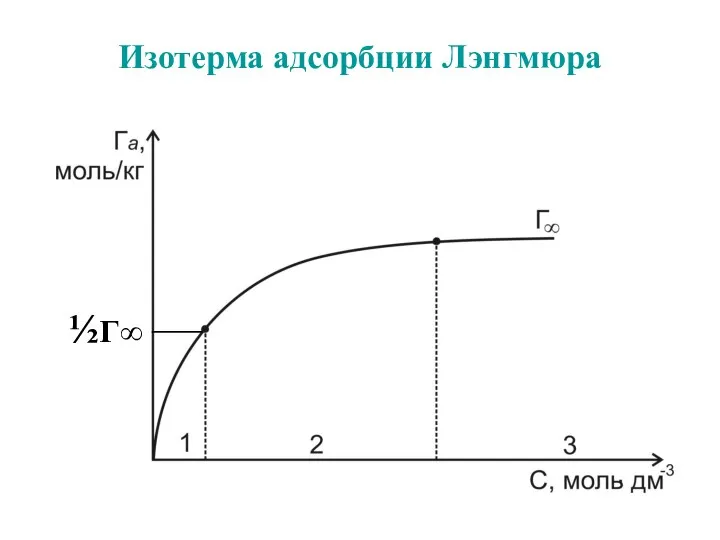
- 48. Изотерма адсорбции Лэнгмюра ½Г∞
- 49. Уравнение Ленгмюра в линейной форме
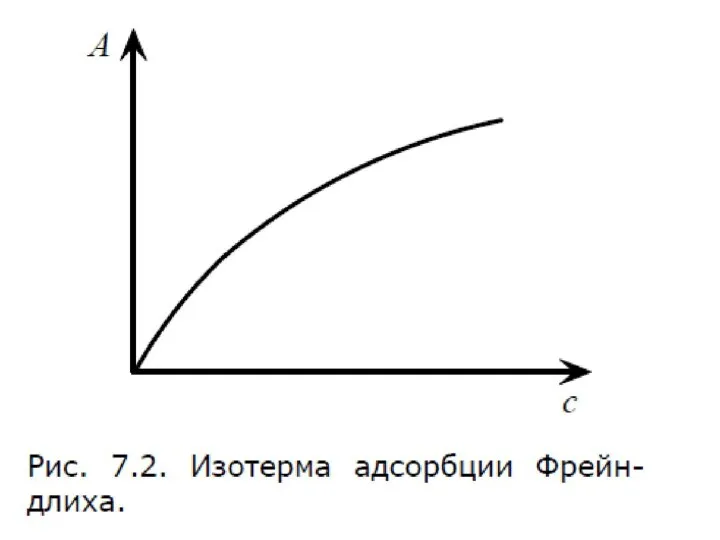
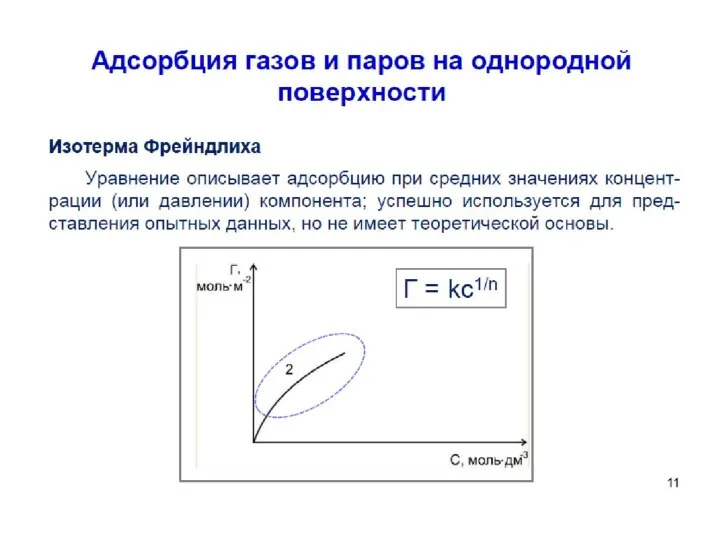
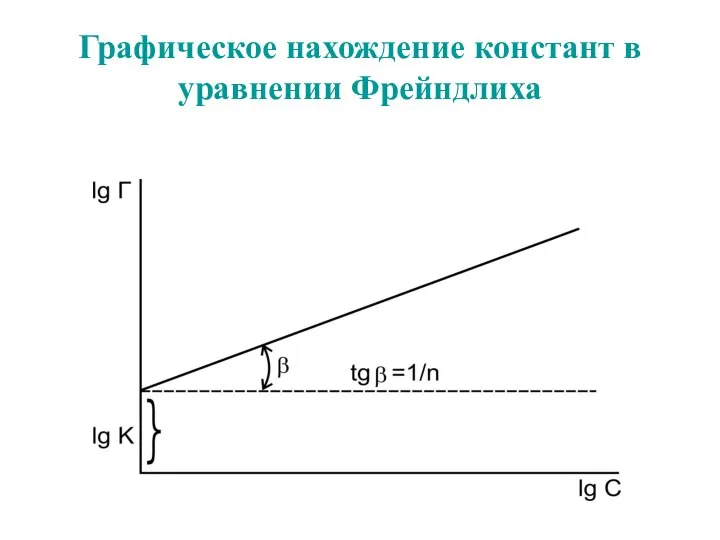
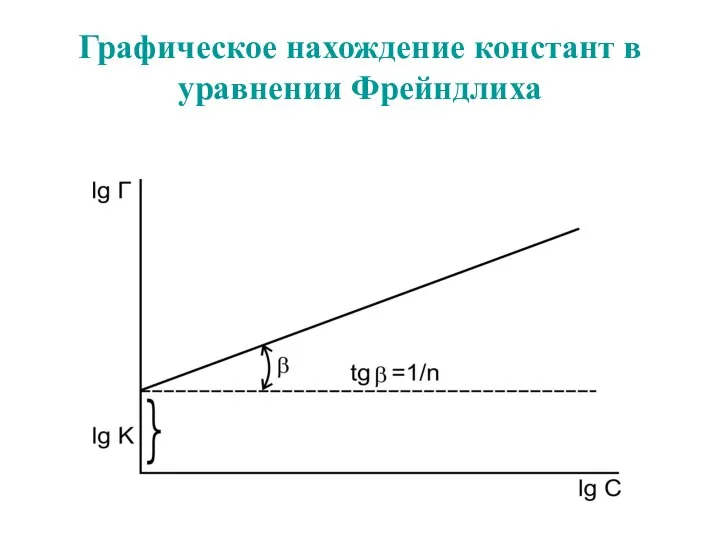
- 54. Уравнение Фрейндлиха. К, 1/n – эмпирические постоянные, т.е. на основе экспериментальных данных; С – равновесная концентрация
- 57. Уравнение Фрейндлиха. К, 1/n – эмпирические постоянные, т.е. на основе экспериментальных данных; С – равновесная концентрация
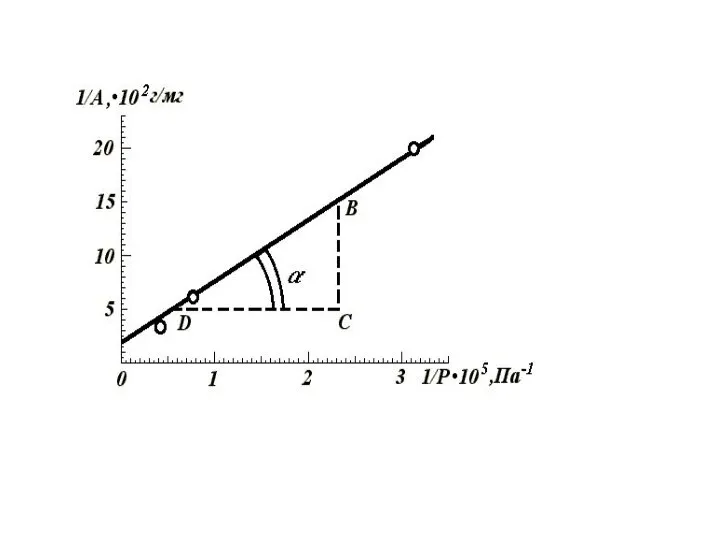
- 59. Графическое нахождение констант в уравнении Фрейндлиха
- 62. Графическое нахождение констант в уравнении Фрейндлиха
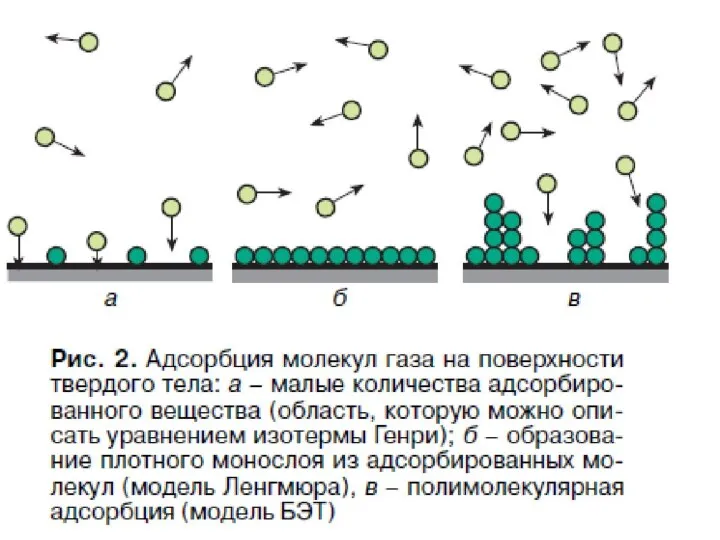
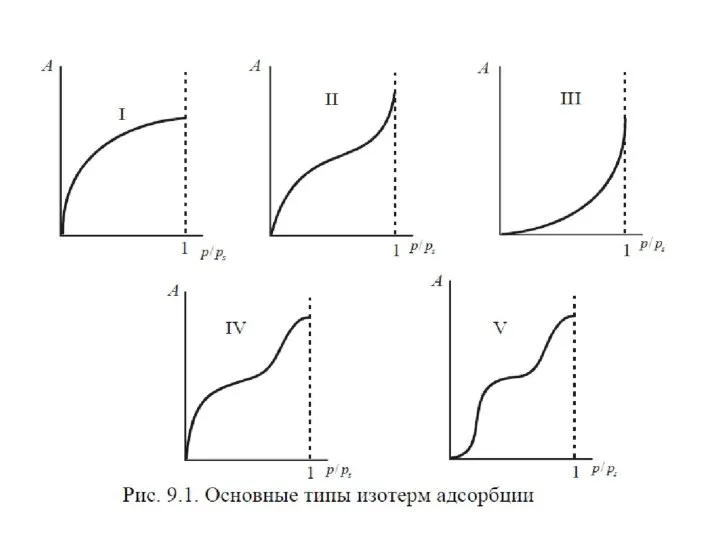
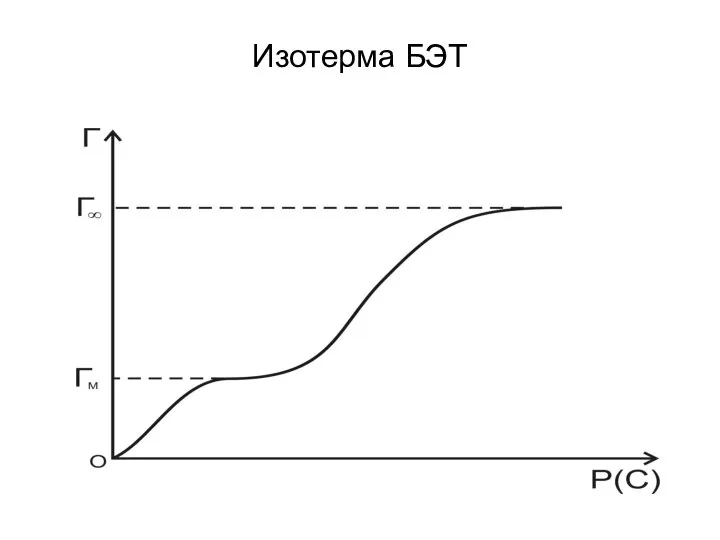
- 75. Изотерма БЭТ
- 77. С уменьшением давления уравнение БЭТ переходит в уравнение мономолекулярной адсорбции Ленгмюра. При
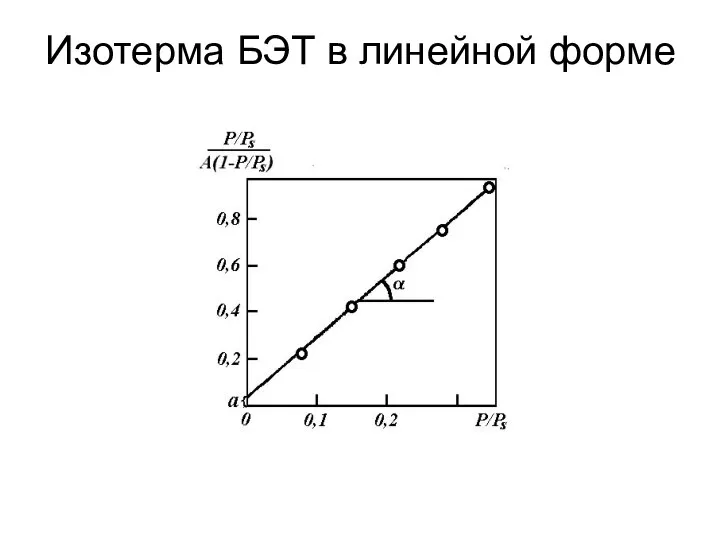
- 78. Изотерма БЭТ в линейной форме
- 83. Скачать презентацию


























































 Арены. Бензол. Среди 22 миллионов органических соединений немного найдется таких , которые оказали на развитие органической химии
Арены. Бензол. Среди 22 миллионов органических соединений немного найдется таких , которые оказали на развитие органической химии  Простые вещества – металлы. Общие физические свойства металлов.
Простые вещества – металлы. Общие физические свойства металлов.  Алюминий - презентация скачать
Алюминий - презентация скачать  Радиоактивные превращения . Закон радиоактивного распада.
Радиоактивные превращения . Закон радиоактивного распада. Інсектициди для захисту сливи та персеку
Інсектициди для захисту сливи та персеку ОКСИДЫ АЗОТА.
ОКСИДЫ АЗОТА. Металлы. Разнообразие металлов
Металлы. Разнообразие металлов Mendel and the Gene Idea
Mendel and the Gene Idea Презентация по Химии "Кальций" - скачать смотреть
Презентация по Химии "Кальций" - скачать смотреть  Студент − это не сосуд, который надо наполнить, а факел, который надо зажечь Л. Арцимович
Студент − это не сосуд, который надо наполнить, а факел, который надо зажечь Л. Арцимович Химия неметаллов
Химия неметаллов Углеводы
Углеводы Гликоген(C6H10O5)n, полисахарид, образованный остатками глюкозы
Гликоген(C6H10O5)n, полисахарид, образованный остатками глюкозы Linear form of polyphenylsilsesquioxanes
Linear form of polyphenylsilsesquioxanes Защита населения от воздействия аварийно химически опасных веществ
Защита населения от воздействия аварийно химически опасных веществ Комплексні сполуки
Комплексні сполуки  Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Основы органической химии
Основы органической химии Гидроксилпроизводные углеводородов
Гидроксилпроизводные углеводородов Рефрактометрия как экспресс-метод определения лекарственных средств
Рефрактометрия как экспресс-метод определения лекарственных средств Загальна характеристика гормонів
Загальна характеристика гормонів Измерительные приборы.
Измерительные приборы.  Общие понятия и определения опасных химических веществ. Модуль 1.1
Общие понятия и определения опасных химических веществ. Модуль 1.1 Биогенные элементы. Классификация. Топография биогенных элементов в организме человека
Биогенные элементы. Классификация. Топография биогенных элементов в организме человека Классификация автомобильных масел
Классификация автомобильных масел Periodic Table of the Elements
Periodic Table of the Elements Introduction in bioorganic chemistry. Isomerism and structure of organic compounds
Introduction in bioorganic chemistry. Isomerism and structure of organic compounds Общая характеристика ферментов как биологических катализаторов
Общая характеристика ферментов как биологических катализаторов