Содержание
- 2. 1. Будова молекули етену: структурна та електронна. Поняття про подвійний зв’язок. 2. Фізичні та хімічні властивості
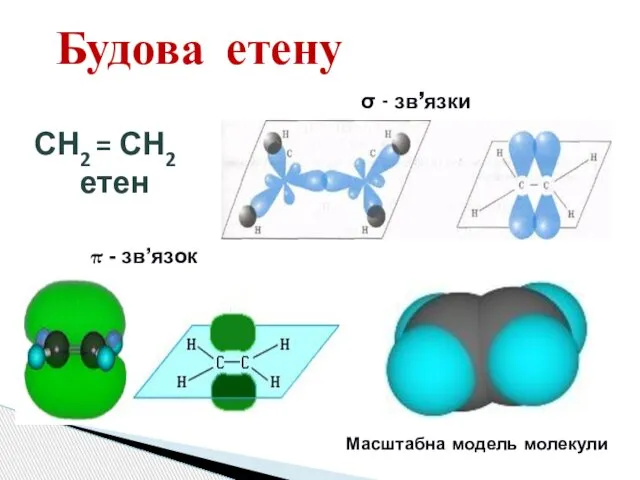
- 3. Будова етену СН2 = СН2 етен σ - зв’язки π - зв’язок Масштабна модель молекули
- 4. Фізичні властивості етену С2Н4 безбарвний газ; погано розчинний у воді, але добре розчинний в органічних розчинниках;
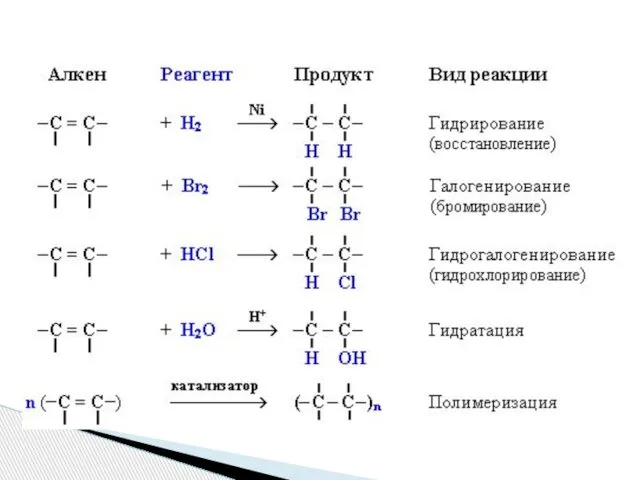
- 5. Хімічні властивості етену 1. Горіння (з виділенням великої кількості теплоти): С2Н4 + 3O2 → 2СО2↑+2Н2О Реакції
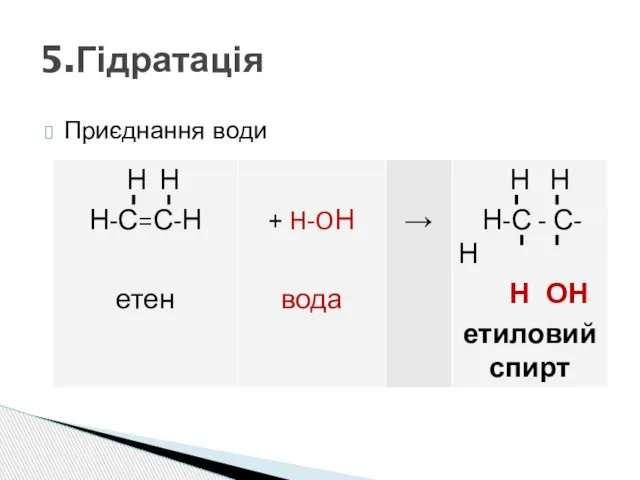
- 6. 5.Гідратація Приєднання води
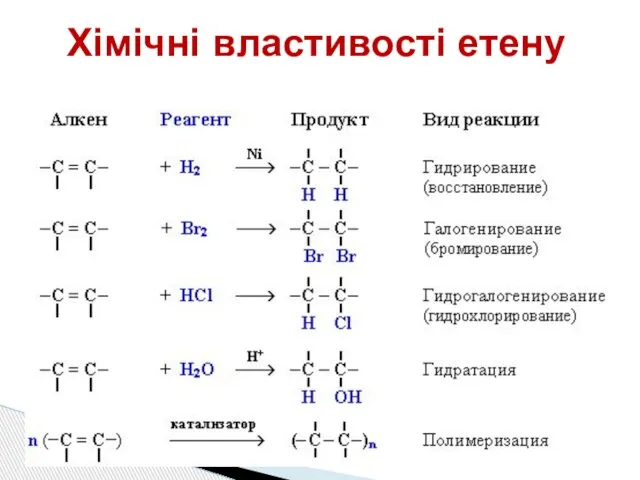
- 7. Хімічні властивості етену
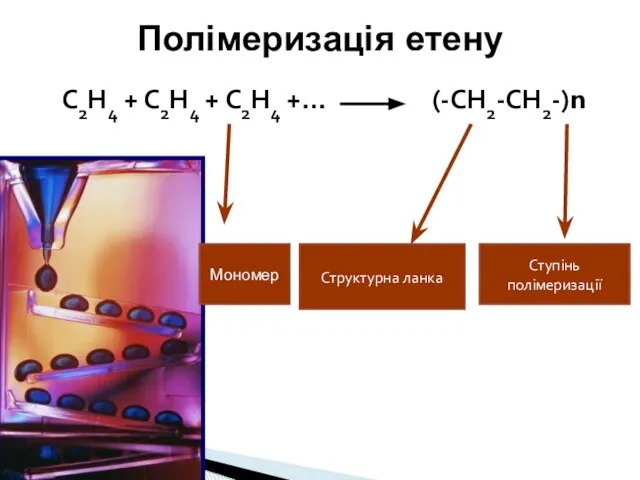
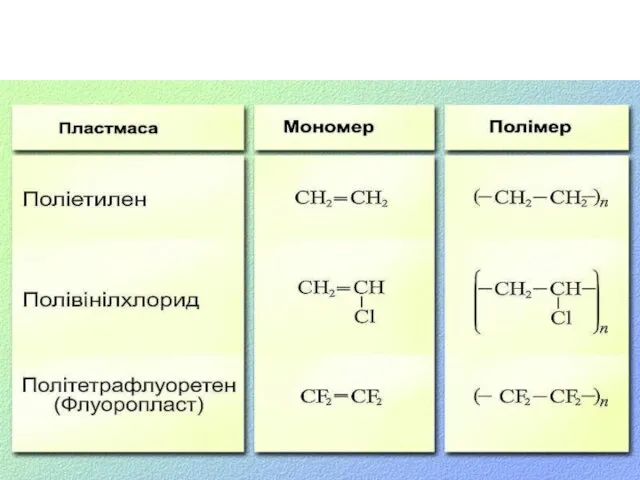
- 8. Полімеризація етену С2Н4 + С2Н4 + С2Н4 +… (-СН2-СН2-)n Структурна ланка Ступінь полімеризації Мономер
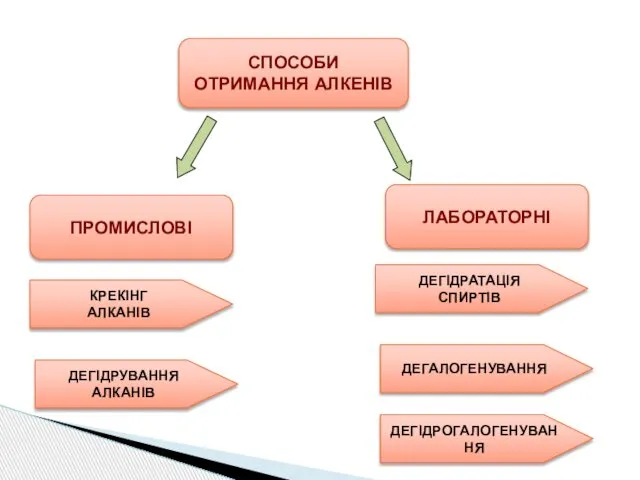
- 10. ПРОМИСЛОВІ СПОСОБИ ОТРИМАННЯ АЛКЕНІВ ЛАБОРАТОРНІ КРЕКІНГ АЛКАНІВ ДЕГІДРУВАННЯ АЛКАНІВ ДЕГІДРАТАЦІЯ СПИРТІВ ДЕГАЛОГЕНУВАННЯ ДЕГІДРОГАЛОГЕНУВАННЯ
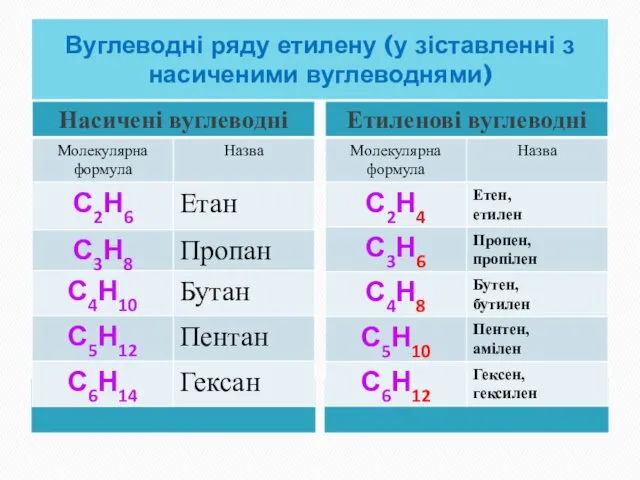
- 15. Вуглеводні ряду етилену (у зіставленні з насиченими вуглеводнями)
- 16. Фізичні властивості АЛКЕНІВ Алкени погано розчиняються у воді, але добре в органічних розчинниках. Із зростанням карбонового
- 18. 4.Гідрогенгалогенування Правило Марковнікова Російський хімік-органік. Атом Гідрогену приєднується до найбільш гідрогенізованого атома Карбону, а атом галогену
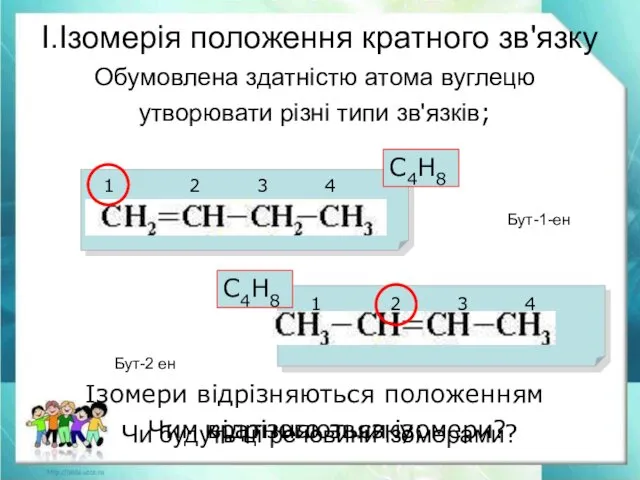
- 19. Обумовлена здатністю атома вуглецю утворювати різні типи зв'язків; І.Ізомерія положення кратного зв'язку С4Н8 С4Н8 Чи будуть
- 20. ІІ. Ізомерія карбонового скелета 5 4 3 2 1 СН3─ СН2─ СН─ СН= СН2 1 2
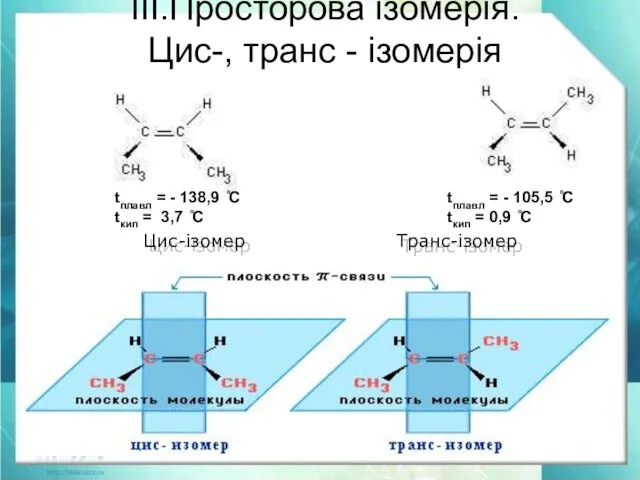
- 21. ІІІ.Просторова ізомерія. Цис-, транс - ізомерія Цис-ізомер Транс-ізомер tплавл = - 138,9 ̊С tкип = 3,7
- 23. Скачать презентацию









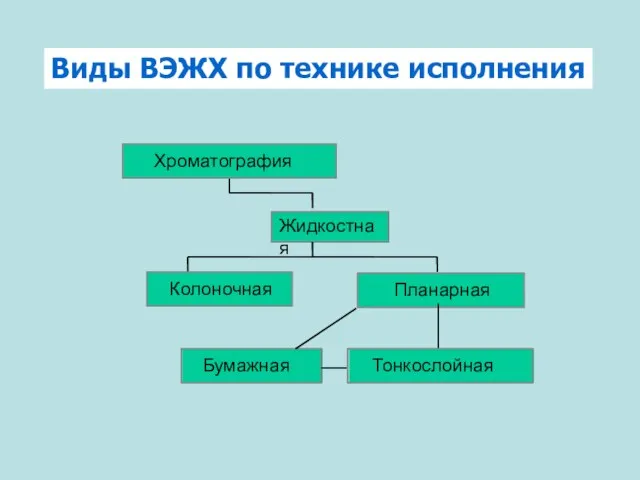 Виды ВЭЖХ по технике исполнения
Виды ВЭЖХ по технике исполнения Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про
Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про Морфология почв
Морфология почв Генетическая связь между классами веществ
Генетическая связь между классами веществ Механизм старения масел
Механизм старения масел Правила безпечного використання засобів побутової хімії.
Правила безпечного використання засобів побутової хімії.  Способы и системы культивирования микроорганизмов. (Тема 3)
Способы и системы культивирования микроорганизмов. (Тема 3) Углеводы. Строение углеводов
Углеводы. Строение углеводов Исследовательская работа. На тему: « Исследование цитрусовых»
Исследовательская работа. На тему: « Исследование цитрусовых» Некрохмалисті полісахариди
Некрохмалисті полісахариди Массообменные процессы
Массообменные процессы Биохимия крови. (Лекция 9)
Биохимия крови. (Лекция 9) Phosphorus
Phosphorus Введение. Виды стекол. Применение конструкций из стекла
Введение. Виды стекол. Применение конструкций из стекла Горючие полезные ископаемые, топливно-энергетические ресурсы
Горючие полезные ископаемые, топливно-энергетические ресурсы Базальты. Классификация основных пород
Базальты. Классификация основных пород Кузнецова Кристина, Матвеева Настя, Савина Марина 10 класс
Кузнецова Кристина, Матвеева Настя, Савина Марина 10 класс  Аппараты основных химических производств
Аппараты основных химических производств Полимерные материалы
Полимерные материалы Презентация по Химии "История развития химии" - скачать смотреть
Презентация по Химии "История развития химии" - скачать смотреть  Химические реакции органических соединений
Химические реакции органических соединений Экологическое образование в школьном курсе неорганической химии
Экологическое образование в школьном курсе неорганической химии Аминокислоты. Белки
Аминокислоты. Белки Linear form of polyphenylsilsesquioxanes
Linear form of polyphenylsilsesquioxanes Виконала: Учениця 11-Б класу Санницька Юля Хімічний та фізичний склад та використання нафти
Виконала: Учениця 11-Б класу Санницька Юля Хімічний та фізичний склад та використання нафти  Избранные главы органической стереохимии
Избранные главы органической стереохимии Растворы. Определения и понятия
Растворы. Определения и понятия Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов