Содержание
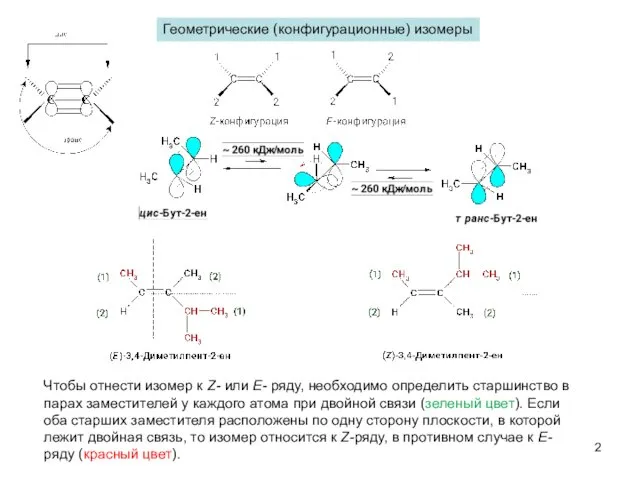
- 2. Геометрические (конфигурационные) изомеры Чтобы отнести изомер к Z- или Е- ряду, необходимо определить старшинство в парах
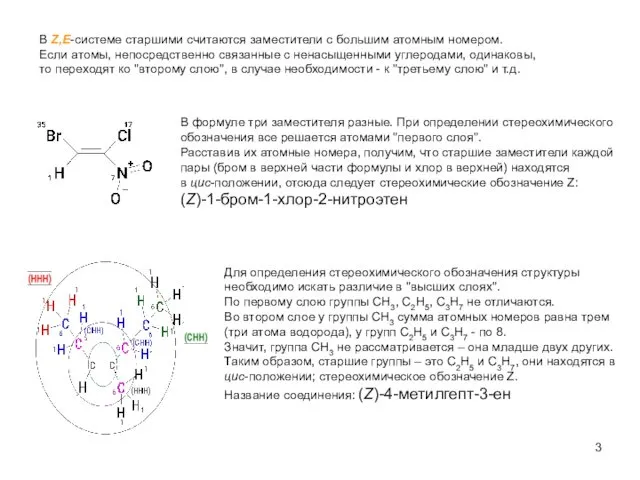
- 3. Для определения стереохимического обозначения структуры необходимо искать различие в "высших слоях". По первому слою группы СН3,
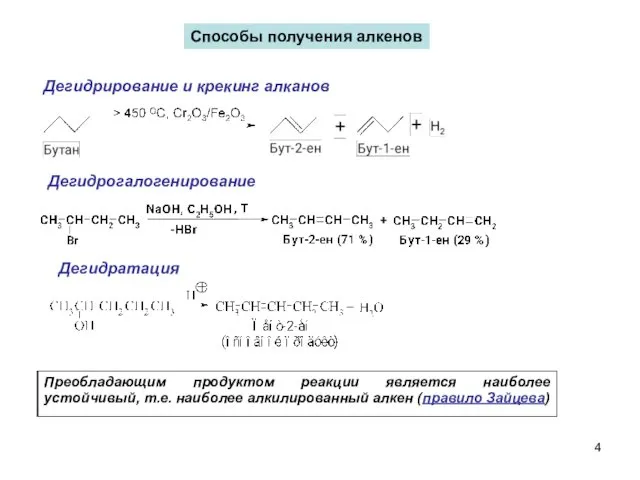
- 4. Способы получения алкенов Дегидрогалогенирование Дегидратация Дегидрирование и крекинг алканов
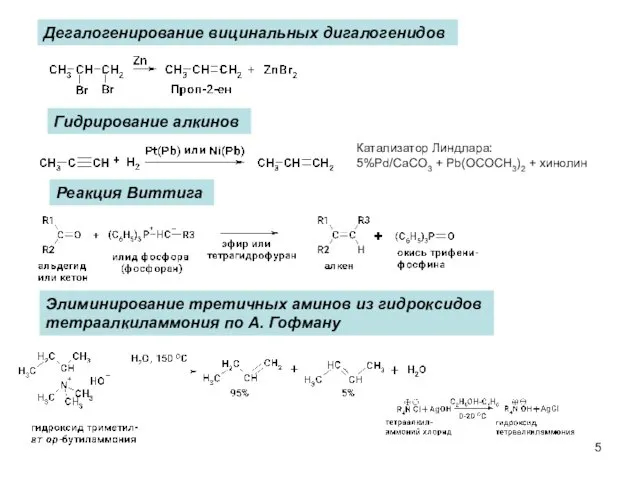
- 5. Дегалогенирование вицинальных дигалогенидов Гидрирование алкинов Катализатор Линдлара: 5%Pd/CaCO3 + Pb(OCOCH3)2 + хинолин Реакция Виттига Элиминирование третичных
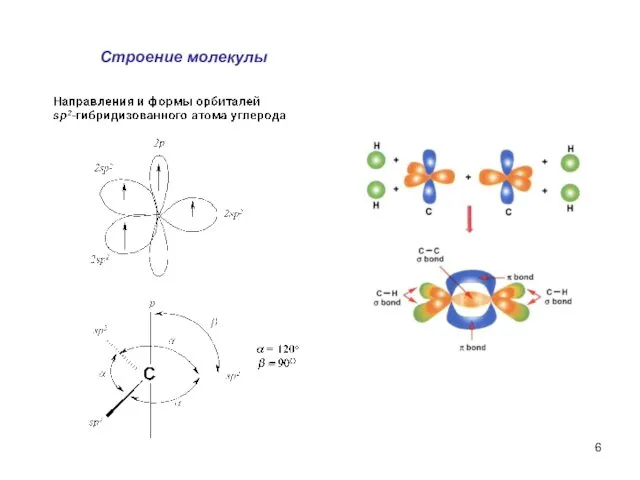
- 6. Строение молекулы
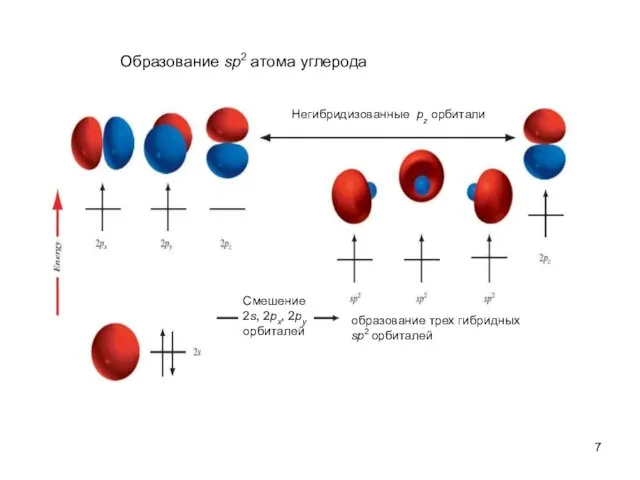
- 7. Негибридизованные pz орбитали Смешение 2s, 2px, 2py орбиталей Образование sp2 атома углерода образование трех гибридных sp2
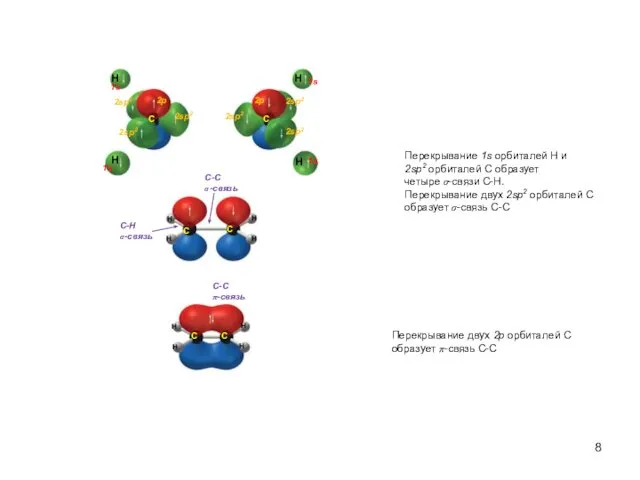
- 8. H H H H H H H H C C C C C C H H
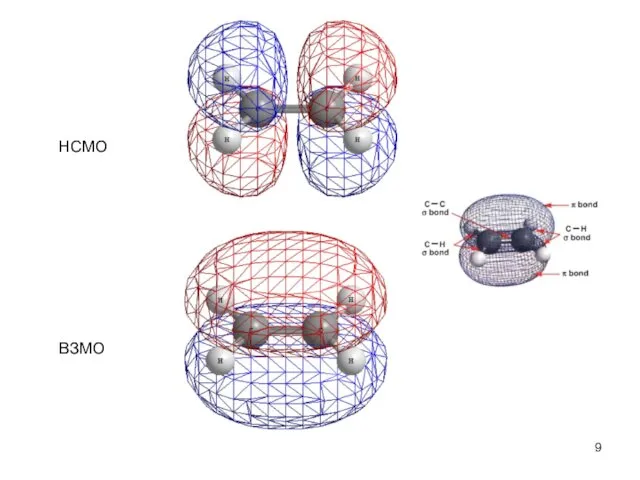
- 9. НСМО ВЗМО
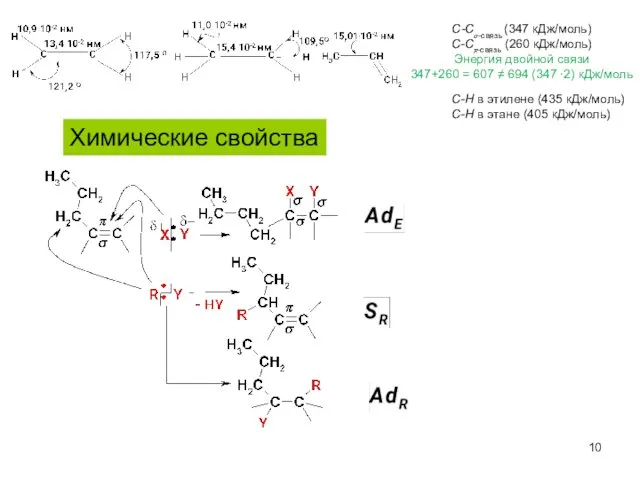
- 10. Химические свойства С-Сσ-связь (347 кДж/моль) С-Сπ-связь (260 кДж/моль) Энергия двойной связи 347+260 = 607 ≠ 694
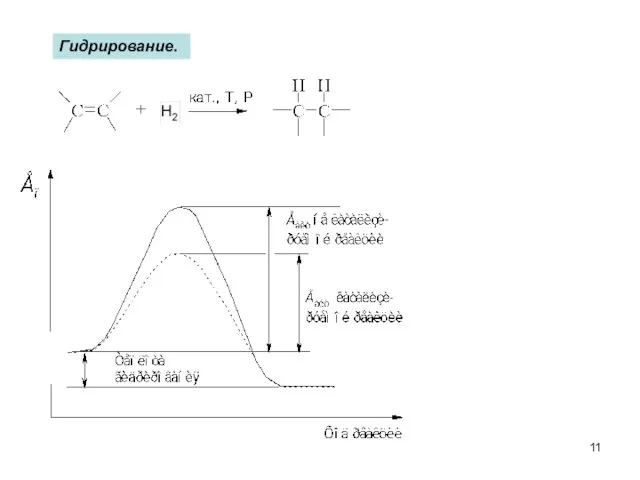
- 11. Гидрирование.
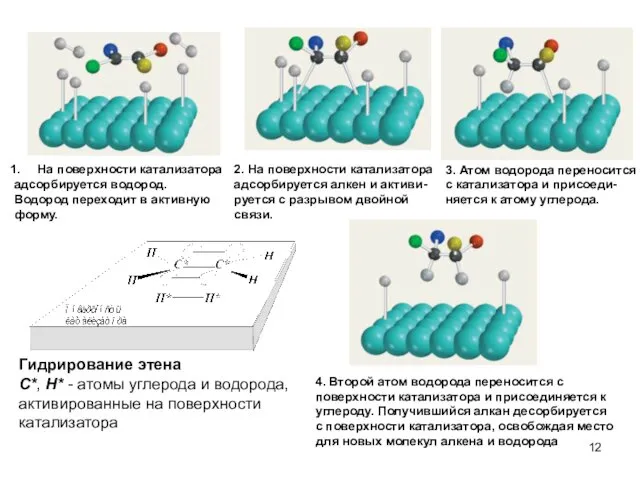
- 12. Гидрирование этена С*, H* - атомы углерода и водорода, активированные на поверхности катализатора На поверхности катализатора
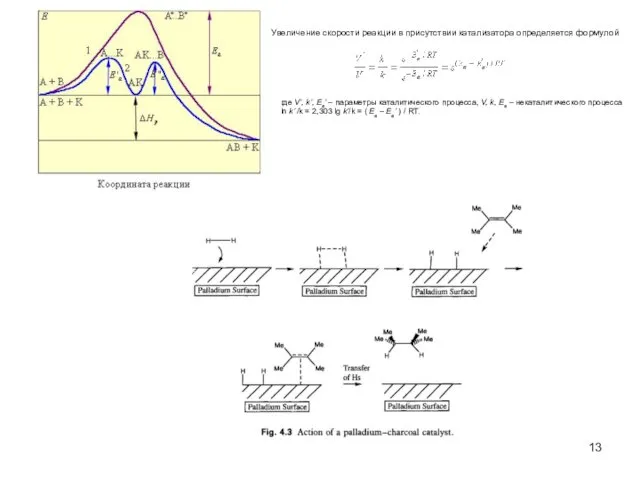
- 13. Увеличение скорости реакции в присутствии катализатора определяется формулой где V’, k’, Ea’ – параметры каталитического процесса,
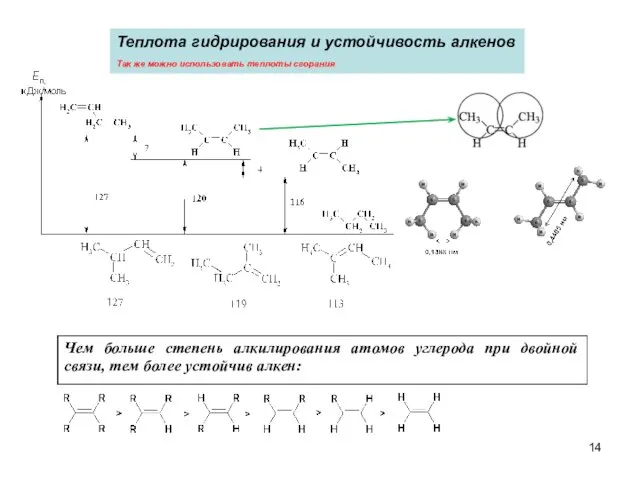
- 14. Теплота гидрирования и устойчивость алкенов Так же можно использовать теплоты сгорания
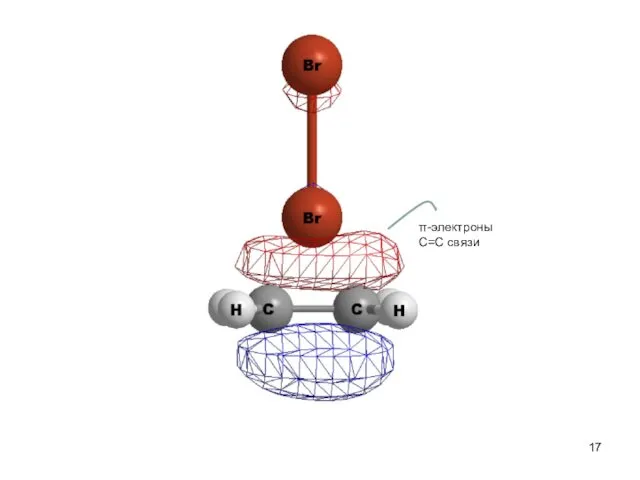
- 16. Присоединение галогенов Механизм реакции AdE Первая стадия. v=k’ [алкен] [Br2] +k’’[алкен] [Br2]2 + k’’’[алкен] [Br2] [Br-]
- 17. δ+ δ− π π-электроны С=С связи
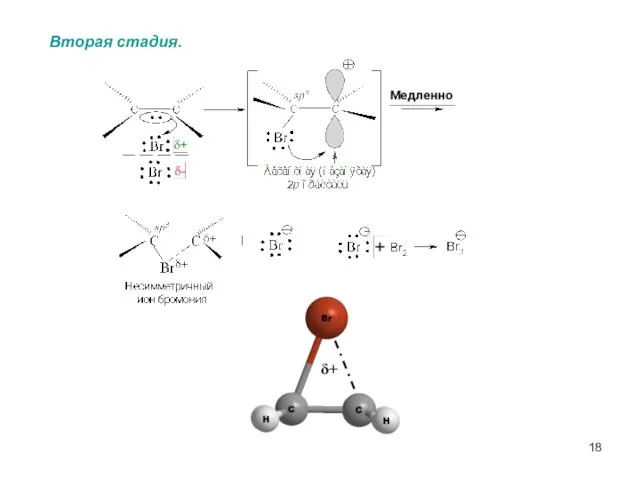
- 18. Вторая стадия. δ+
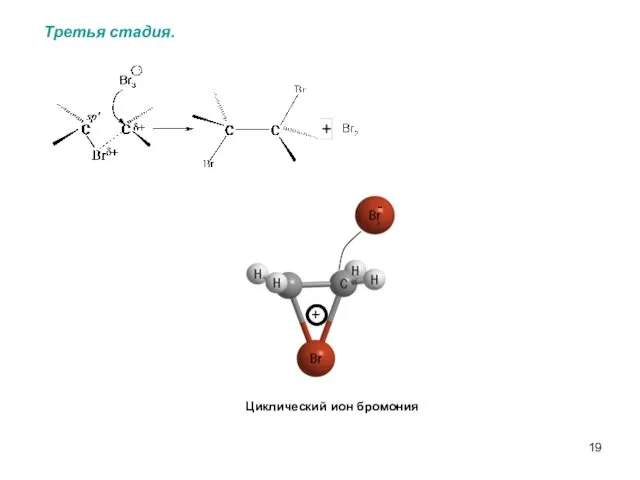
- 19. Третья стадия. Циклический ион бромония
- 21. Стереоспецифическим называется процесс, в котором орбразуется только один из возможных стереоизомеров. Стереоселективным называется процесс, в котором
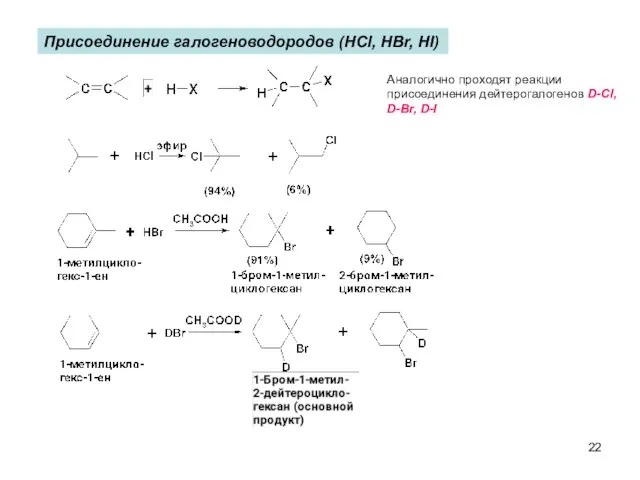
- 22. Присоединение галогеноводородов (HCl, HBr, HI) Аналогично проходят реакции присоединения дейтерогалогенов D-Cl, D-Br, D-I
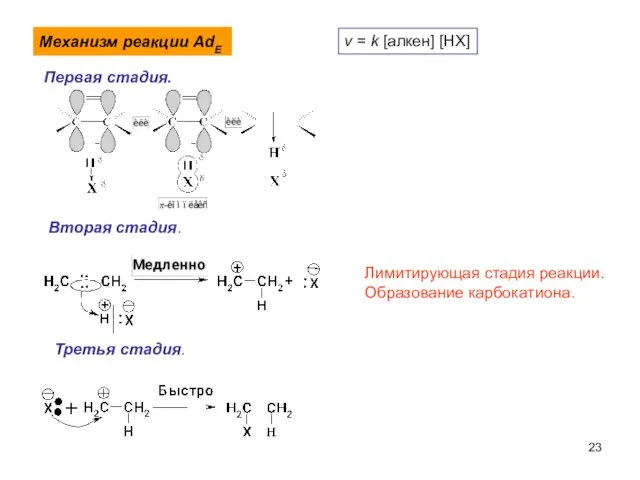
- 23. Механизм реакции AdE Первая стадия. Лимитирующая стадия реакции. Образование карбокатиона. Вторая стадия. v = k [алкен]
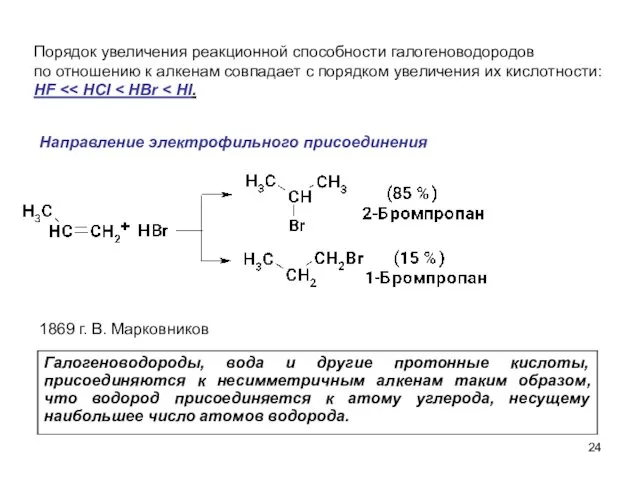
- 24. Порядок увеличения реакционной способности галогеноводородов по отношению к алкенам совпадает с порядком увеличения их кислотности: HF
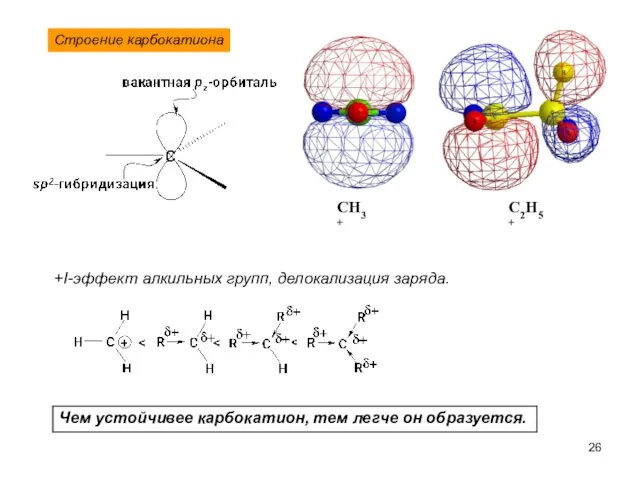
- 26. Строение карбокатиона +I-эффект алкильных групп, делокализация заряда. CH3+ C2H5+
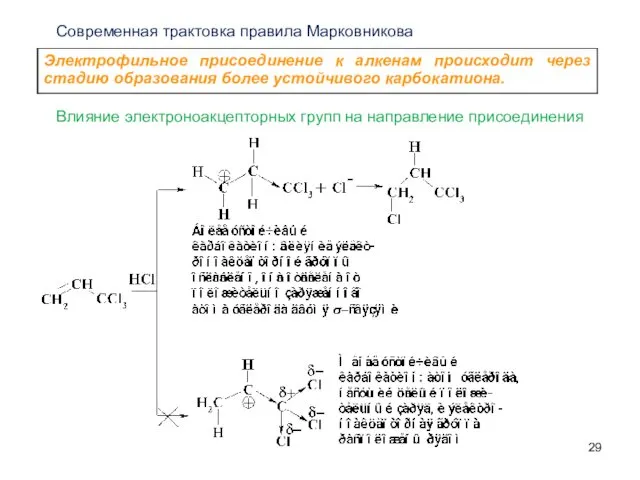
- 29. Современная трактовка правила Марковникова Влияние электроноакцепторных групп на направление присоединения
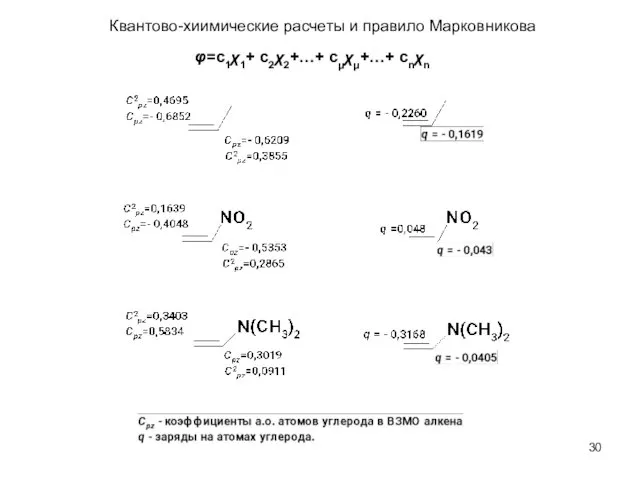
- 30. Квантово-хиимические расчеты и правило Марковникова φ=c1χ1+ c2χ2+…+ cμχμ+…+ cnχn
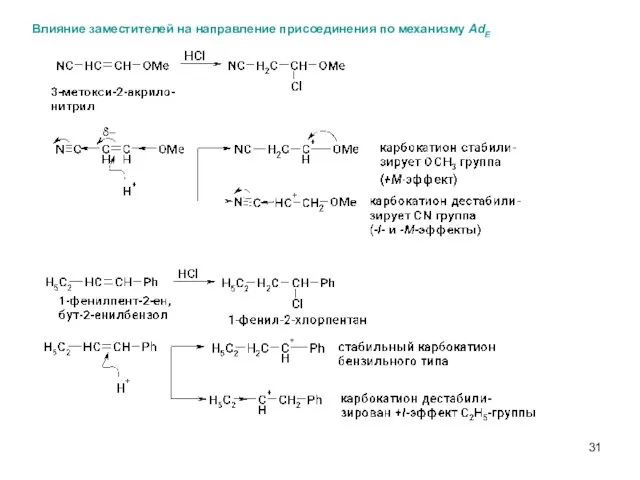
- 31. Влияние заместителей на направление присоединения по механизму AdE
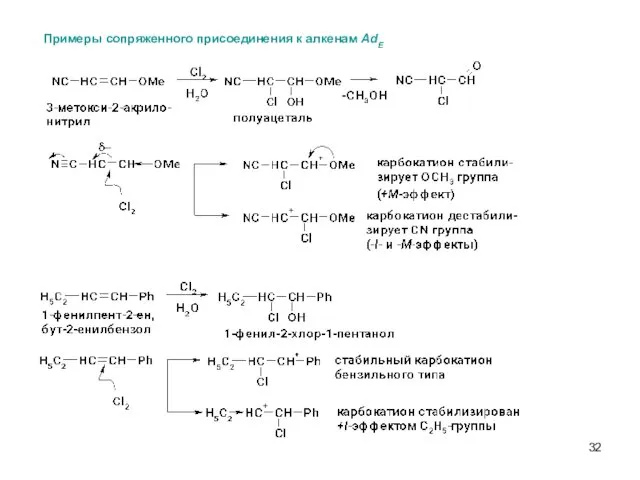
- 32. Примеры сопряженного присоединения к алкенам AdE
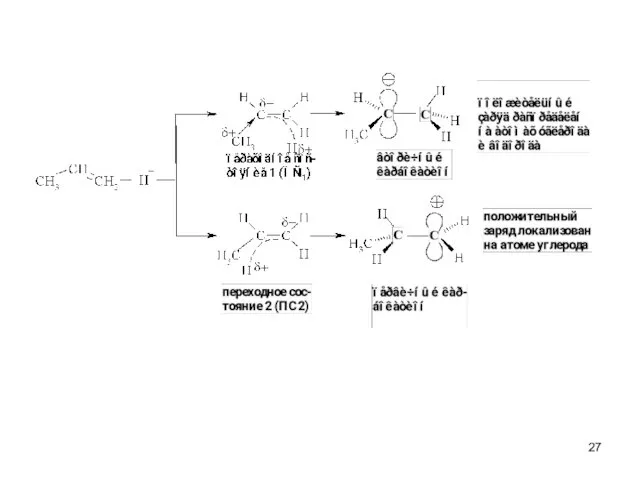
- 33. Реакционная способность и селективность Наиболее реакционноспособным должен быть алкен, дающий наиболее устойчивый карбокатион: Перегруппировка
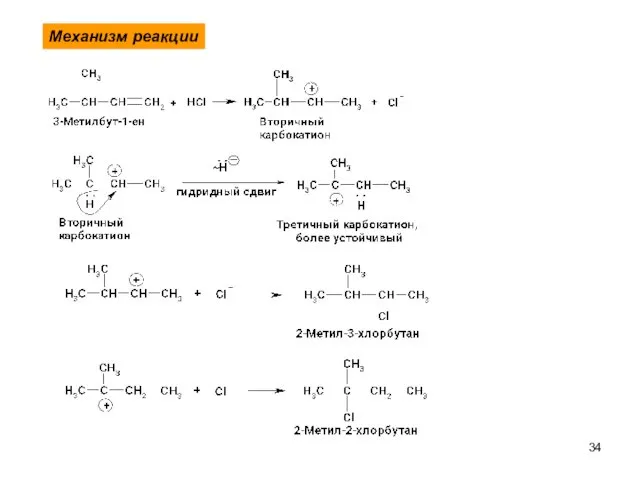
- 34. Механизм реакции
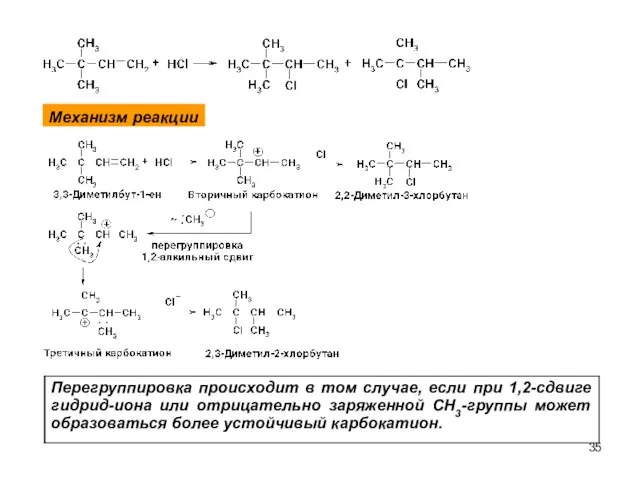
- 35. Механизм реакции
- 36. Присоединение серной кислоты Механизм реакции AdE
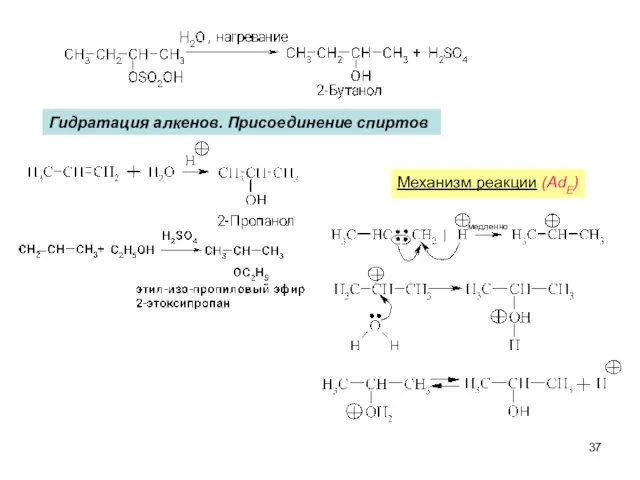
- 37. Гидратация алкенов. Присоединение спиртов Механизм реакции (AdE) медленно
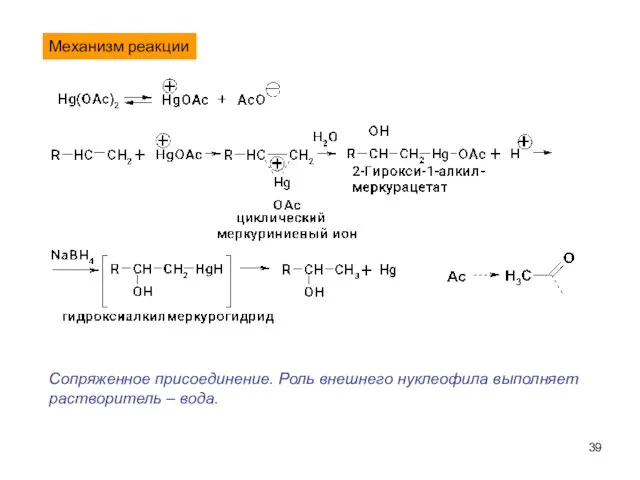
- 38. Оксимеркурирование-демеркурирование (AdE) Региоселективное получение спиртов в соответствии с правилом Марковникова. Сопряженное присоединение. Отсутствуют перегруппировки
- 39. Механизм реакции Сопряженное присоединение. Роль внешнего нуклеофила выполняет растворитель – вода.
- 40. Гидроборирование алкенов
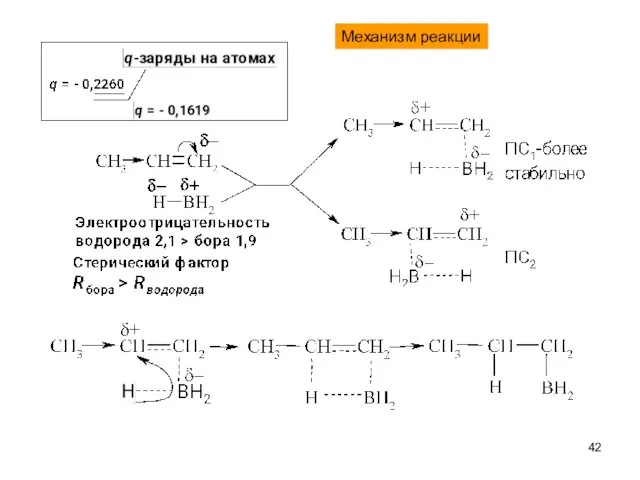
- 42. Механизм реакции
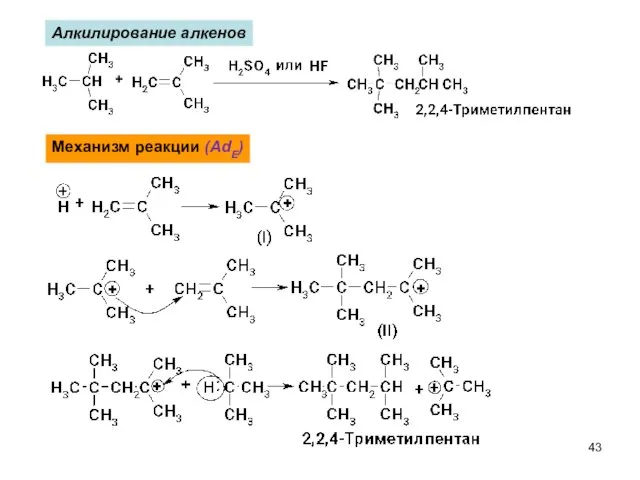
- 43. Алкилирование алкенов Механизм реакции (AdE)
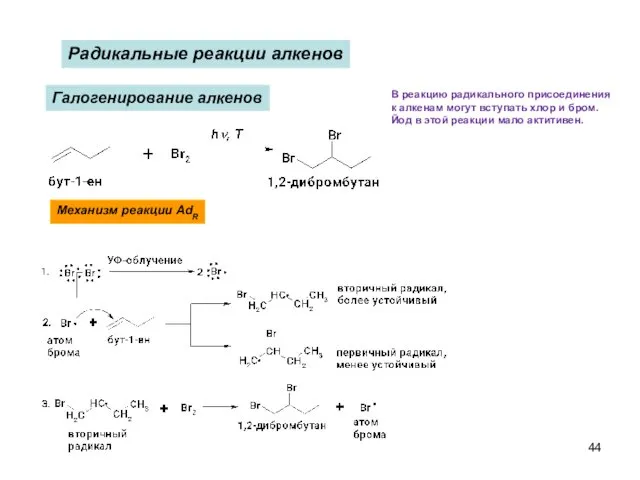
- 44. Радикальные реакции алкенов Галогенирование алкенов В реакцию радикального присоединения к алкенам могут вступать хлор и бром.
- 45. 1. Инициирование: Механизм реакции 2. Рост цепи: Образование атома Br· энергетически более выгодно, чем образование атома
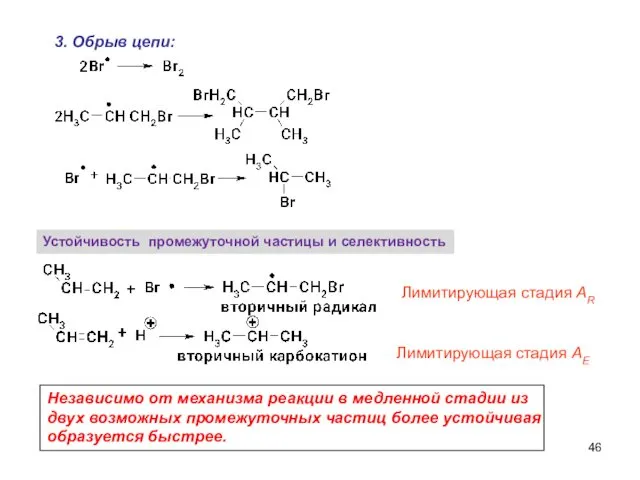
- 46. 3. Обрыв цепи: Лимитирующая стадия AR Лимитирующая стадия AE Независимо от механизма реакции в медленной стадии
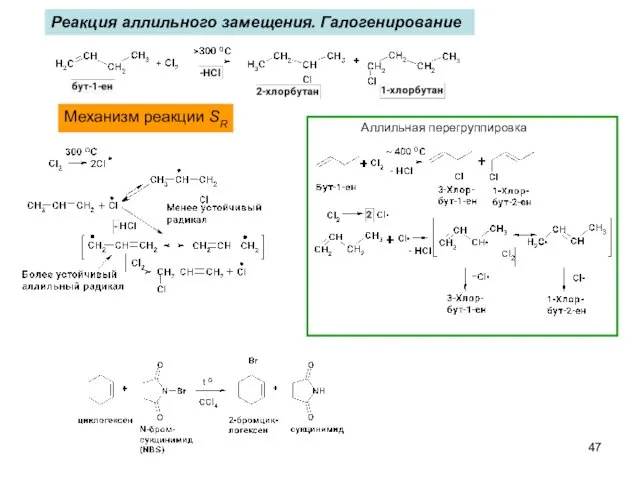
- 47. Механизм реакции SR Реакция аллильного замещения. Галогенирование Аллильная перегруппировка
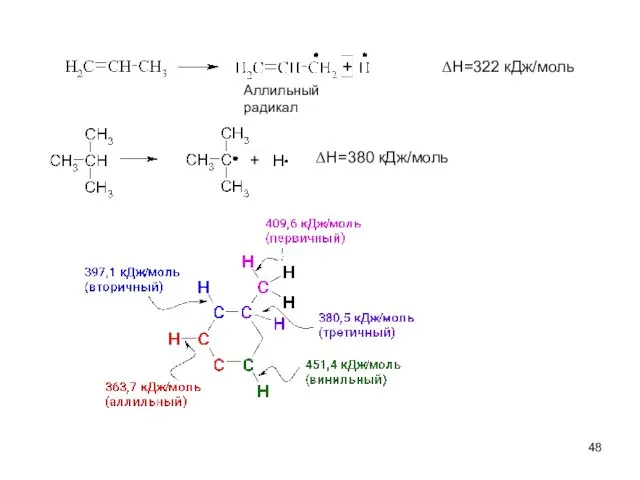
- 48. ΔH=322 кДж/моль Аллильный радикал ΔH=380 кДж/моль
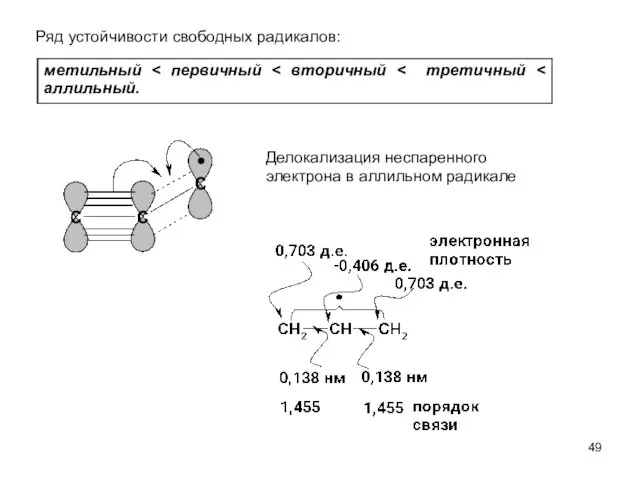
- 49. Ряд устойчивости свободных радикалов: Делокализация неспаренного электрона в аллильном радикале
- 50. Окисление Эпоксидирование Реакция Н.А.Прилежаева Гидроксилирование - синтез гликолей (реакция Е.Е.Вагнера) Механизм реакции Промышленный способ получения окиси
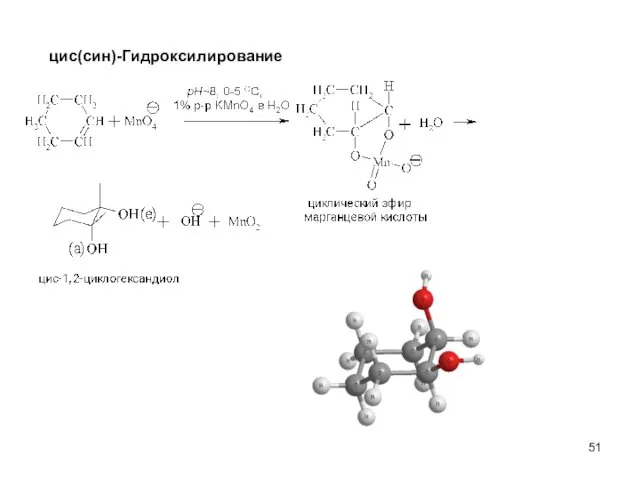
- 51. цис(син)-Гидроксилирование
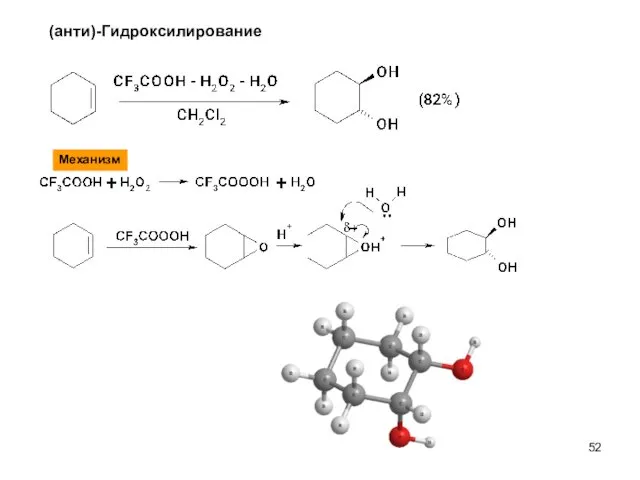
- 52. (анти)-Гидроксилирование Механизм
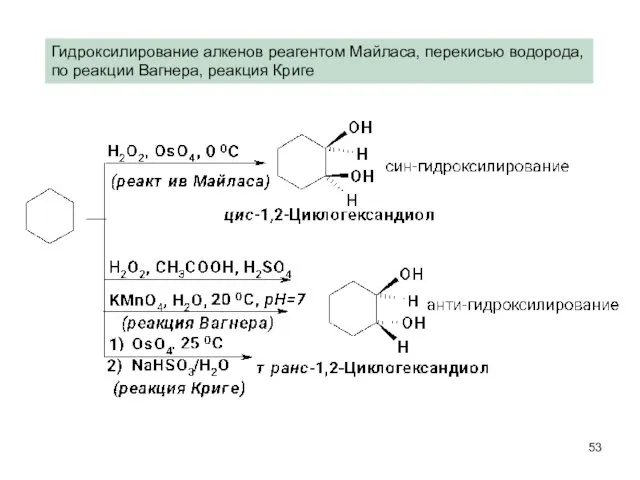
- 53. Гидроксилирование алкенов реагентом Майласа, перекисью водорода, по реакции Вагнера, реакция Криге
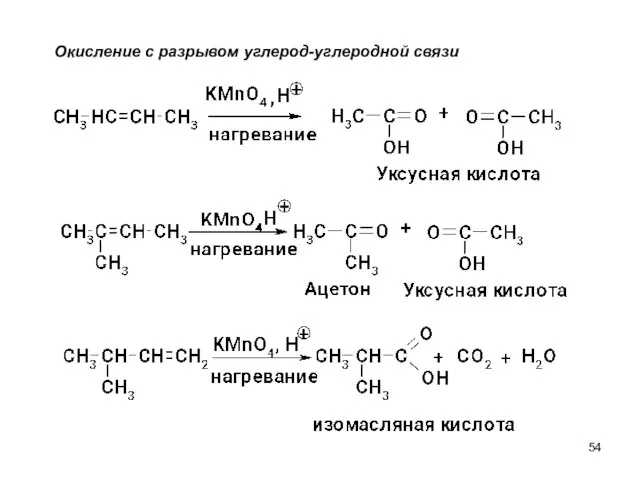
- 54. Окисление с разрывом углерод-углеродной связи
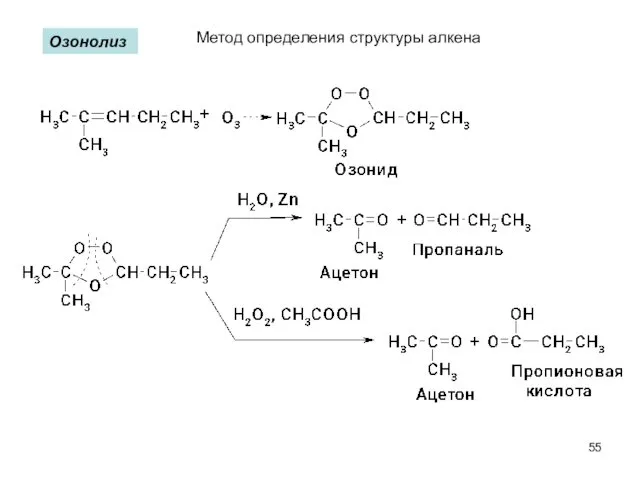
- 55. Озонолиз Метод определения структуры алкена
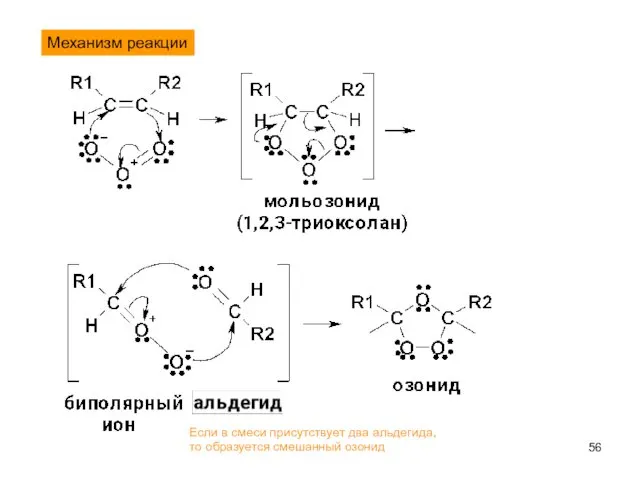
- 56. Механизм реакции Если в смеси присутствует два альдегида, то образуется смешанный озонид
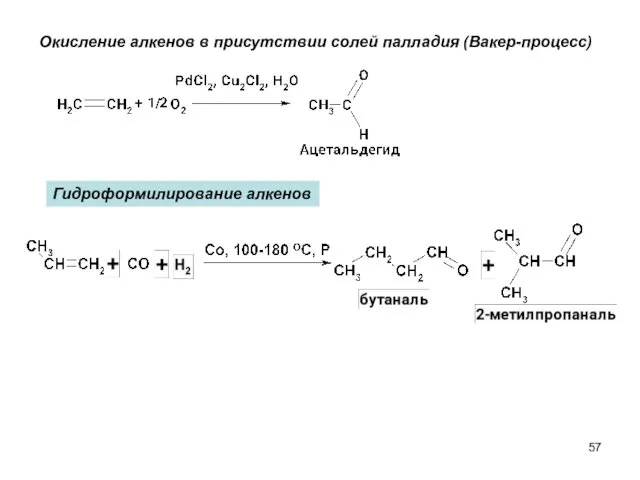
- 57. Окисление алкенов в присутствии солей палладия (Вакер-процесс) Гидроформилирование алкенов
- 58. Полимеризация алкенов Полимер - это макромолекула, состоящая из очень большого числа повторяющихся звеньев. Он образуется путем
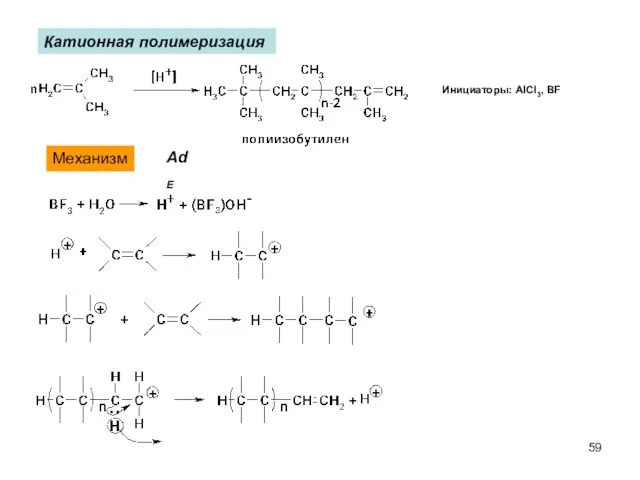
- 59. Катионная полимеризация AdE Механизм Инициаторы: AlCl3, BF
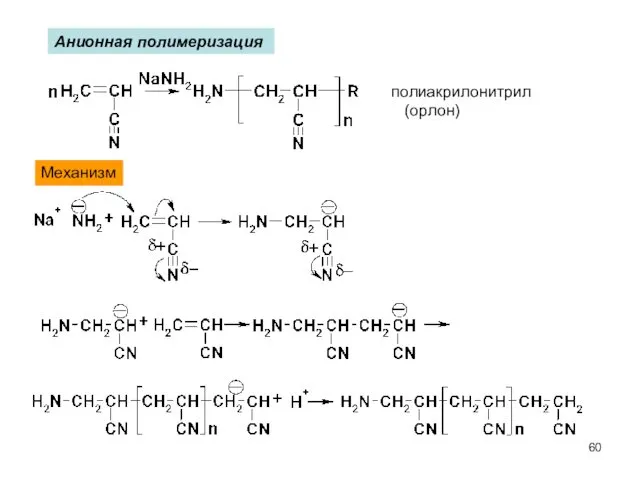
- 60. Анионная полимеризация Механизм полиакрилонитрил (орлон)
- 61. Свободнорадикальная полимеризация Механизм инициирование цепи зарождение цепи рост цепи
- 62. обрыв цепи диспропорционирование рекомбинация
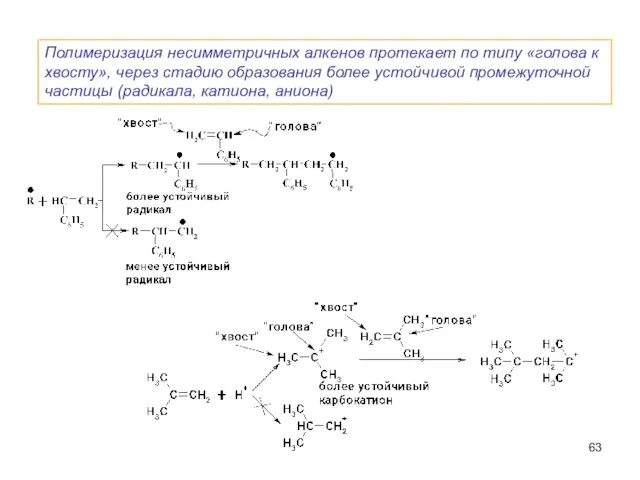
- 63. Полимеризация несимметричных алкенов протекает по типу «голова к хвосту», через стадию образования более устойчивой промежуточной частицы
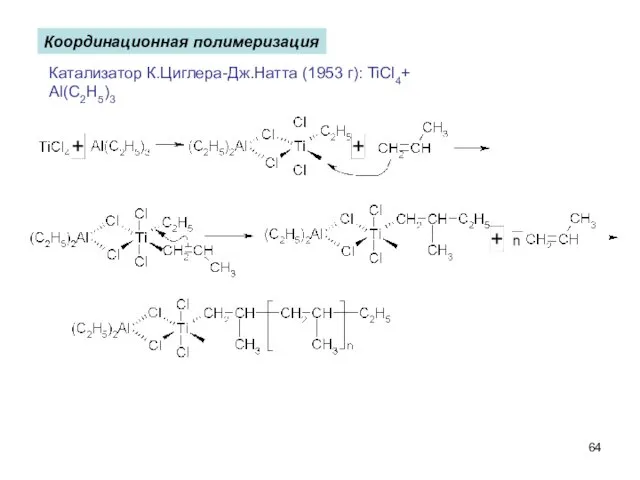
- 64. Координационная полимеризация Катализатор К.Циглера-Дж.Натта (1953 г): TiCl4+ Al(C2H5)3
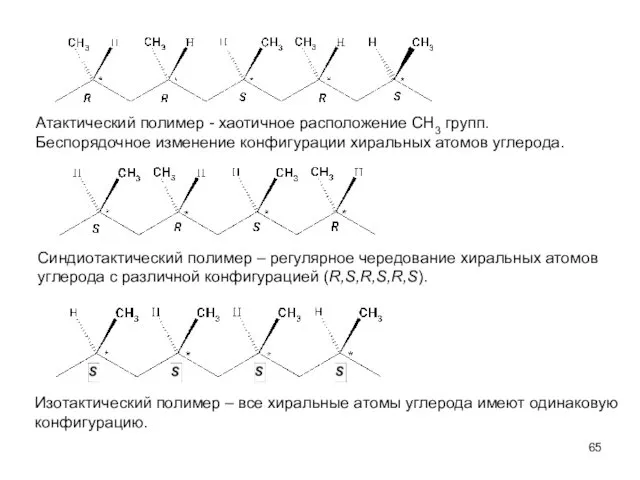
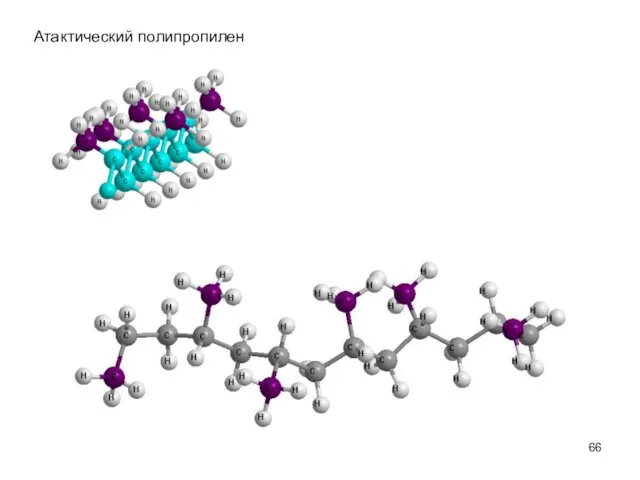
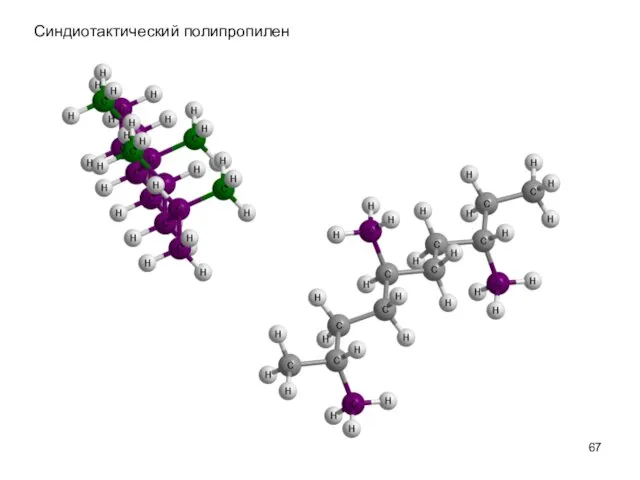
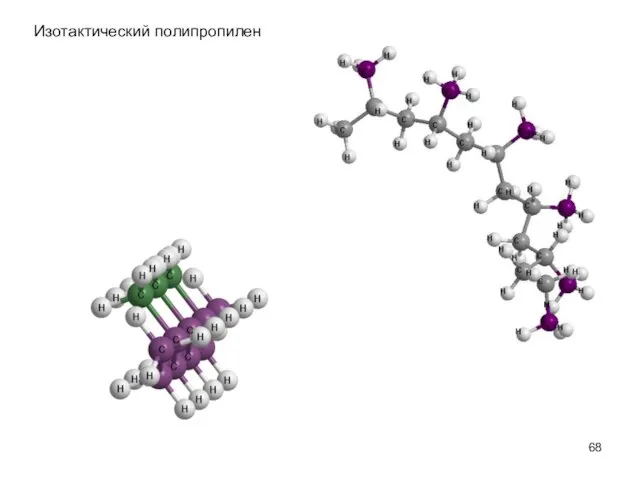
- 65. Атактический полимер - хаотичное расположение CH3 групп. Беспорядочное изменение конфигурации хиральных атомов углерода. Синдиотактический полимер –
- 66. Атактический полипропилен
- 67. Синдиотактический полипропилен
- 68. Изотактический полипропилен
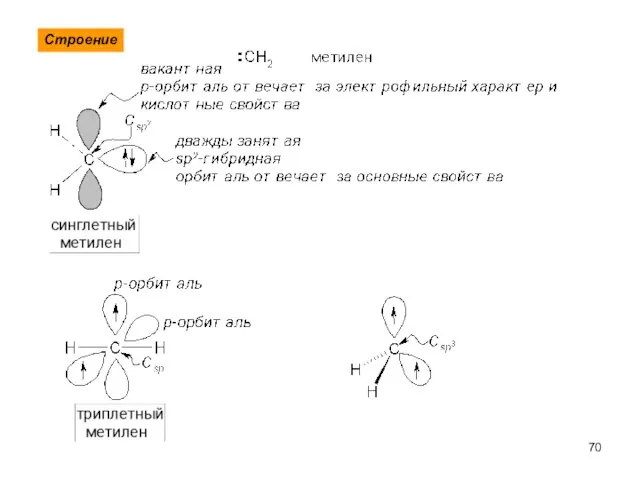
- 69. Карбены и карбеноиды Карбены – частицы с двухкоординационным атомом углерода, имеющим только шесть валентных электронов. Способы
- 70. Строение
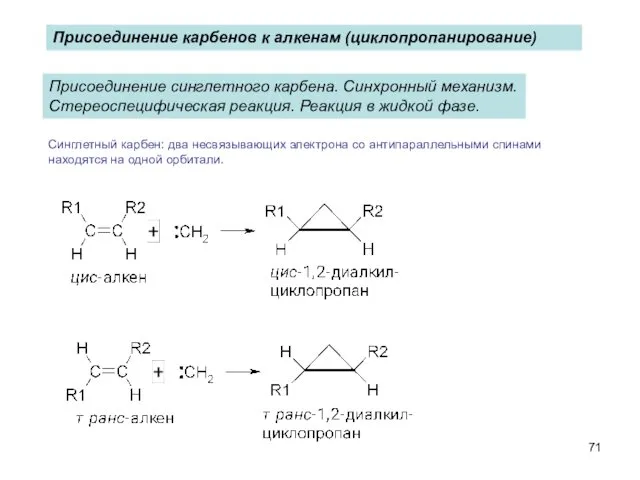
- 71. Присоединение карбенов к алкенам (циклопропанирование) Присоединение синглетного карбена. Синхронный механизм. Стереоспецифическая реакция. Реакция в жидкой фазе.
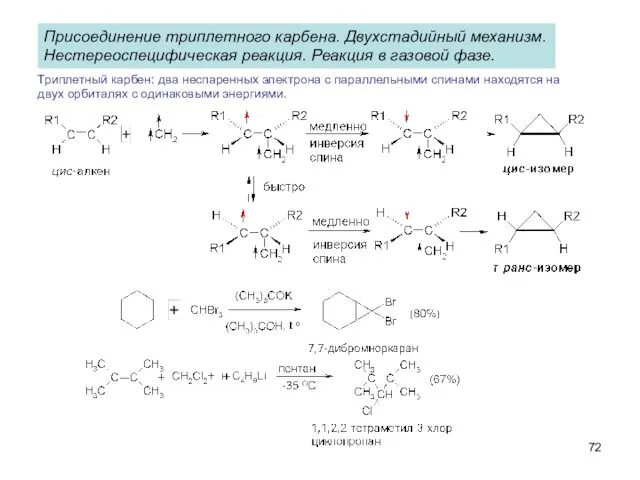
- 72. Присоединение триплетного карбена. Двухстадийный механизм. Нестереоспецифическая реакция. Реакция в газовой фазе. Триплетный карбен: два неспаренных электрона
- 74. Скачать презентацию

![Присоединение галогенов Механизм реакции AdE Первая стадия. v=k’ [алкен] [Br2] +k’’[алкен]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/484376/slide-15.jpg)















 Геолого-промышленные типы месторождений полезных ископаемых
Геолого-промышленные типы месторождений полезных ископаемых Степень окисления Химия 8 класс
Степень окисления Химия 8 класс Презентация по Химии "ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ" - скачать смотреть бесплатно
Презентация по Химии "ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ" - скачать смотреть бесплатно Растворы коллоидных поверхностно-активных веществ (ПАВ)
Растворы коллоидных поверхностно-активных веществ (ПАВ) Презентация по Химии "Степень окисления. Составление химических формул бинарных соединений" - скачать смотреть
Презентация по Химии "Степень окисления. Составление химических формул бинарных соединений" - скачать смотреть  Підготувала учениця 11-А класу Білецька Олеся
Підготувала учениця 11-А класу Білецька Олеся  Способы получения металлов. (11 класс)
Способы получения металлов. (11 класс) Осветлённая вода системы гидрозолоудаления
Осветлённая вода системы гидрозолоудаления Производные ксантина (дипрофиллин, ксантинола никотинат, пентоксифиллин) и гедантоина (фенитоин)
Производные ксантина (дипрофиллин, ксантинола никотинат, пентоксифиллин) и гедантоина (фенитоин) Простейшие операции с веществом
Простейшие операции с веществом Общая фармакология
Общая фармакология Энергетика и направление химических реакций
Энергетика и направление химических реакций Классификация химических реакций
Классификация химических реакций Углеводороды. Обобщение знаний
Углеводороды. Обобщение знаний Термодинамические свойства дисперсных систем
Термодинамические свойства дисперсных систем Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики
Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики Лед – как состояние воды
Лед – как состояние воды Поверхностные явления и дисперсные системы (коллоидная химия)
Поверхностные явления и дисперсные системы (коллоидная химия) Геохимия литосферы
Геохимия литосферы Метанол. Краткая характеристика
Метанол. Краткая характеристика Железо-углеродистые сплавы
Железо-углеродистые сплавы Методы исследования комплексообразования. Леция 2
Методы исследования комплексообразования. Леция 2 Вода - растворитель. Растворы
Вода - растворитель. Растворы Теория строения органических соединений
Теория строения органических соединений Коррозия металлов
Коррозия металлов Особенности химии фтора
Особенности химии фтора Філософія державного контролю якості лікарських засобів. Міжнародний досвід управління якістю у фармацевтичній галузі
Філософія державного контролю якості лікарських засобів. Міжнародний досвід управління якістю у фармацевтичній галузі Химия и охрана окружающей среды
Химия и охрана окружающей среды