Содержание
- 2. Алкены (этиленовые углеводороды, олефины) – непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула ряда
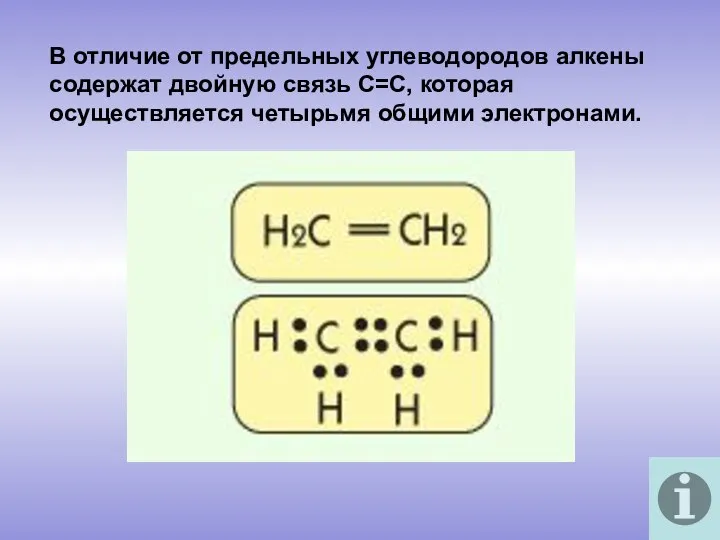
- 3. В отличие от предельных углеводородов алкены содержат двойную связь С=С, которая осуществляется четырьмя общими электронами.
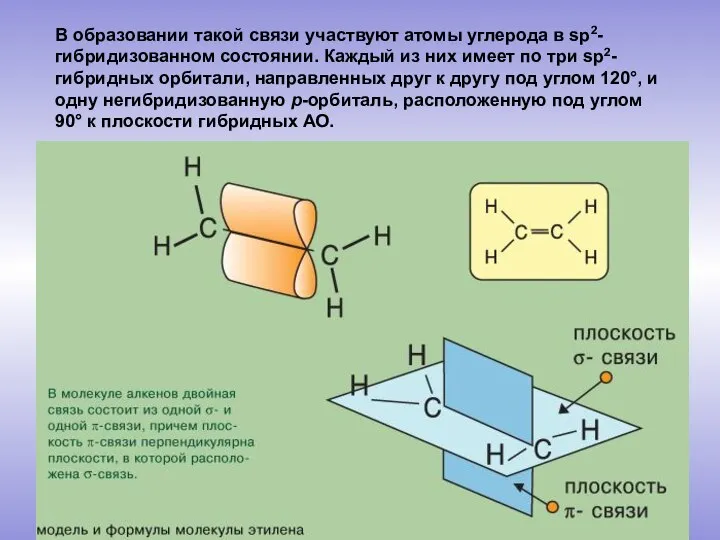
- 4. В образовании такой связи участвуют атомы углерода в sp2-гибридизованном состоянии. Каждый из них имеет по три
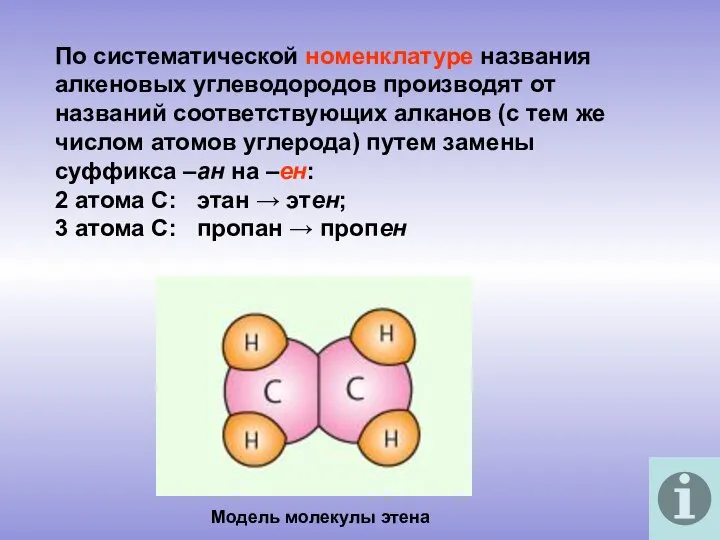
- 5. По систематической номенклатуре названия алкеновых углеводородов производят от названий соответствующих алканов (с тем же числом атомов
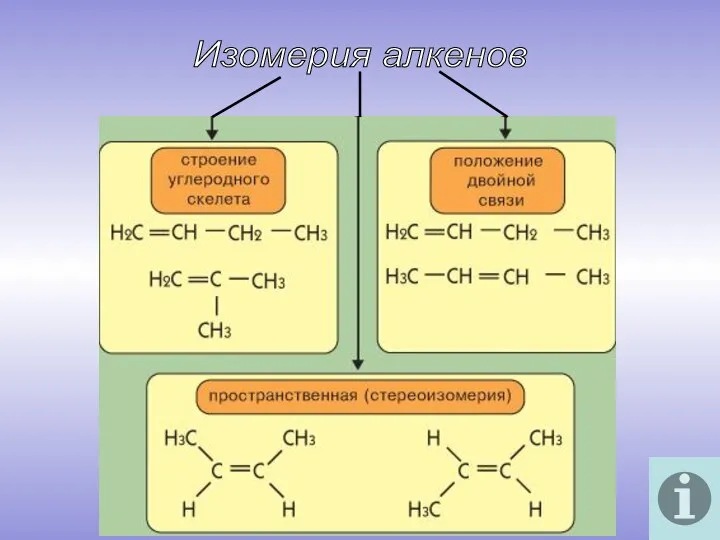
- 6. Изомерия алкенов
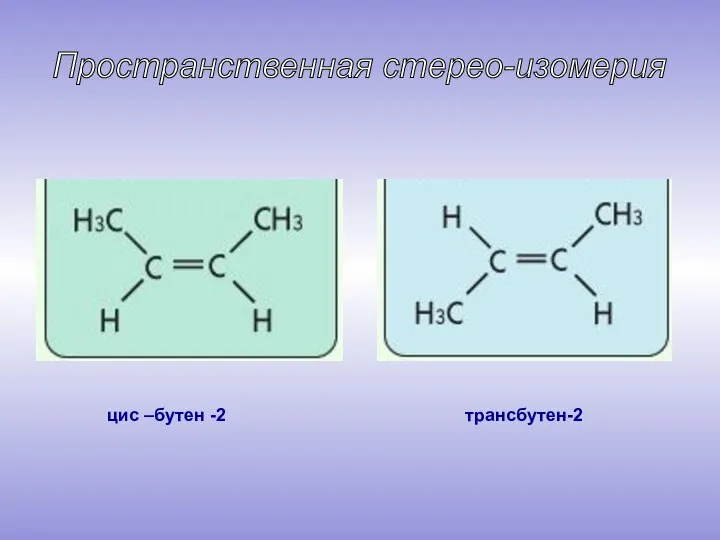
- 7. цис –бутен -2 трансбутен-2 Пространственная стерео-изомерия
- 8. Физические свойства алкенов закономерно изменяются в гомологическом ряду: от С2Н4 до С4Н8 – газы, начиная с
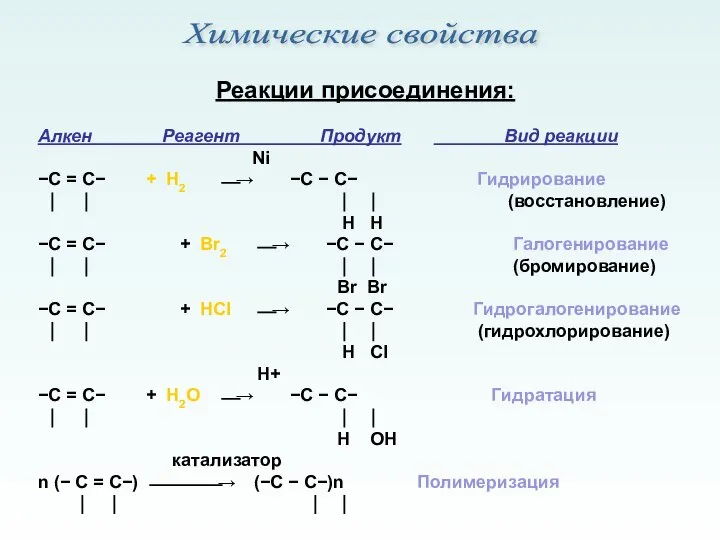
- 9. Реакции присоединения: Алкен Реагент Продукт Вид реакции Ni −С = С− + Н2 ⎯→ −С −
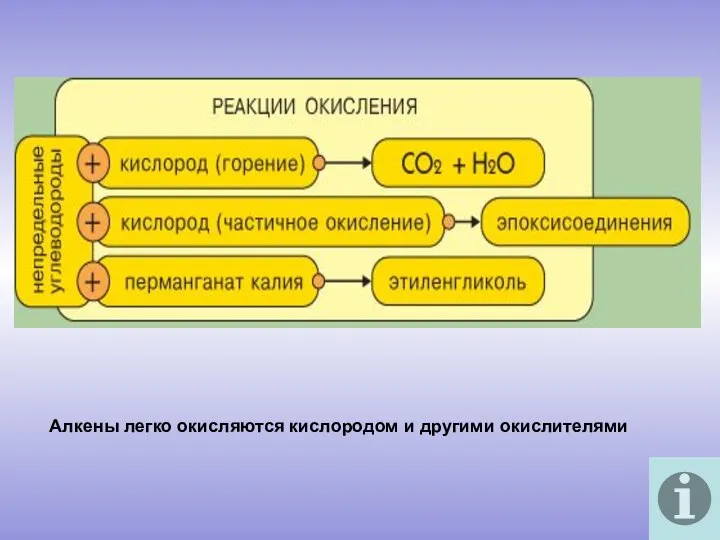
- 10. Алкены легко окисляются кислородом и другими окислителями
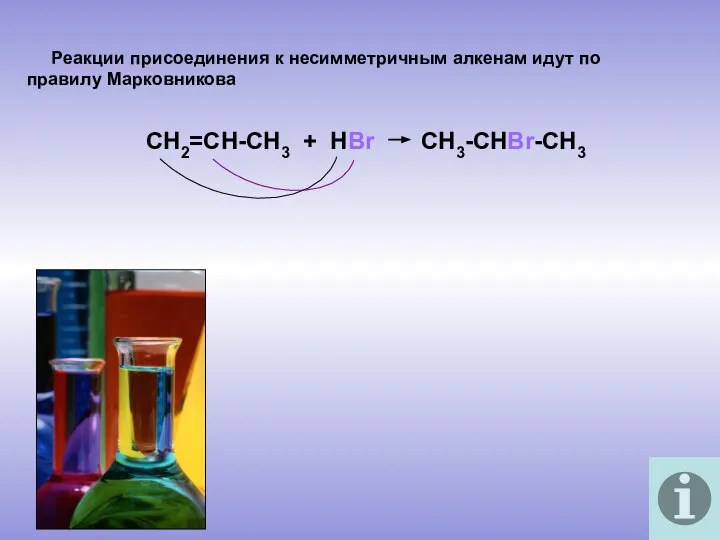
- 11. Реакции присоединения к несимметричным алкенам идут по правилу Марковникова СН2=СН-СН3 + НВr CH3-CHBr-CH3
- 12. Важнейшей реакцией непредельных углеводородов является реакция полимеризации –соединение молекул углеводородов друг с другом с образованием длинных
- 13. Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3). Изомеризация алкенов приводит или к
- 14. Получение алкенов Крекинг алканов: CnH2n+2 ⎯→ CmH2m + CpH2p+2, (где m + p = n) Например:
- 15. Получение алкенов Дегидратация спиртов (лабораторный способ) при t > 150 °C в присутствии водоотнимающих реагентов H2SO4
- 16. Получение алкенов Дегидрогалогенирование моногалогеналканов при действии спиртового_раствора щелочи : СН3−СНBr−CH3 + KOH (спирт) → CH3−CH=CH2 +
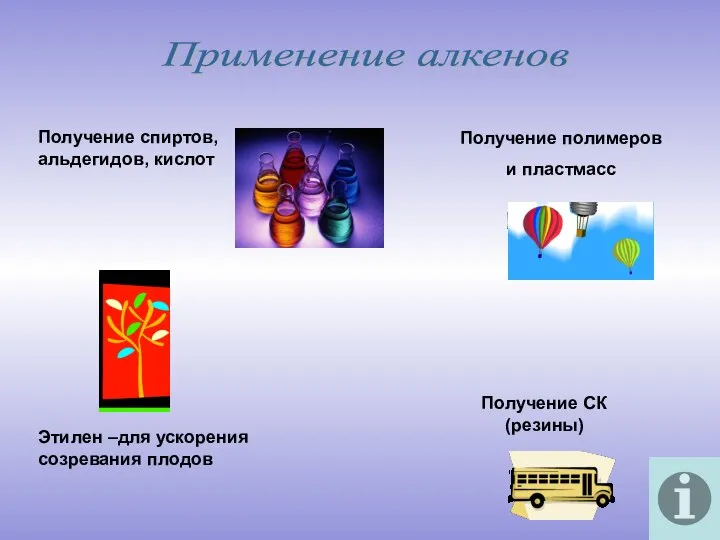
- 17. Применение алкенов Получение спиртов, альдегидов, кислот Получение полимеров и пластмасс Этилен –для ускорения созревания плодов Получение
- 18. Вопросы для текущего контроля ТЕСТ Почему алкены относят к непредельным углеводородам? Чем алкены отличаются от алканов
- 20. Скачать презентацию








 Применение наноматериалов
Применение наноматериалов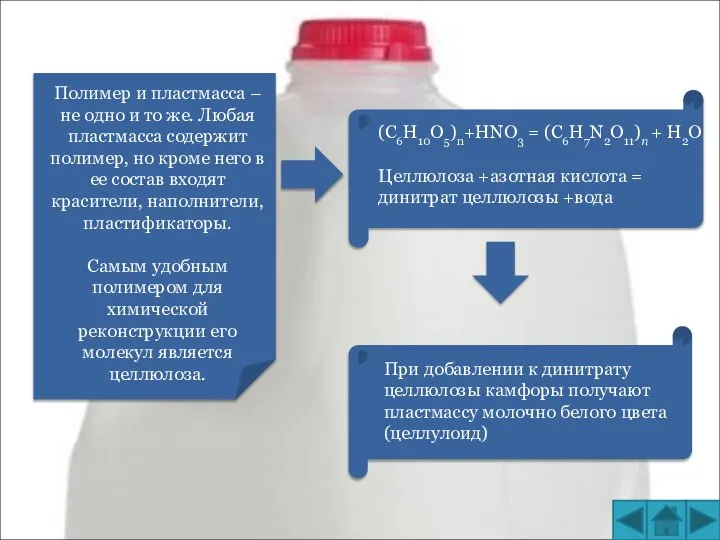 Полимер и пластмасса
Полимер и пластмасса Гексан С6Н14
Гексан С6Н14 Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена
Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена Гидролиз солей
Гидролиз солей Катионы 1, 2 аналитических групп
Катионы 1, 2 аналитических групп Введение в химию. Теоретические основы химии
Введение в химию. Теоретические основы химии Ароматерапия. Химия эфирных масел
Ароматерапия. Химия эфирных масел Выполнила: ученица 11 класса Э Бахарева Маргарита Руководитель: учитель химии Ефименко О.А.
Выполнила: ученица 11 класса Э Бахарева Маргарита Руководитель: учитель химии Ефименко О.А. Классификация кристаллов по силам связи
Классификация кристаллов по силам связи Комплексные соединения. Лекция № 3
Комплексные соединения. Лекция № 3 Коррозия металлов. Виды коррозии металлов
Коррозия металлов. Виды коррозии металлов Хімія у побуті
Хімія у побуті  Загрязнение продуктов питания примесями, мигрирующими из оборудования, инвентаря, тары и упаковочных материалов
Загрязнение продуктов питания примесями, мигрирующими из оборудования, инвентаря, тары и упаковочных материалов Интерактивные игры. Химия
Интерактивные игры. Химия Молекулы и атомы. Броуновское движение
Молекулы и атомы. Броуновское движение История химии Выполнила:Попова Кристина Ученица 7 А класса МБОУ ГИМНАЗИЯ № 11
История химии Выполнила:Попова Кристина Ученица 7 А класса МБОУ ГИМНАЗИЯ № 11 Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Алюминий, его физические и химические свойства
Алюминий, его физические и химические свойства Основные понятия химии
Основные понятия химии Химический состав. Закуска
Химический состав. Закуска Фармацевтические эмульсии
Фармацевтические эмульсии Группа веществ, изолируемых из биологического материала дистилляцией. (Лекция 11)
Группа веществ, изолируемых из биологического материала дистилляцией. (Лекция 11) Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром
Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром Углеводы. Моносахариды
Углеводы. Моносахариды Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии
Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии Презентация к уроку «Вода – важнейшее бинарное соединение»
Презентация к уроку «Вода – важнейшее бинарное соединение»  Топливо и его химические реакции при сгорании
Топливо и его химические реакции при сгорании