Содержание
- 2. В отличие от предельных углеводородов, алкены содержат двойную связь С=С, которая осуществляется 4-мя общими электронами: В
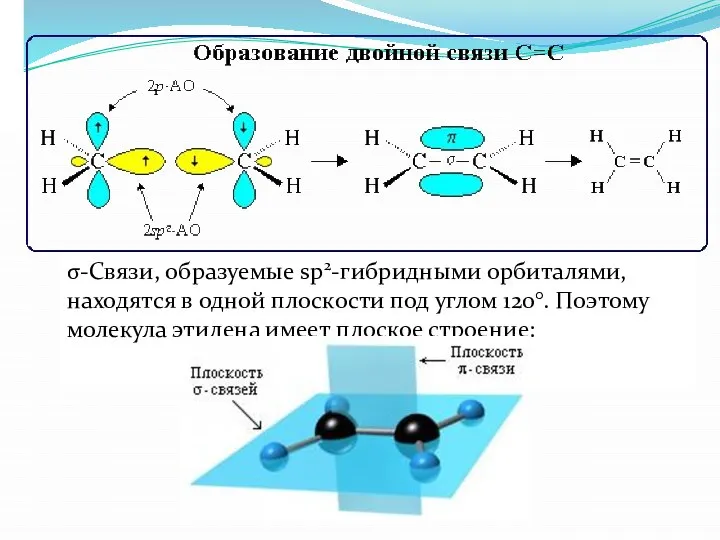
- 3. 4.1. Строение двойной связи С=С Двойная связь является сочетанием σ- и π-связей (хотя она изображается двумя
- 5. σ-Связи, образуемые sp2-гибридными орбиталями, находятся в одной плоскости под углом 120°. Поэтому молекула этилена имеет плоское
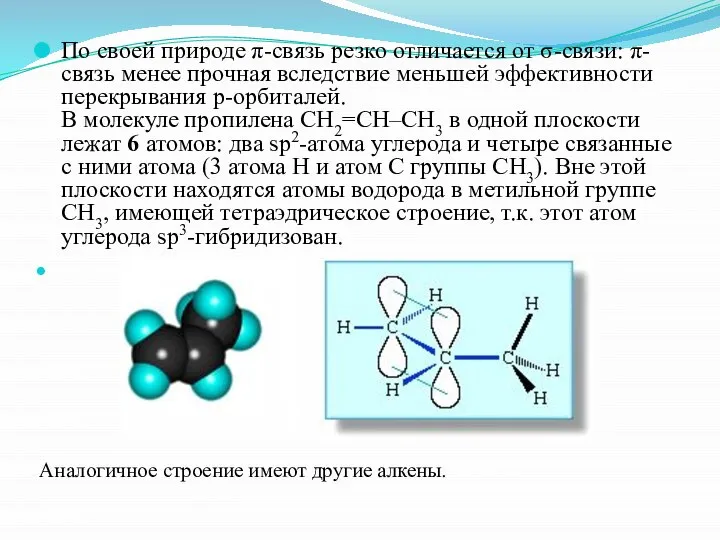
- 6. По своей природе π-связь резко отличается от σ-связи: π-связь менее прочная вследствие меньшей эффективности перекрывания р-орбиталей.
- 7. 4.2. Номенклатура алкенов По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же
- 8. Для простейших алкенов применяются также исторически сложившиеся названия: этилен (этен), пропилен (пропен), бутилен(бутен-1), изобутилен (2-метилпропен) и
- 9. 4.3. Изомерия алкенов Алкенам свойственна изомерия различных типов. Если алкан С4Н10 имеет 2 изомера, то алкену
- 10. 4.3.1. Структурная изомерия алкенов 1. Изомерия углеродного скелета (начиная с С4Н8): 2. Изомерия положения двойной связи
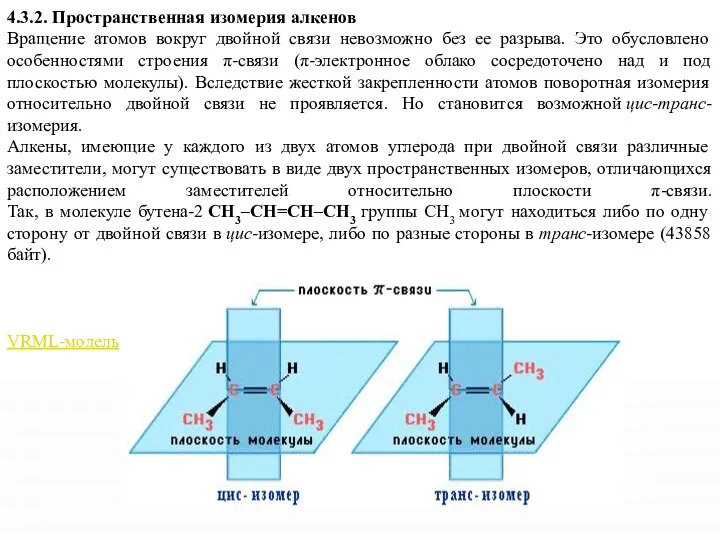
- 11. 4.3.2. Пространственная изомерия алкенов Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями
- 12. цис-транс-Изомерия не проявляется, если хотя бы один из атомов С при двойной связи имеет 2 одинаковых
- 13. 4.4. Свойства алкенов Физические свойства алкенов закономерно изменяются в гомологическом ряду: от С2Н4 до С4Н8 –
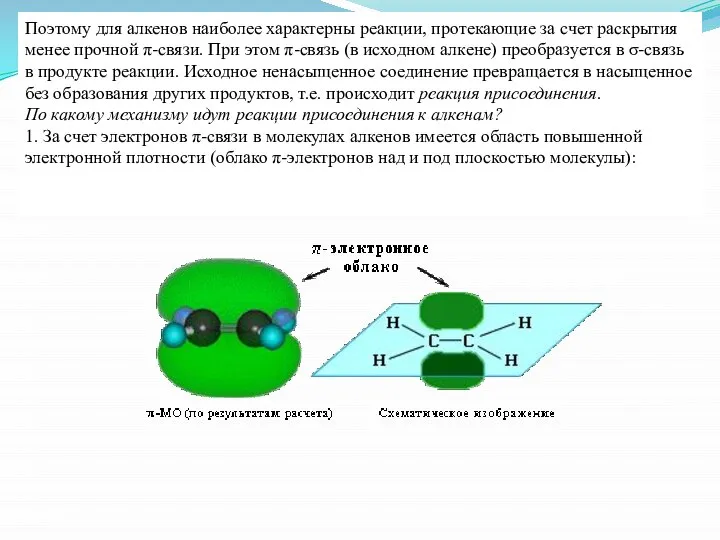
- 14. Поэтому для алкенов наиболее характерны реакции, протекающие за счет раскрытия менее прочной π-связи. При этом π-связь
- 15. Поэтому двойная связь склонна подвергаться атаке электрофильным (электронодефицитным) реагентом. В этом случае будет происходить гетеролический разрыв
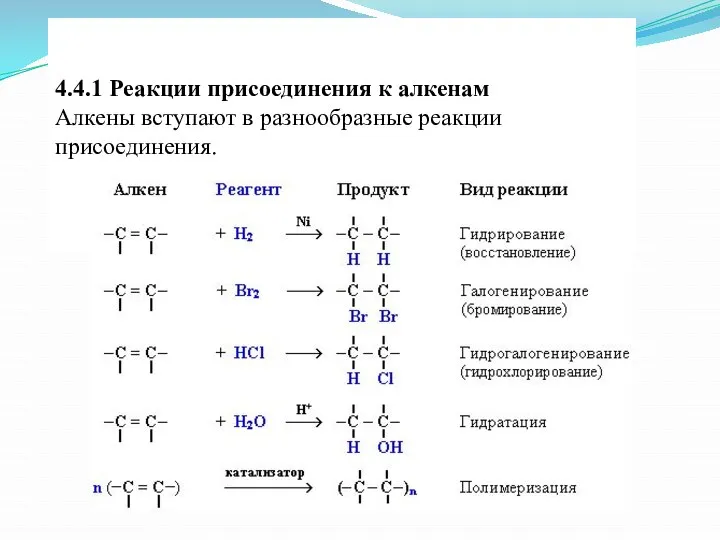
- 16. 4.4.1 Реакции присоединения к алкенам Алкены вступают в разнообразные реакции присоединения.
- 17. 4.4.1.1. Гидрирование (присоединение водорода) Алкены взаимодействуют с водородом при нагревании и повышенном давлении в присутствии катализаторов
- 18. 4.4.1.2. Галогенирование (присоединение галогенов) Присоединение галогенов по двойной связи С=С происходит легко в обычных условиях (при
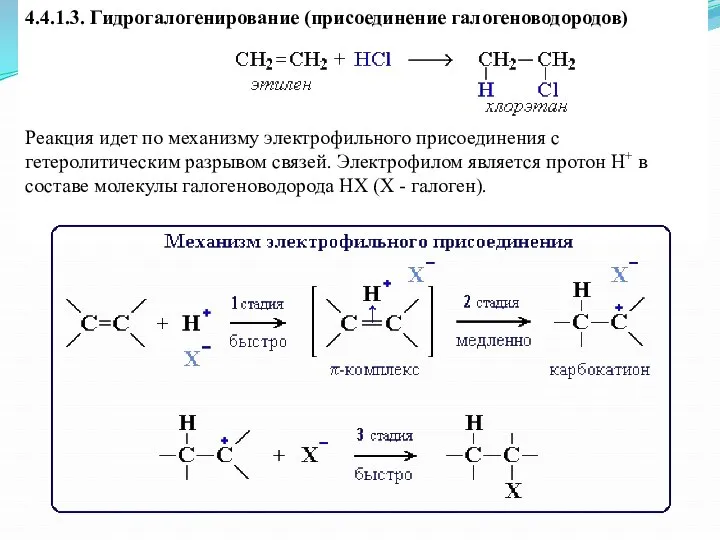
- 19. 4.4.1.3. Гидрогалогенирование (присоединение галогеноводородов) Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей. Электрофилом является
- 20. Реакции гидрохлорирования этилена CH2=CH2 + HCl CH3-CH2Cl Интерактивная анимация (упрощенный вариант: без показа стадии образования π-комплекса)
- 21. 4.4.1.4. Гидратация (присоединение воды) Гидратация происходит в присутствии минеральных кислот по механизму электрофильного присоединения: В реакциях
- 22. 4.4.1.5. Полимеризация алкенов 1. Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного
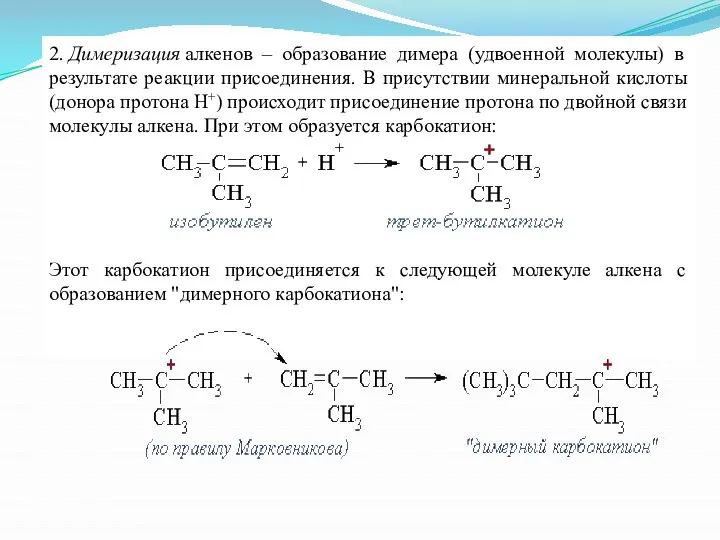
- 23. 2. Димеризация алкенов – образование димера (удвоенной молекулы) в результате реакции присоединения. В присутствии минеральной кислоты
- 24. "Димерный карбокатион" стабилизируется путем выброса протона, что приводит к продуктам димеризации алкена – смеси изомерных диизобутиленов
- 25. 4.4.2. Реакции окисления алкенов Строение продуктов окисления алкенов зависит от условий реакции и природы окислителя. 1.
- 26. 2. При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
- 27. 4.4.3. Изомеризация алкенов Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3). Изомеризация алкенов
- 28. 4.5. Получение алкенов В природе алкены встречаются в значительно меньшей степени, чем предельные углеводороды, по-видимому, вследствие
- 29. 1.Реакции элиминирования идут в соответствии с правилом Зайцева: Отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации
- 31. Скачать презентацию





















 Теория строения химических соединений А.М. Бутлерова
Теория строения химических соединений А.М. Бутлерова Возведение наземных стальных резервуаров
Возведение наземных стальных резервуаров Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс Повышение эффективности разработки низкопродуктивных коллекторов самотлорского месторождения
Повышение эффективности разработки низкопродуктивных коллекторов самотлорского месторождения Штучні і синтетичні волокна
Штучні і синтетичні волокна  Теория горения горючих дисперсных материалов
Теория горения горючих дисперсных материалов  Вода. Растворы. Растворение
Вода. Растворы. Растворение Получение и применение порфиринов и их аналогов
Получение и применение порфиринов и их аналогов Реакции иммунного лизиса. Реакция связывания комплемента (РСК)
Реакции иммунного лизиса. Реакция связывания комплемента (РСК) Химическая Кинетика
Химическая Кинетика Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Сера в таблице Д.И. Менделеева
Сера в таблице Д.И. Менделеева Инертные газы
Инертные газы Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства Практическое применение метанола
Практическое применение метанола Тиімді қоректенудің биохимиялық негіздері. Қоректік заттар катаболизмінің жалпы жолдары
Тиімді қоректенудің биохимиялық негіздері. Қоректік заттар катаболизмінің жалпы жолдары Презентация по Химии "портфоліо" - скачать смотреть
Презентация по Химии "портфоліо" - скачать смотреть  Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные
Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений
Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений Свободное окисление и токсические формы кислорода
Свободное окисление и токсические формы кислорода Углеводороды. Алкены
Углеводороды. Алкены Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия
Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия Состав энергетических напитков
Состав энергетических напитков Природній та супутній нафтові гази, їх склад, використання
Природній та супутній нафтові гази, їх склад, використання Наполненные полимеры. Структура и физико-химические свойства. Введение
Наполненные полимеры. Структура и физико-химические свойства. Введение Биохимия печени
Биохимия печени