Содержание
- 2. Разделение химии на две большие отрасли - неорганическую и органическую химию произошло в начале XIX века,
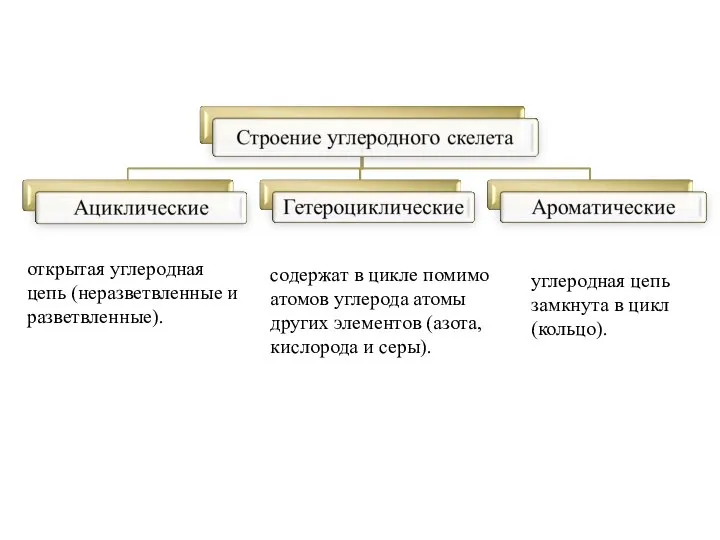
- 3. открытая углеродная цепь (неразветвленные и разветвленные). углеродная цепь замкнута в цикл (кольцо). содержат в цикле помимо
- 4. Функциональная группа - это атом или группа атомов неуглеводородного характера, которые определяют принадлежность соединения к определенному
- 5. Химические свойства Неполярные связи С-С и С-Н способны расщепляться гомолитически под действием активных свободных радикалов. Препараты
- 6. Хлорэтил (Aethylii chloridum) Получение. В промышленных условиях хлорированием этана или гидрохлорированием этилена: C2H6 + Cl2 =
- 7. Описание. Прозрачная, бесцветная, подвижная, легколетучая жидкость с характерным запахом. Растворимость. Трудно или мало растворим в воде,
- 8. Количественное определение. Выполняется с помощью дегалогенирования при нагревании со спиртовым раствором щелочи и последующего аргентометрического определения
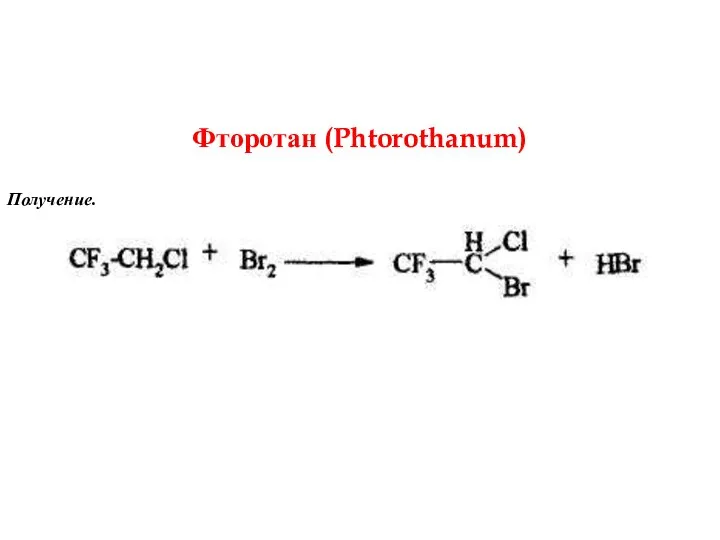
- 9. Фторотан (Phtorothanum) Получение.
- 10. Описание. Прозрачная, бесцветная, подвижная, легколетучая жидкость с характерным запахом. Растворимость. Трудно или мало растворим в воде,
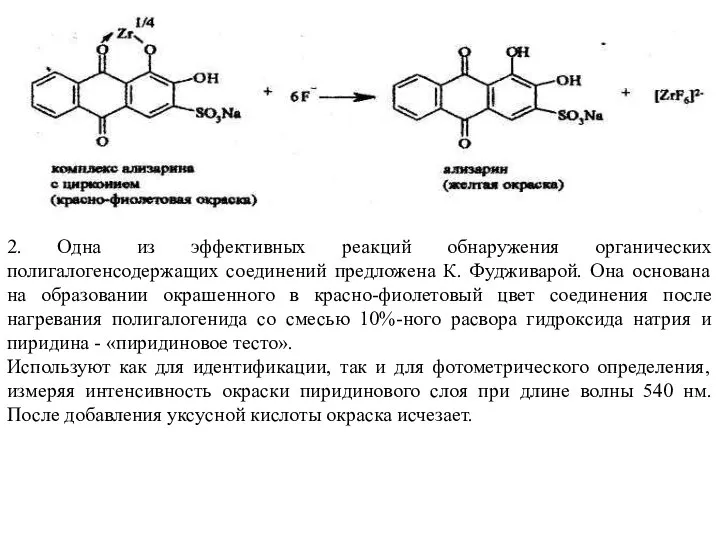
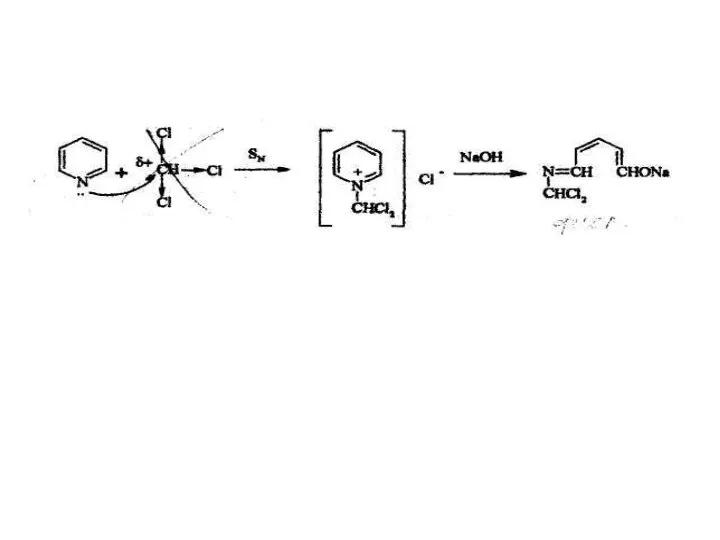
- 11. 2. Одна из эффективных реакций обнаружения органических полигалогенсодержащих соединений предложена К. Фудживарой. Она основана на образовании
- 13. 3. По идентичности ИК-спектров препарата и стандартного образца. Чистота. Примеси хлоридов, бромидов, свободного хлора и брома
- 14. СПИРТЫ Спирты - это производные углеводородов, в которых один или несколько атомов водорода заменены на гидроксильные
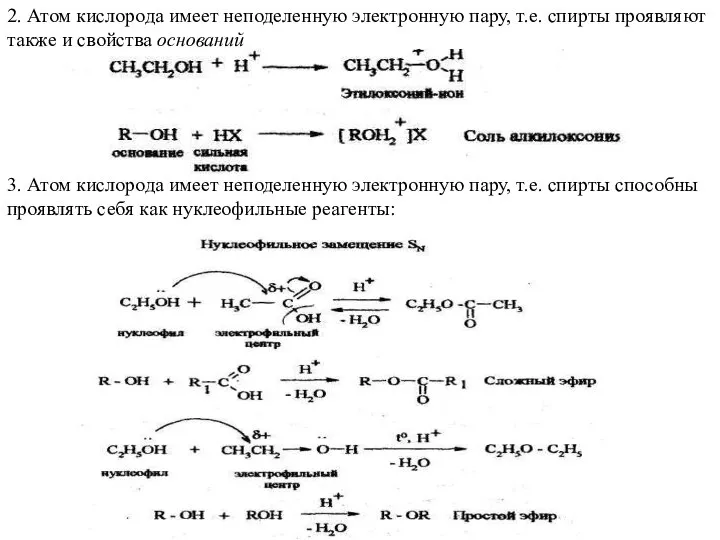
- 15. 2. Атом кислорода имеет неподеленную электронную пару, т.е. спирты проявляют также и свойства оснований 3. Атом
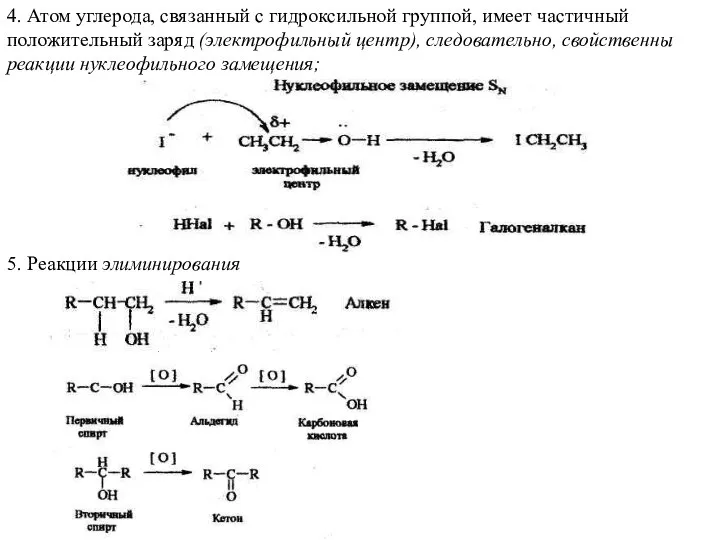
- 16. 4. Атом углерода, связанный с гидроксильной группой, имеет частичный положительный заряд (электрофильный центр), следовательно, свойственны реакции
- 17. 6. Первичные спирты окисляются в альдегиды, которые могут окисляться в карбоновые кислоты. Вторичные спирты окисляются в
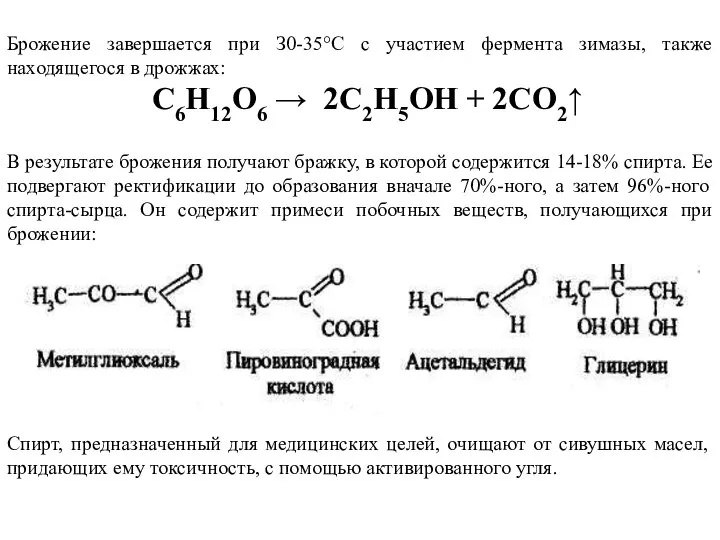
- 18. Брожение завершается при З0-35°С с участием фермента зимазы, также находящегося в дрожжах: С6Н12О6 → 2С2Н5ОH +
- 19. Описание. Прозрачная летучая жидкость с характерным запахом и жгучим вкусом. Легко воспламеняется и горит синеватым бездымным
- 20. 3. Этанол идентифицируют цветной реакцией с раствором дихромата калия. В присутствии серной кислоты происходит образование солей
- 21. Примесь восстанавливающих веществ определяют по обесцвечиванию раствора перманганата калия. Раствор перманганата калия при добавлении к исследуемому
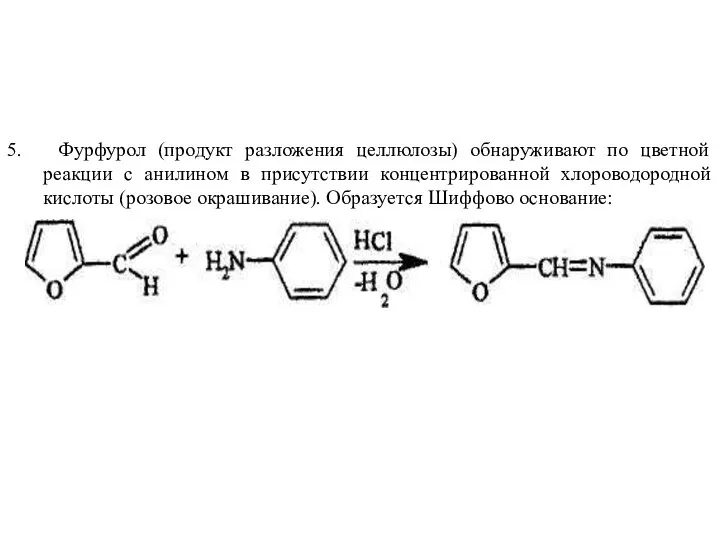
- 22. 5. Фурфурол (продукт разложения целлюлозы) обнаруживают по цветной реакции с анилином в присутствии концентрированной хлороводородной кислоты
- 23. Количественное определение. В жидких лекарственных формах в соответствии с требованиями ГФ XI устанавливают по плотности отгонов
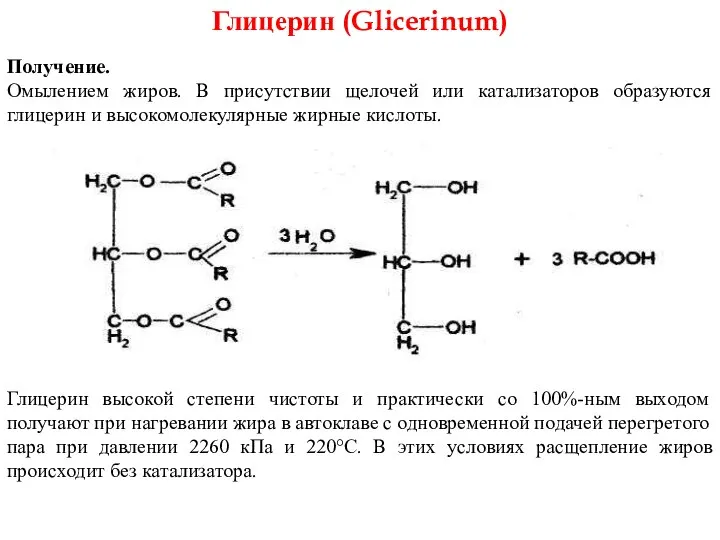
- 24. Глицерин (Glicerinum) Получение. Омылением жиров. В присутствии щелочей или катализаторов образуются глицерин и высокомолекулярные жирные кислоты.
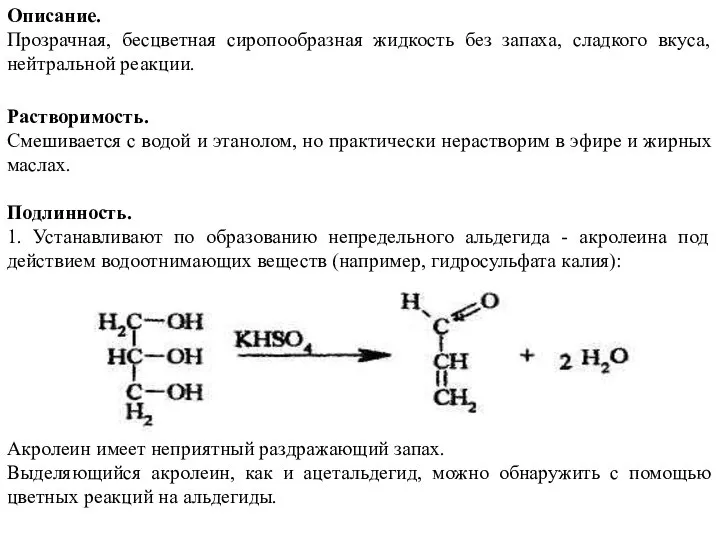
- 25. Описание. Прозрачная, бесцветная сиропообразная жидкость без запаха, сладкого вкуса, нейтральной реакции. Растворимость. Смешивается с водой и
- 26. 2. Открывают глицерин с помощью реакции образования глицерата меди. Смешивают предварительно 5%-ный раствор сульфата меди с
- 27. Хранение. В хорошо укупоренной таре, в прохладном месте, учитывая способность глицерина поглощать пары воды, содержащиеся в
- 28. Химические свойства Простые эфиры - мало реакционноспособные соединения. Наиболее важной реакцией является их расщепление под действием
- 29. Этилсернистая кислота взаимодействует с избытком этилового спирта, образуя диэтиловый эфир: Полученный эфир отгоняют в приёмник. При
- 30. Растворимость. Оба препарата растворимы в 12 ч. воды, смешиваются с этанолом, бензолом, хлороформом, жирными и эфирными
- 31. Наличие пероксидов в эфире медицинском устанавливают по реакции с иодидами: H5C2-O-O-C2H5 +2KI + H2O → I2
- 32. Хранение. Оба препарата относятся к списку Б. Эфир медицинский хранят в хорошо укупоренных склянках оранжевого стекла
- 33. Применение. Эфир медицинский применяют как растворитель для приготовления настоек, экстрактов, некоторых лекарственных форм для наружного применения,
- 34. Химические свойства. 1. Кислотный гидролиз (реакции этерификации): 2. Щелочной гидролиз (омыление ). 3. Гидроксамовая проба -
- 35. Нитроглицерин (Nitrogiycermum) Н2С-0-NO2 ⎢ HС-О-NO2 ⎢ H2С-О-NO2 Получение. По реакции этерификации. Исходными продуктами синтеза служат глицерин,
- 36. Описание. Бесцветное или бледно-ж`лтое масло. Плотность не более 0,829 г/см3 Растворимость. В воде нерастворим, хорошо растворяется
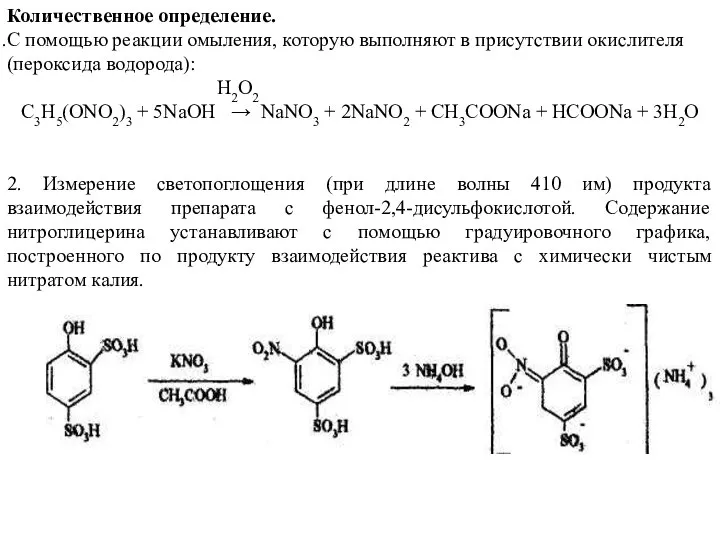
- 37. Количественное определение. С помощью реакции омыления, которую выполняют в присутствии окислителя (пероксида водорода): H2O2 C3H5(ONO2)3 +
- 38. Хранение. По списку Б в хорошо укупоренной таре, в прохладном, защищенном от света месте в малых
- 39. Альдегиды и их производные Альдегиды - это соединения, которые содержат в молекуле карбонильную группу, обязательно связанную
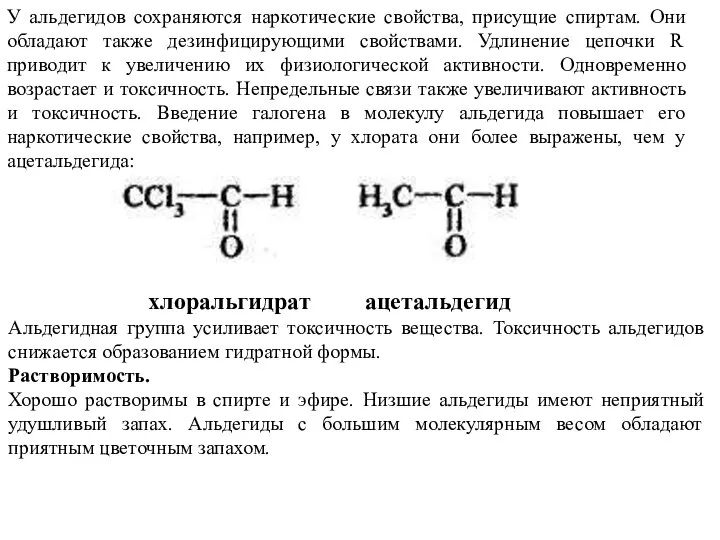
- 40. У альдегидов сохраняются наркотические свойства, присущие спиртам. Они обладают также дезинфицирующими свойствами. Удлинение цепочки R приводит
- 41. Раствор формальдегида (Solutio Formaldehydi, Formalinum) Получение. Описание. Прозрачная бесцветная жидкость своеобразного острого запаха. Смешивается во всех
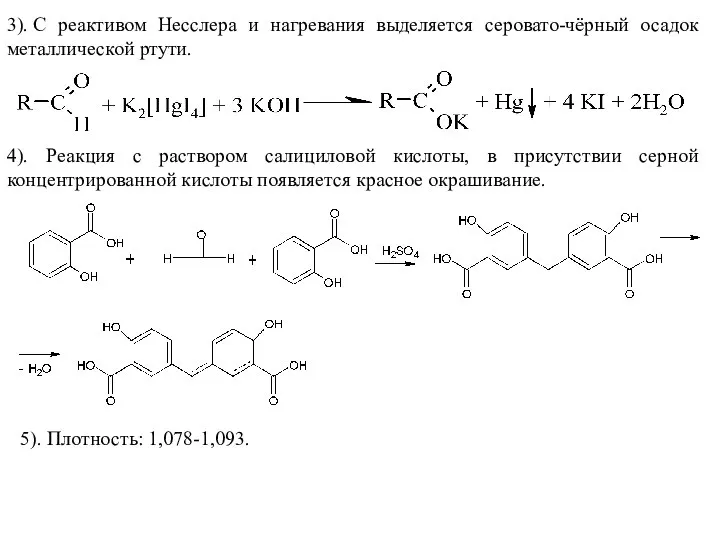
- 42. 3). С реактивом Несслера и нагревания выделяется серовато-чёрный осадок металлической ртути. 4). Реакция с раствором салициловой
- 43. Количественное определение. Обратная йодометрия в присутствии щёлочи, первый рабочий раствор-раствор йода, второй –натрия тиосульфат, индикатор крахмал.
- 44. Метенамин (Hexamethylentetraminum, Urotropinum, Methenaminum) Получение. Описание. Бесцветные кристаллы или белый кристаллический порошок, без запаха, жгучего и
- 45. Чистота. 1.Кислотность или щелочность: раствор препарата должен быть щелочным по лакмусу и не давать щелочной реакции
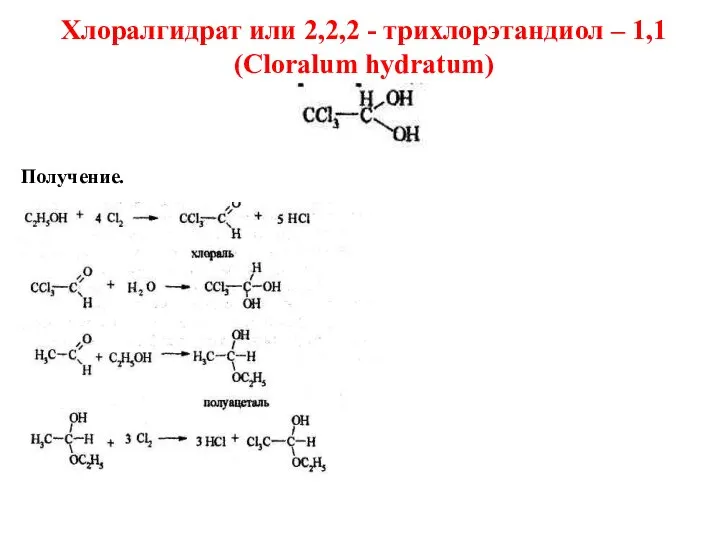
- 46. Хлоралгидрат или 2,2,2 - трихлорэтандиол – 1,1 (Cloralum hydratum) Получение.
- 47. Описание. Бесцветные прозрачные кристаллы или мелкокристаллический порошок с характерным запахом и слегка горьковатым вкусом. Гигроскопичен при
- 48. Чистота. 1.Прозрачность и цветность раствора Полученный раствор должен быть прозрачным и бесцветным. 2.Кислотность. При добавлении к
- 50. Скачать презентацию

































 Амины. 10 класс
Амины. 10 класс Квантовая химия
Квантовая химия Жиры. 9 класс
Жиры. 9 класс Химические волокна Ацетатное волокно Подготовила: ученица 11 класса Гориславец Дарья
Химические волокна Ацетатное волокно Подготовила: ученица 11 класса Гориславец Дарья  Сероводород и оксид серы
Сероводород и оксид серы Система инактивации лекарственных средств в организме человека
Система инактивации лекарственных средств в организме человека Электролиз воды
Электролиз воды Электрохимические системы. Химические источники тока
Электрохимические системы. Химические источники тока Кремний в природе
Кремний в природе Презентация по Химии "Альдегиды, свойства, получение, применение" - скачать смотреть
Презентация по Химии "Альдегиды, свойства, получение, применение" - скачать смотреть  Мікробіологічні основи асептики та антисептики. Антисептичні засоби і матеріали
Мікробіологічні основи асептики та антисептики. Антисептичні засоби і матеріали Исследование защитных свойств зубных паст. Автор работы- ученик 11 Б класса Гиря Научный руководитель- Якимова М.А. МОУ Южно-росс
Исследование защитных свойств зубных паст. Автор работы- ученик 11 Б класса Гиря Научный руководитель- Якимова М.А. МОУ Южно-росс Аминокислоты
Аминокислоты Производство серной кислоты H2SO4
Производство серной кислоты H2SO4 Гидролиз солей
Гидролиз солей Пиридин. Методы получения пиридина. Химические свойства. Биологически активные производные. (Леекция 5)
Пиридин. Методы получения пиридина. Химические свойства. Биологически активные производные. (Леекция 5) Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев)
Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев) Щелочноземельные металлы
Щелочноземельные металлы Химия в повседневной жизни человека Выполнила: Корпачева Лена 11б класс
Химия в повседневной жизни человека Выполнила: Корпачева Лена 11б класс  Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля Химия элементов IVA группы
Химия элементов IVA группы Метаболизм липидов. Метаболизм триацилглицеридов. (Лекция 9)
Метаболизм липидов. Метаболизм триацилглицеридов. (Лекция 9) Производственные яды. Смазочные масла и синтетические охлаждающие смеси. Области применения и действие на организм
Производственные яды. Смазочные масла и синтетические охлаждающие смеси. Области применения и действие на организм Ліпіди
Ліпіди Фенол. Физические и химические свойства фенола
Фенол. Физические и химические свойства фенола Антиоксидантная защита мозга
Антиоксидантная защита мозга Протолитическое равновесие в водных и неводных растворах
Протолитическое равновесие в водных и неводных растворах ЭМВИ — прогрессивное направление в области криминалистических исследований
ЭМВИ — прогрессивное направление в области криминалистических исследований