Содержание
- 2. «Открытие алюминия» В 1825 г. датский физик Ханс Кристиан Эрстед был первым, кому удалось, подобно неизвестному
- 3. «Серебро из глины» Немецкий учёный Ф. Велер (1827 г.) получил алюминий при нагревании хлорида алюминия со
- 4. «Электролитический способ» В 1886 году Поль Эру французский инженер-химик запатентовал открытие способа получения алюминия Чарльз Мартин
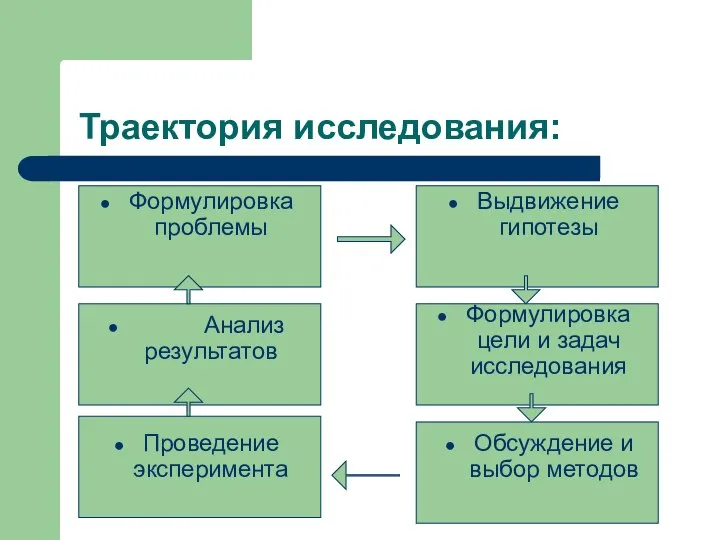
- 5. Траектория исследования: Формулировка проблемы Выдвижение гипотезы Формулировка цели и задач исследования Проведение эксперимента Обсуждение и выбор
- 6. Проблемный вопрос: «Алюминий – металл будущего?»
- 7. Характеристика алюминия Al Хими- ческий элемент Простое вещество
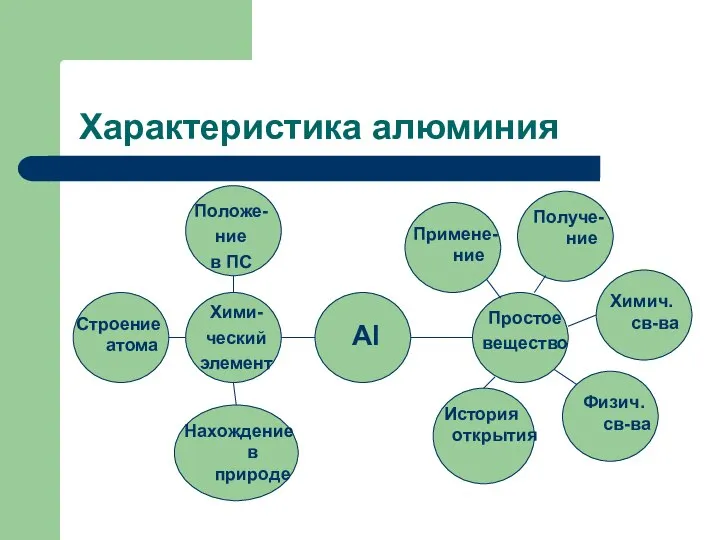
- 8. Характеристика алюминия Положе- ние в ПС Строение атома Примене- ние Al Хими- ческий элемент Нахождение в
- 9. Цель и задачи исследования: Ответить на вопрос: « Почему алюминий называют металлом будущего?» Дать характеристику элемента
- 10. Положение алюминия в ПСХЭ Д.И.Менделеева. Строение атома. Порядковый номер 13 . Алюминий - элемент III группы,
- 11. Положение алюминия в ПСХЭ Д.И.Менделеева. Строение атома. Порядковый номер 13 . Алюминий - элемент III группы,
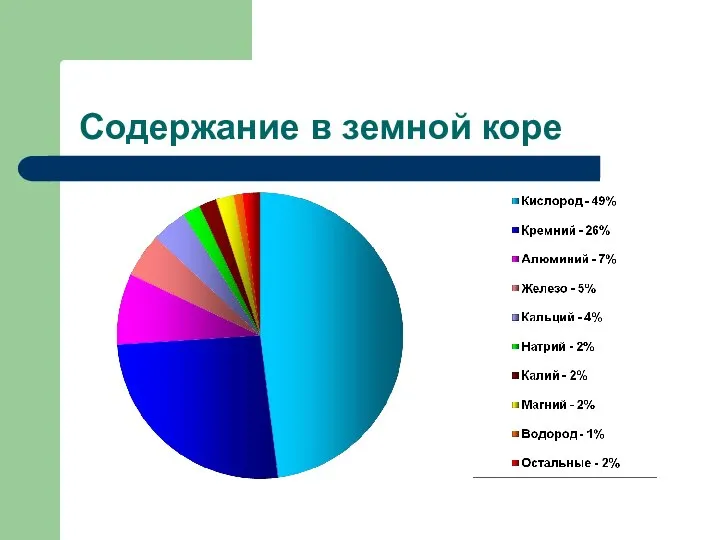
- 12. Содержание в земной коре
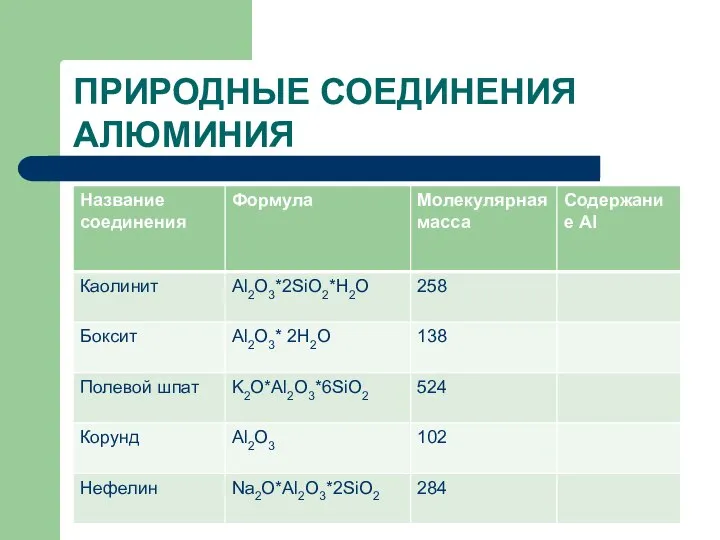
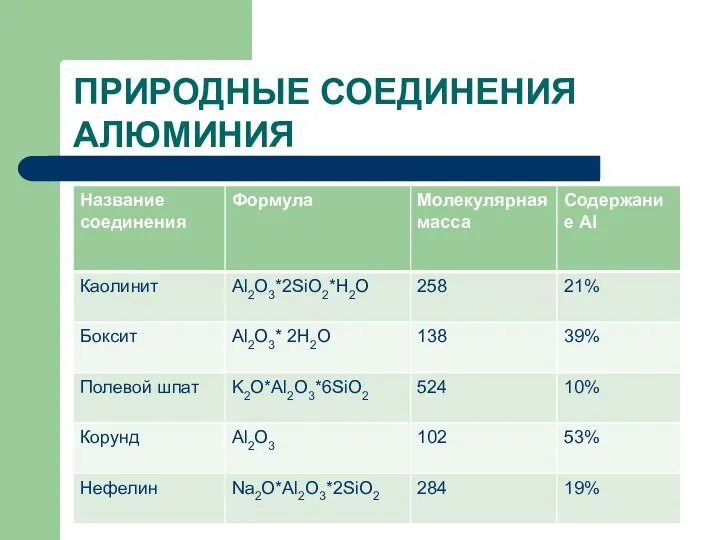
- 13. ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ
- 14. ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ
- 15. Физические свойства
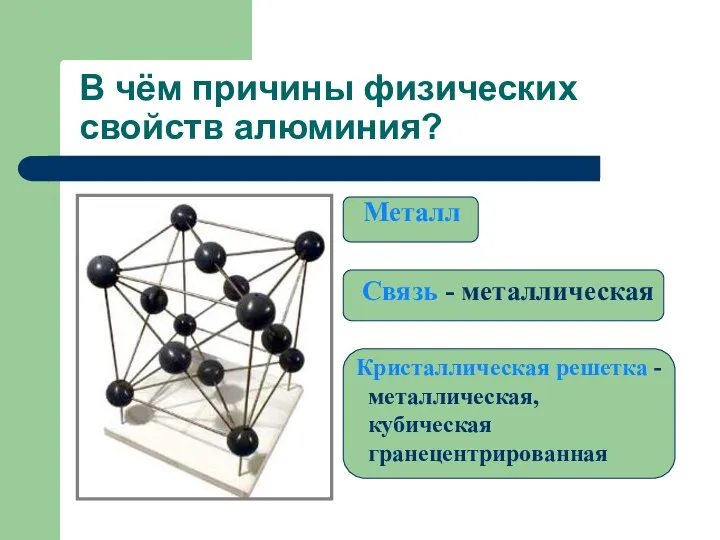
- 16. В чём причины физических свойств алюминия? Металл Связь - металлическая Кристаллическая решетка - металлическая, кубическая гранецентрированная
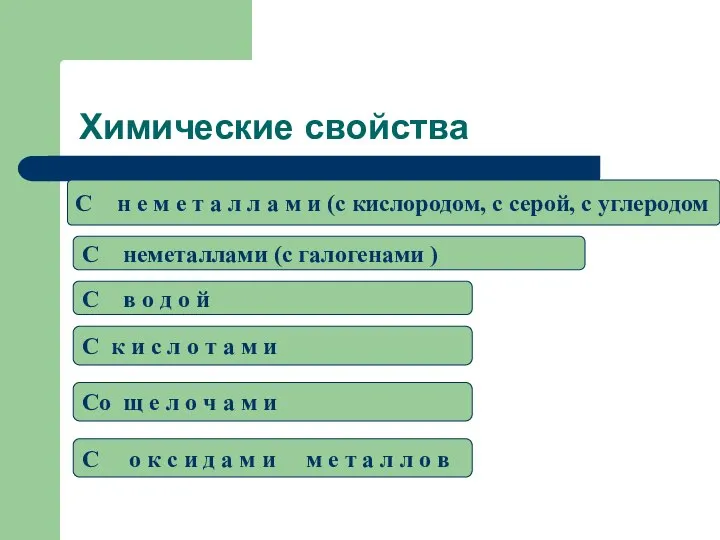
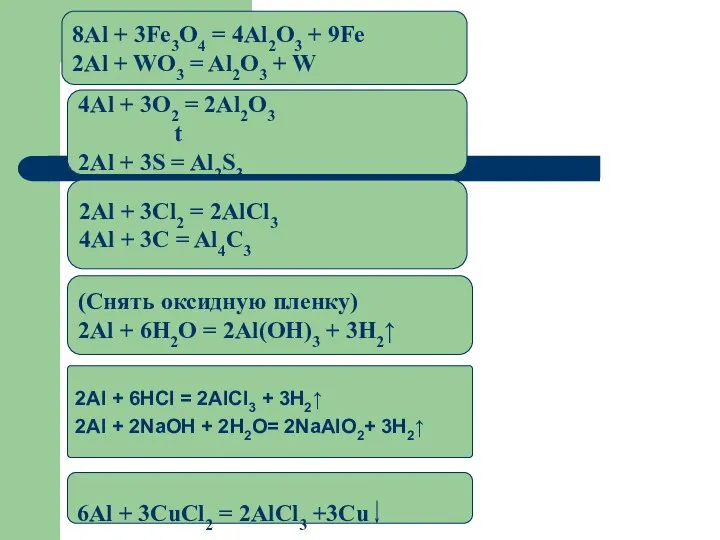
- 17. Химические свойства C н е м е т а л л а м и (c кислородом,
- 19. 2Al + 6HCl = 2AlCl3 + 3H2↑ 2Al + 2NaOH + 2H2O= 2NaAlO2+ 3H2↑ (Снять оксидную
- 20. Химические свойства Алюминий - очень активный металл. В реакциях он проявляет восстановительные свойства. Реагирует с простыми
- 21. Применение алюминия
- 23. Скачать презентацию











 СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ Аттестационная работа. Программа кружка по химии «Юный химик»
Аттестационная работа. Программа кружка по химии «Юный химик» Электронное строение атома. Периодический закон
Электронное строение атома. Периодический закон Кетоны
Кетоны Point defects and diffusion
Point defects and diffusion Презентация по Химии "Презентация Химический состав растений" - скачать смотреть
Презентация по Химии "Презентация Химический состав растений" - скачать смотреть  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Продолжение лекции «Химическая связь»
Продолжение лекции «Химическая связь» Коллоидно-химические свойства и методы определения дисперсности НДС. Лекция 3
Коллоидно-химические свойства и методы определения дисперсности НДС. Лекция 3 Обмен липидов
Обмен липидов Неорганические вещества, входящие в состав клетки
Неорганические вещества, входящие в состав клетки Биогенные элементы периодической системы
Биогенные элементы периодической системы Опыты в домашних условиях
Опыты в домашних условиях Элементы подгруппы углерода
Элементы подгруппы углерода Химические реакции. Изменение степеней окисления
Химические реакции. Изменение степеней окисления Виды химической связи
Виды химической связи Характеристика азота и фосфора. Свойства азота
Характеристика азота и фосфора. Свойства азота Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции Решение задач на избыток и недостаток
Решение задач на избыток и недостаток Углерод. 9 класс
Углерод. 9 класс Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена
Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена  Одноатомные спирты
Одноатомные спирты Количество вещества
Количество вещества Классификация органических реакций в органической химии
Классификация органических реакций в органической химии Игра по химии Разработала учитель химии МОУ «Яльчикская СОШ» Левая В.Н.
Игра по химии Разработала учитель химии МОУ «Яльчикская СОШ» Левая В.Н. Пигменті в реставрации декоративно-прикладного искусства
Пигменті в реставрации декоративно-прикладного искусства БЫТОВАЯ ХИМИЯ. МОЮЩИЕ СРЕДСТВА МОУ СОШ № 95 Советского района городского округа г.Уфа
БЫТОВАЯ ХИМИЯ. МОЮЩИЕ СРЕДСТВА МОУ СОШ № 95 Советского района городского округа г.Уфа Сапропель және бактериалды тыңайтқыштар және қордалар
Сапропель және бактериалды тыңайтқыштар және қордалар