Содержание
- 2. Атом А́том— наименьшая часть химического элемента, являющаяся носителем его свойств. Ядро атома состоит из положительно заряженных
- 3. Электронная атомная орбиталь АО Область электронного облака, в котором электрон проводит более 95% времени, называется электронной
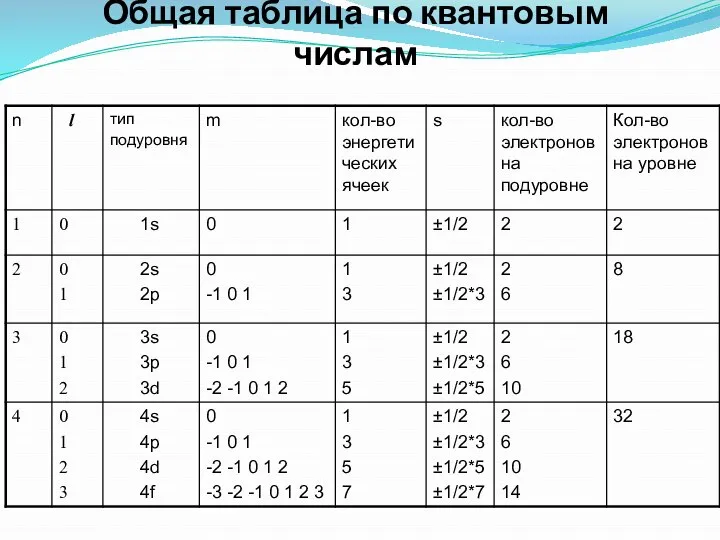
- 4. Квантовые числа Главное квантовое число n Орбитальное квантовое число l Магнитное квантовое число m Спиновое квантовое
- 5. Главное квантовое число Главное квантовое число может принимать положительные целочисленные значения: n=1, 2, 3,..7..,∞ Главное квантовое
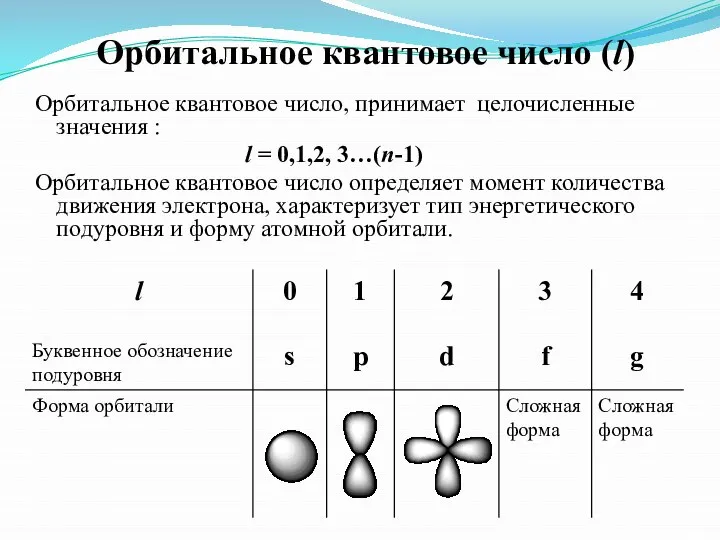
- 6. Орбитальное квантовое число (l) Орбитальное квантовое число, принимает целочисленные значения : l = 0,1,2, 3…(n-1) Орбитальное
- 7. Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Например, Т.о., энергетический подуровень – это
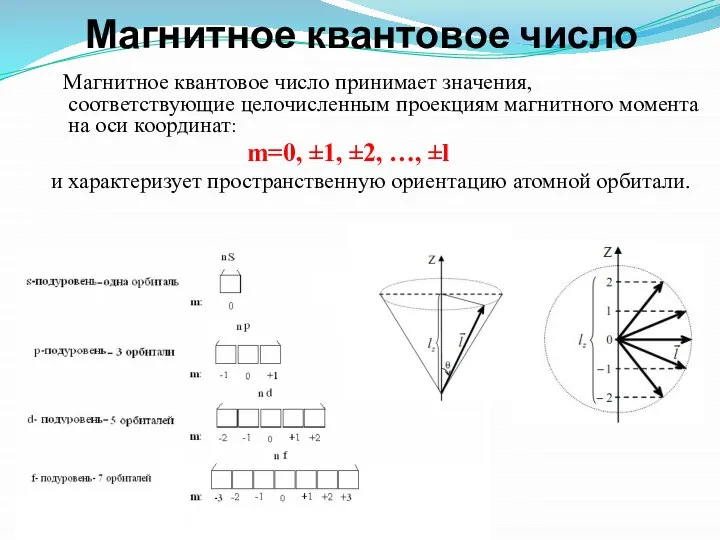
- 8. Магнитное квантовое число Магнитное квантовое число принимает значения, соответствующие целочисленным проекциям магнитного момента на оси координат:
- 9. Оно принимает все целочисленные значения от – l до + l. Например, при l =0 ml
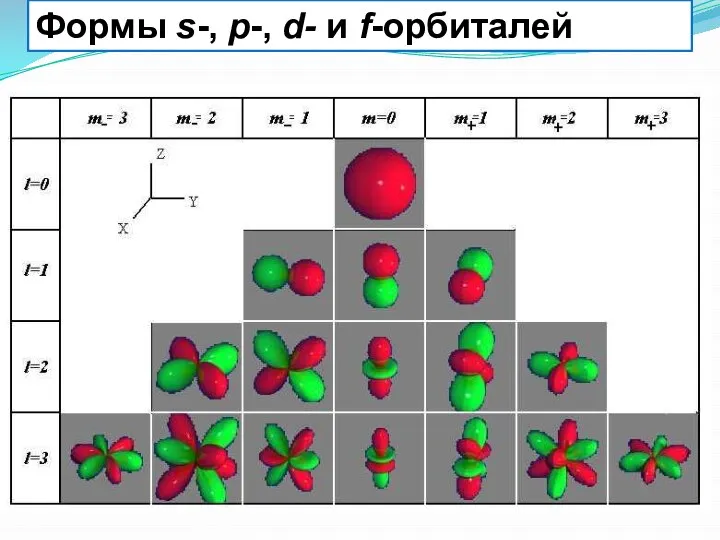
- 12. Формы s-, p-, d- и f-орбиталей
- 13. Спиновое число (s) Спиновое число -«СПИН» - определяется собственным моментом вращения электрона в двух противоположных направлениях.
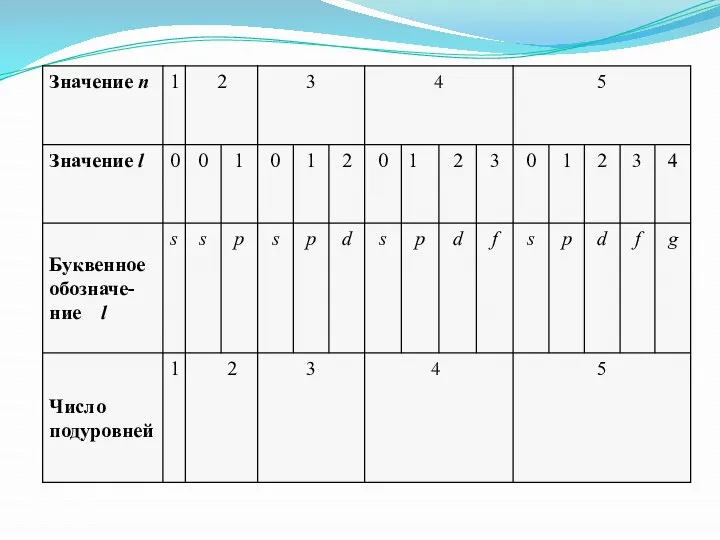
- 14. Общая таблица по квантовым числам
- 15. При составлении электронных конфигураций многоэлектронных атомов учитывают: 1.Принцип минимума энергии 2. Правило Клечковского 3. Запрет Паули
- 16. Последовательность заполнения электронных подуровней 1. Принцип минимума энергии Наиболее устойчивое состояние электрона в атоме соответствует наименьшему
- 17. Применим правило Клечковского …3s 3p 3d 4s 4p… (3+0) (3+1) (3+2) (4+0) (4+1) 3 4 5
- 18. 1s 4d≈5s
- 19. 3. Запрет Паули В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых
- 20. При наличии однотипных орбиталей их заполнение происходит в соответствии с правилом Хунда: в пределах энергетического подуровня
- 21. Составление электронных формул 1. полная электронная формула показывает распределение электронов атома по его уровням и подуровням.
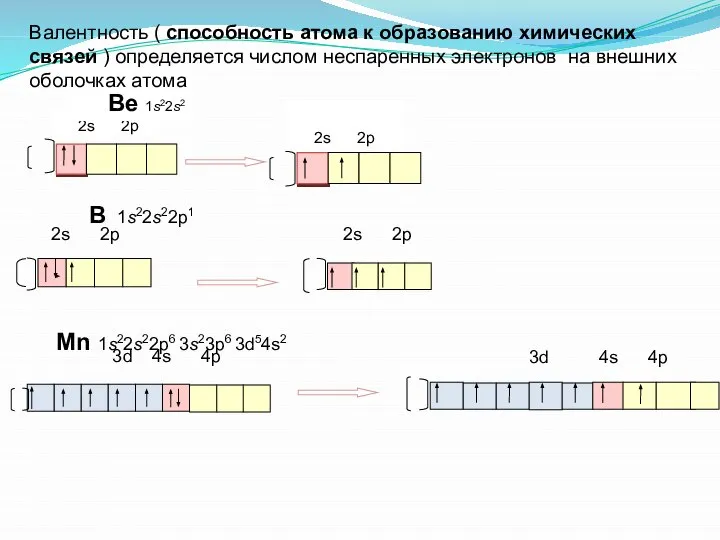
- 22. 3. электронная формула в виде энергетических ячеек. Составляется только для сокращенной электронной формулы. Показывает распределение валентных
- 23. 2s 2p Ве 1s22s2 В 1s22s22p1 Mn 1s22s22p6 3s23p6 3d54s2 2s 2p 2s 2p 3d 4s
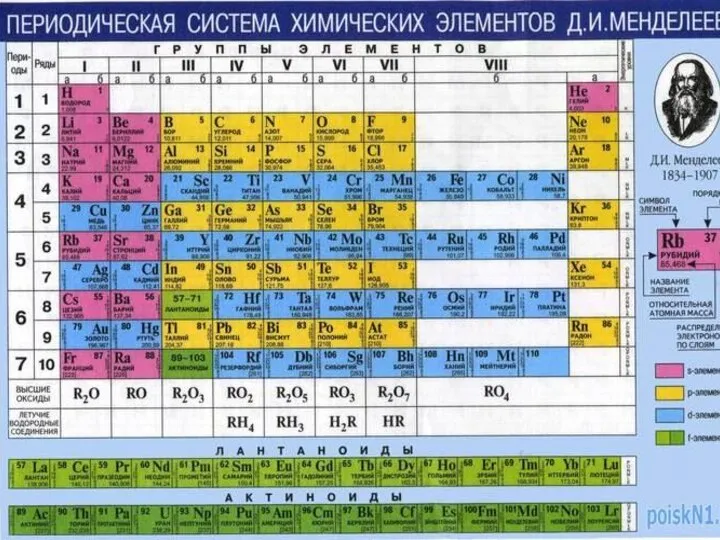
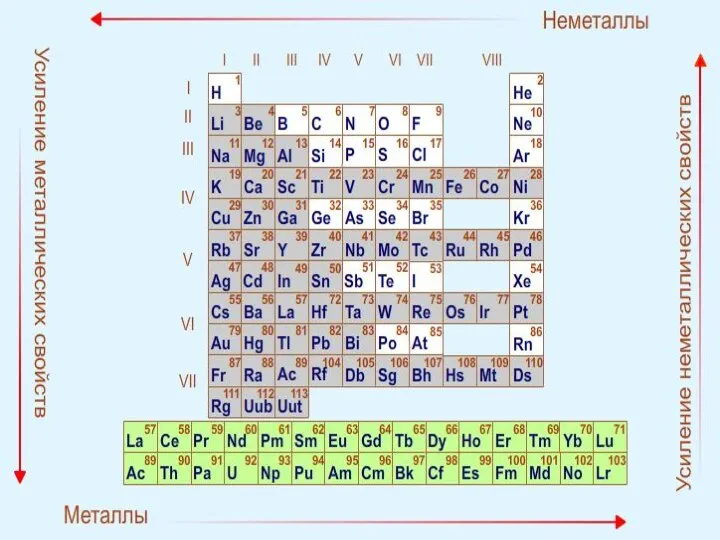
- 24. Периодический закон Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра (порядковый номер).
- 25. Период таблицы Д.И.Менделеева Периодом называется последовательный ряд элементов, размещенных в порядке возрастания заряда ядра атомов, электронная
- 26. Элементы, расположенные в одной подгруппе Периодической системы, являются электронными аналогами. 8O[ ]2s22p6; 16S[ ]3s23p6; 34Se[ ]4s24p6
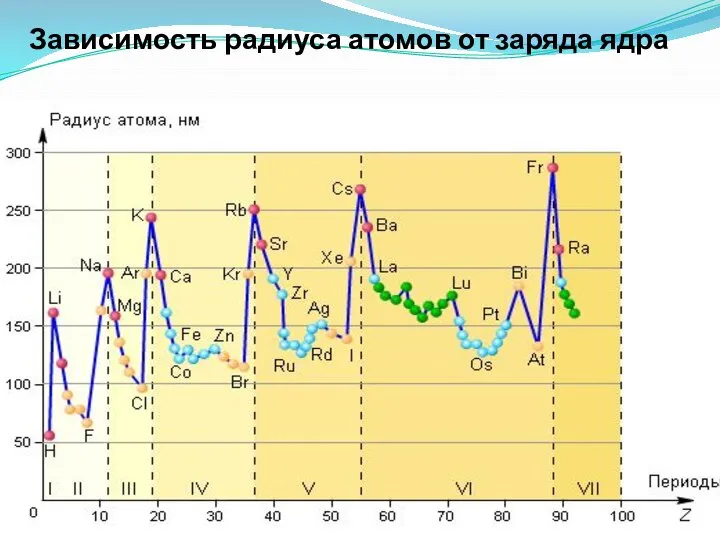
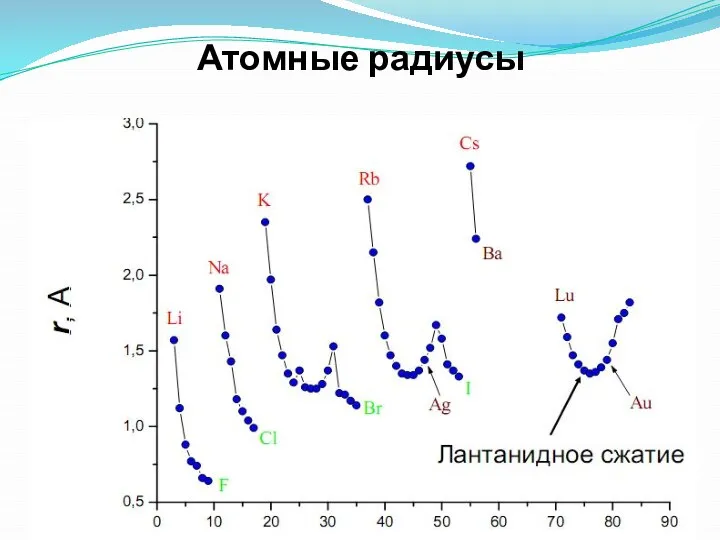
- 28. Атомный радиус Орбитальный атомный радиус- это условная величина, которая равна расстоянию между ядром и самой дальней
- 29. при этом в главных подгруппах такое увеличение происходит в большей степени, чем в побочных подгруппах .
- 30. Зависимость радиуса атомов от заряда ядра
- 31. Атомные радиусы
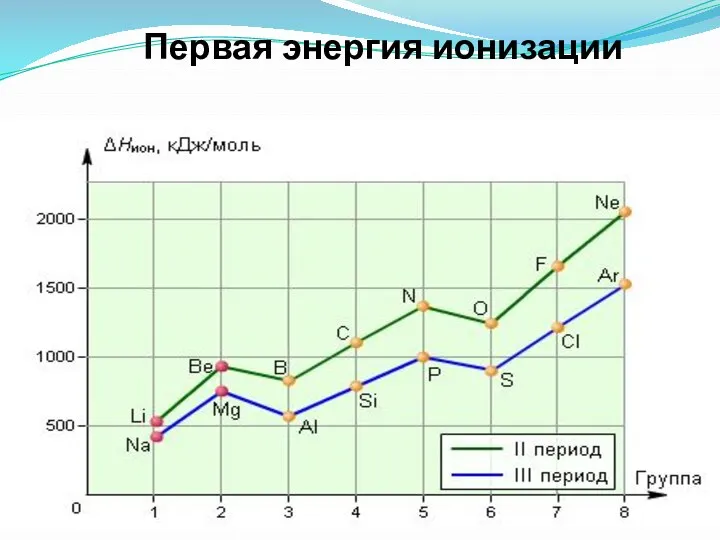
- 32. Энергия ионизации Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома.
- 33. Первая энергия ионизации
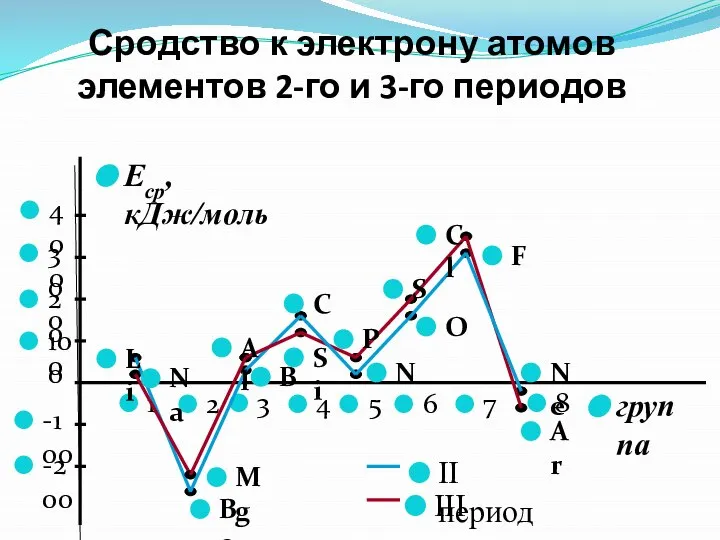
- 34. Сродство к электрону атомов элементов 2-го и 3-го периодов
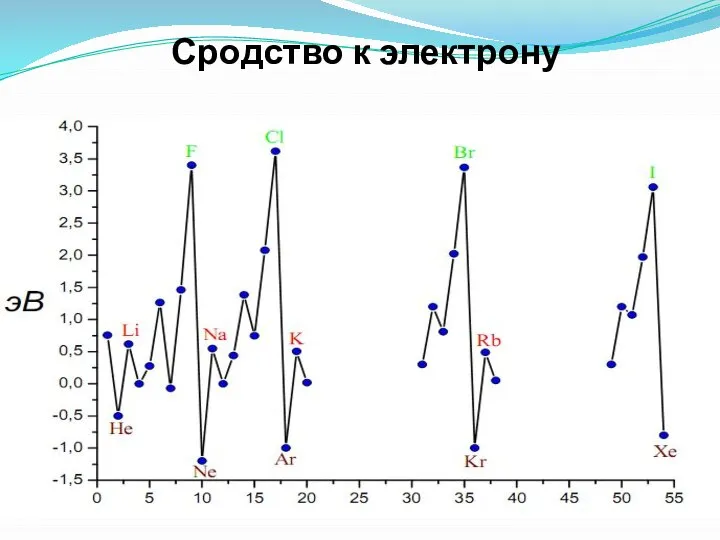
- 35. Сродство к электрону
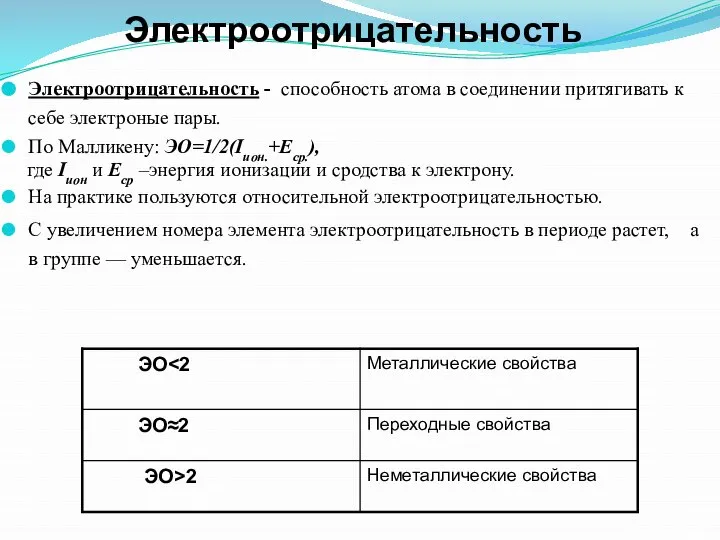
- 36. Электроотрицательность Электроотрицательность - способность атома в соединении притягивать к себе электроные пары. По Малликену: ЭО=1/2(Iион.+Eср.), где
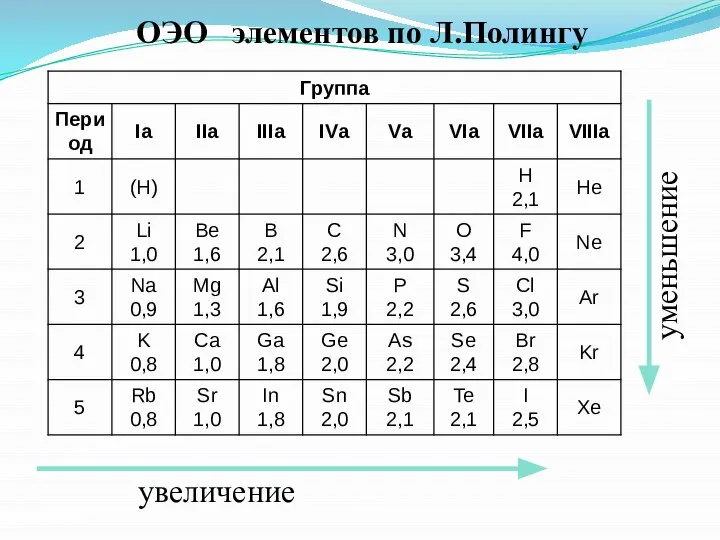
- 37. увеличение уменьшение ОЭО элементов по Л.Полингу
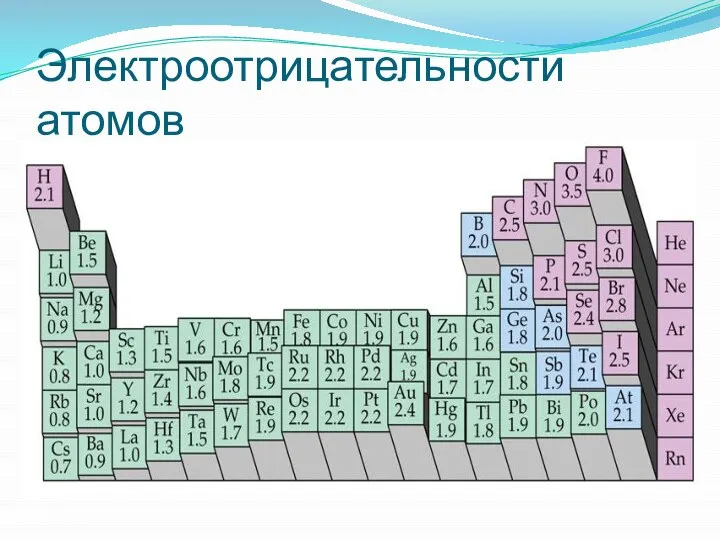
- 38. Электроотрицательности атомов
- 41. Скачать презентацию






















 Н2O Матвієнко А. 10-а
Н2O Матвієнко А. 10-а  Зола. Свойства щёлока
Зола. Свойства щёлока Химические свойства металлов. (9 класс)
Химические свойства металлов. (9 класс) Ди- және полисахаридтер
Ди- және полисахаридтер История спички Выполнил ученик 9 б класса МОУ Навлинская СОШ №1 Фролов Кирилл
История спички Выполнил ученик 9 б класса МОУ Навлинская СОШ №1 Фролов Кирилл Химия в быту
Химия в быту Investigation of the conditions for the synthesis of a silver - containing composite
Investigation of the conditions for the synthesis of a silver - containing composite ПИЩЕВЫЕ ДОБАВКИ-Е Выполнила ученица 10 класса Цатурова Аида Арташевна
ПИЩЕВЫЕ ДОБАВКИ-Е Выполнила ученица 10 класса Цатурова Аида Арташевна Тема урока: Силикатная промышленность
Тема урока: Силикатная промышленность Периодический закон Менделеева в действии
Периодический закон Менделеева в действии Презентация Предельные углеводороды
Презентация Предельные углеводороды  Электродные процессы
Электродные процессы Уксусная кислота (эта́новая кислота)
Уксусная кислота (эта́новая кислота) Вредны или полезны сладкие газированные напитки
Вредны или полезны сладкие газированные напитки Качественный анализ и его методы
Качественный анализ и его методы Образование растворов ВМС
Образование растворов ВМС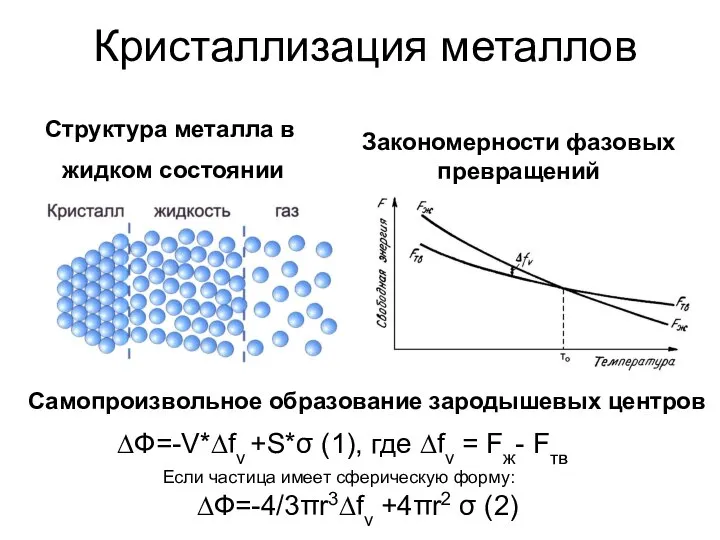 Закономерности фазовых превращений
Закономерности фазовых превращений Химические элементы космоса.
Химические элементы космоса. Шлюмберже Бұрғылау жабдығы және жөндеу (БЖ жәнеЖ) Джалал Каримов Атырау 2 шілде, 2013
Шлюмберже Бұрғылау жабдығы және жөндеу (БЖ жәнеЖ) Джалал Каримов Атырау 2 шілде, 2013 Соли
Соли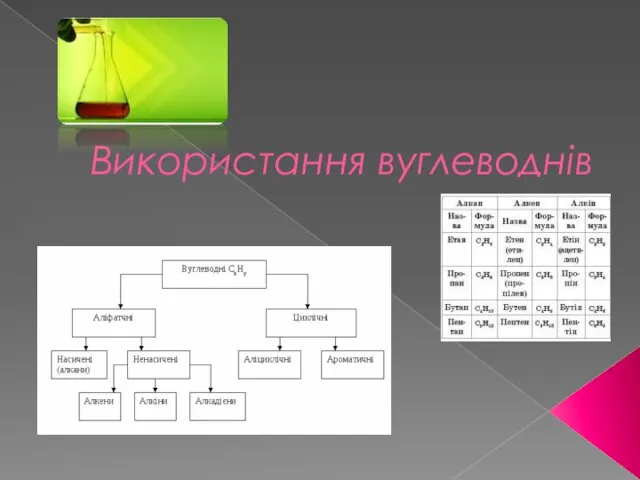 Використання вуглеводнів
Використання вуглеводнів Должностные обязанности Инструкции по ТБ и ОТ Реактивы Паспорт кабинета химии
Должностные обязанности Инструкции по ТБ и ОТ Реактивы Паспорт кабинета химии Полісахариди харчових продуктів і їх властивості. Лекція 4
Полісахариди харчових продуктів і їх властивості. Лекція 4 Технологии создания и обработки кристаллических материалов
Технологии создания и обработки кристаллических материалов Виды присадок к моторному топливу. Керосин
Виды присадок к моторному топливу. Керосин Исследование воздействия плазмы метана на свойства оксида графена
Исследование воздействия плазмы метана на свойства оксида графена Термодинамика химических процессов
Термодинамика химических процессов History of radioactivity
History of radioactivity