Содержание
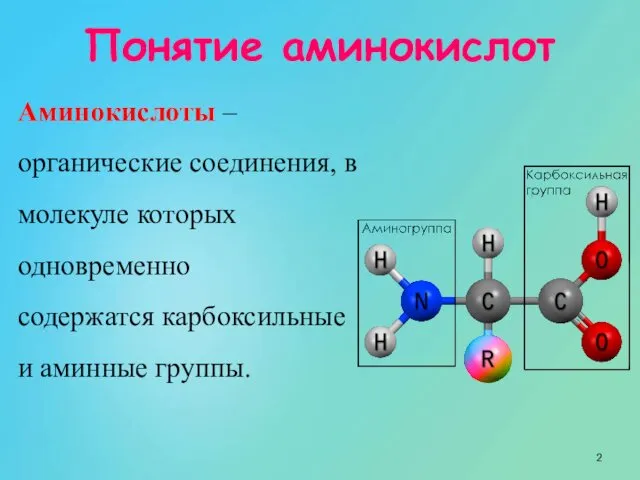
- 2. Аминокислоты – органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Понятие аминокислот
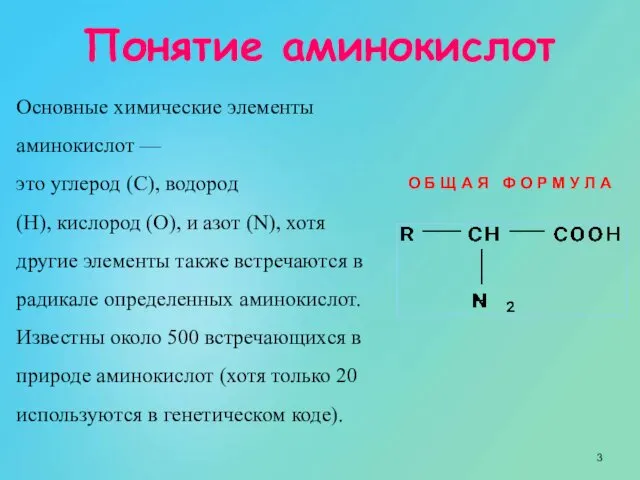
- 3. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O), и азот (N), хотя
- 4. Природа химической связи в аминокислотах боковой радикал основная группа кислотная группа
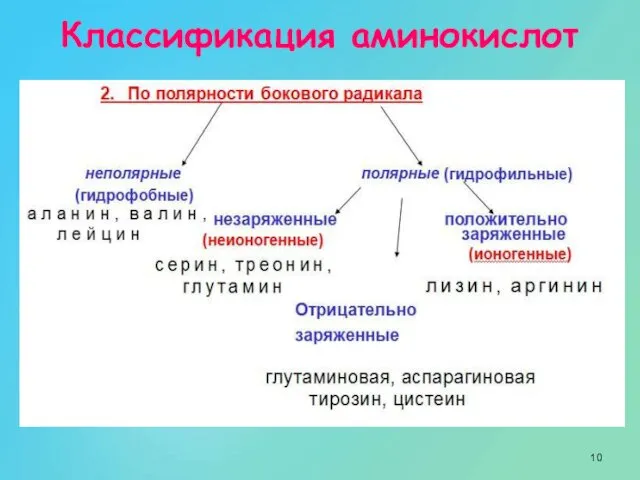
- 5. Классификация аминокислот Для аминокислот существует несколько классификаций в зависимости от того, какой признак положен в основу.
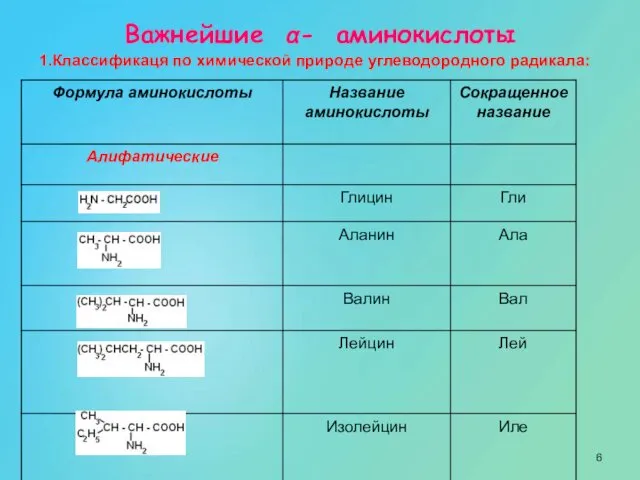
- 6. Важнейшие α- аминокислоты 1.Классификаця по химической природе углеводородного радикала:
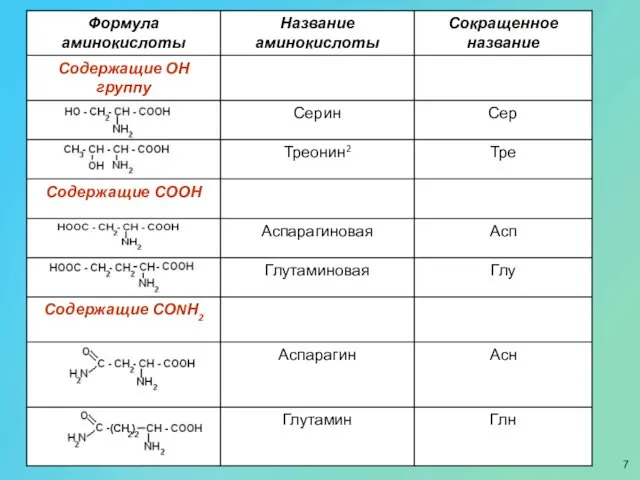
- 9. Формула аминокислоты
- 10. Классификация аминокислот
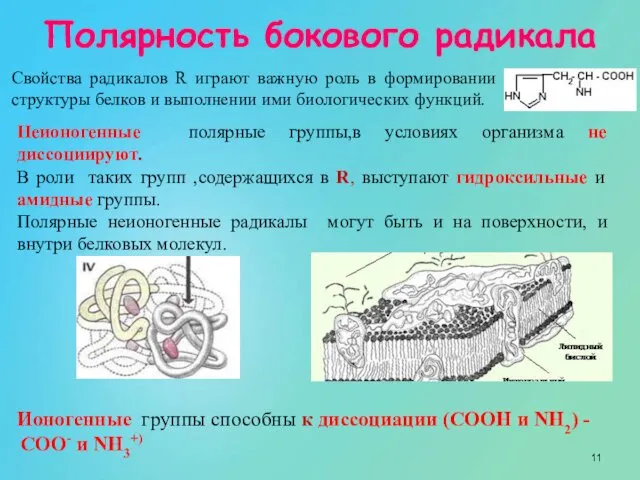
- 11. Свойства радикалов R играют важную роль в формировании структуры белков и выполнении ими биологических функций. Неионогенные
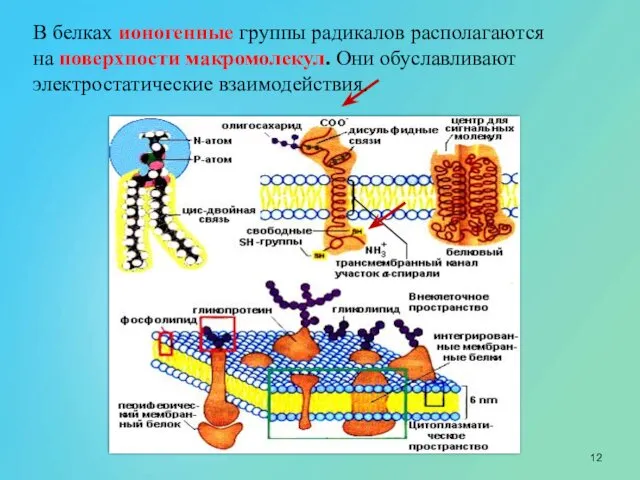
- 12. В белках ионогенные группы радикалов располагаются на поверхности макромолекул. Они обуславливают электростатические взаимодействия.
- 13. 1 амино- и 1 карбоксильная группа – нейтральные 1 амино- 2 карбоксильные группы – кислые 2
- 14. По положению аминогруппы различают α, β, γ, ε – структурные изомеры. CH2 CH2 COOH NH2 3-аминопропановая
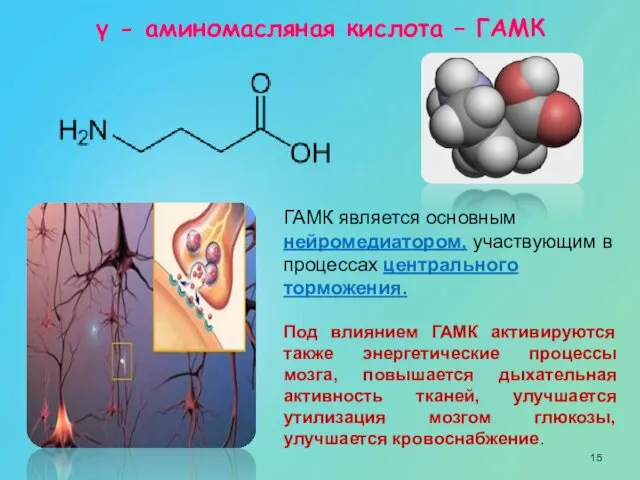
- 15. ГАМК является основным нейромедиатором, участвующим в процессах центрального торможения. Под влиянием ГАМК активируются также энергетические процессы
- 16. γ-Аминомасляная кислота выполняет в организме функцию ингибирующего медиатора центральной нервной системы. При выбросе ГАМК в синаптическую
- 17. Аминокапроновая кислота является антигеморрагическим и гемостатическим препаратом, который обладает специфическим кровоостанавливающим действием при кровотечениях. ε –
- 18. Структурные изомеры аминокислот можно различить по их отношению к нагреванию . Эти свойства аналогичны поведению α,
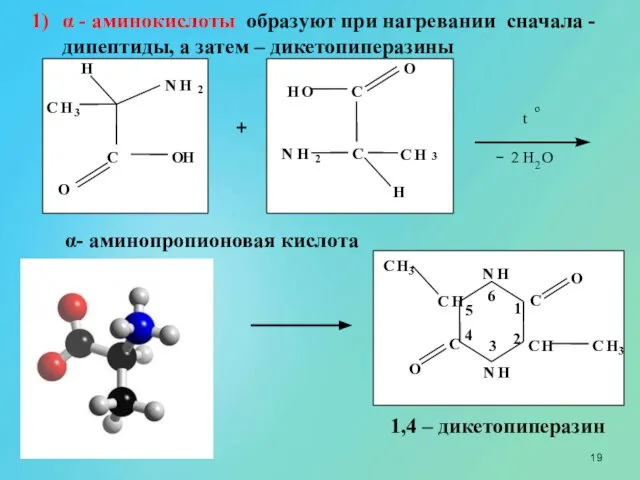
- 19. α - аминокислоты образуют при нагревании сначала - дипептиды, а затем – дикетопиперазины α- аминопропионовая кислота
- 20. 2) β - аминокислоты образуют при нагревании непредельные кислоты. 3-аминопропановая кислота β-аланин Пропеновая, акриловая кислота Акриловая
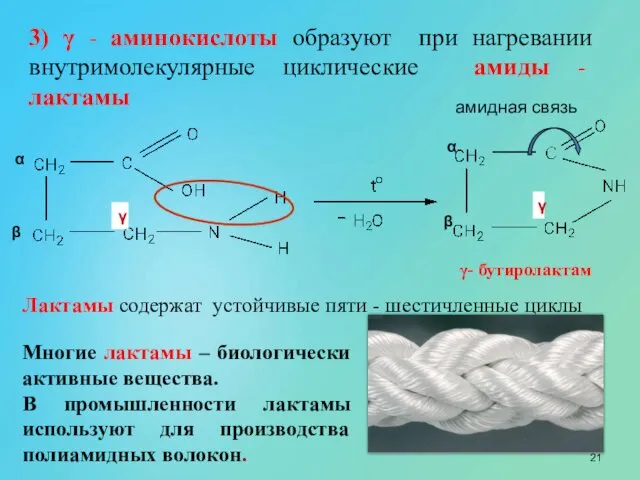
- 21. амидная связь α β α β 3) γ - аминокислоты образуют при нагревании внутримолекулярные циклические амиды
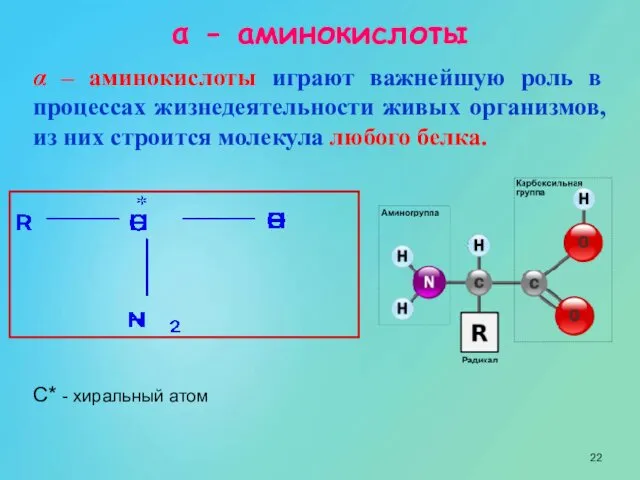
- 22. α - аминокислоты α – аминокислоты играют важнейшую роль в процессах жизнедеятельности живых организмов, из них
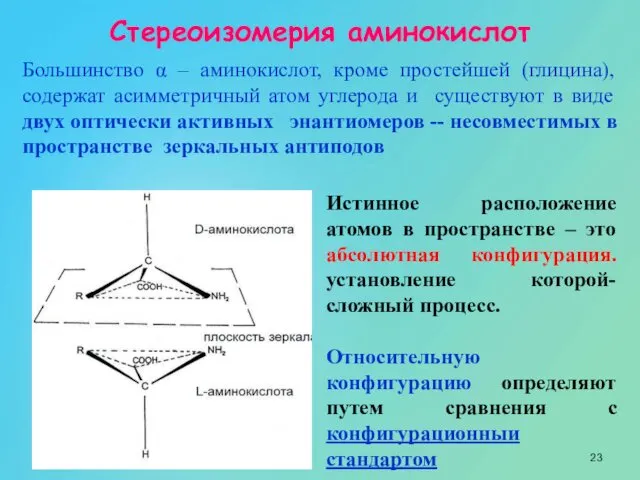
- 23. Стереоизомерия аминокислот Большинство α – аминокислот, кроме простейшей (глицина), содержат асимметричный атом углерода и существуют в
- 24. L – α - аминокислота D – α - аминокислота Большинство природных аминокислот относятся к L
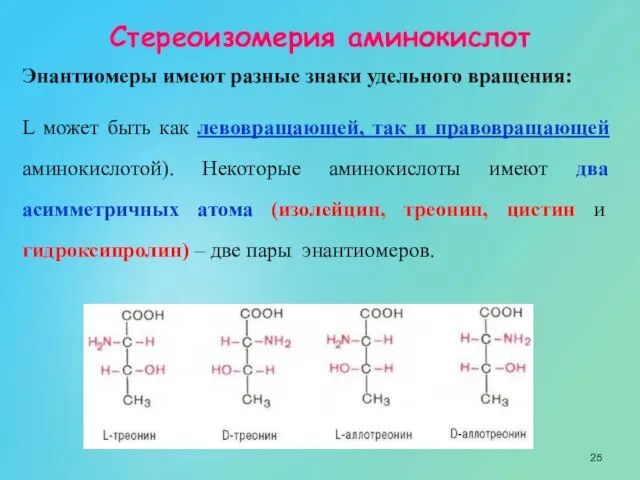
- 25. Стереоизомерия аминокислот Энантиомеры имеют разные знаки удельного вращения: L может быть как левовращающей, так и правовращающей
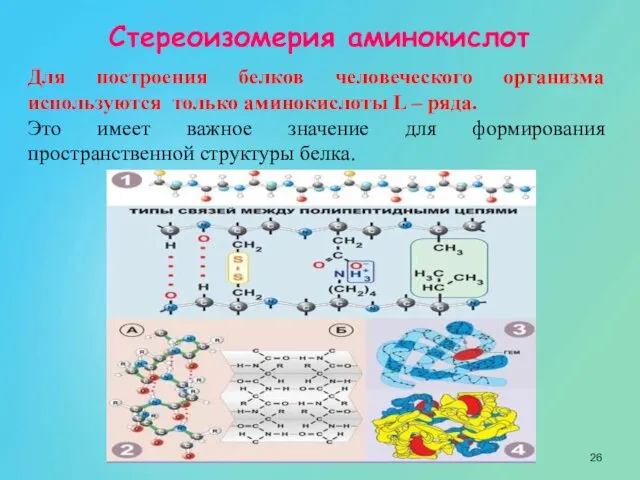
- 26. Стереоизомерия аминокислот Для построения белков человеческого организма используются только аминокислоты L – ряда. Это имеет важное
- 27. D – аминокислоты (неприродные) встречаются во многих природных пептидах, образованных с помощью микроорганизмов, в антибиотиках (грамицидин,
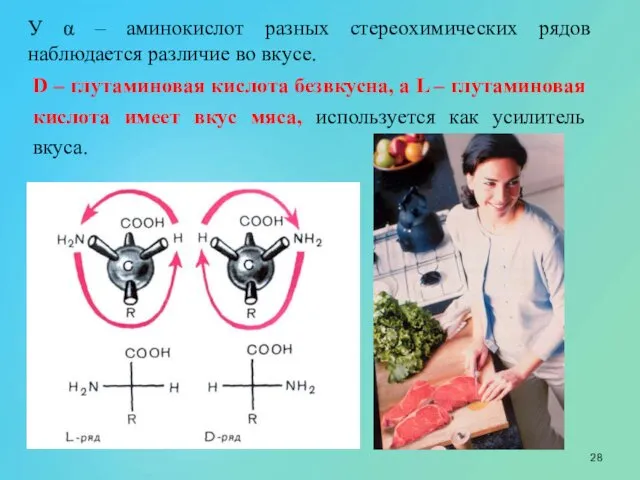
- 28. У α – аминокислот разных стереохимических рядов наблюдается различие во вкусе. D – глутаминовая кислота безвкусна,
- 29. Номенклатура аминокислот Для названия аминокислот используют три типа номенклатуры –тривиальную, рациональнцю и IUPAC. По систематической номенклатуре
- 30. Номенклатура аминокислот По рациональной номенклатуре к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения
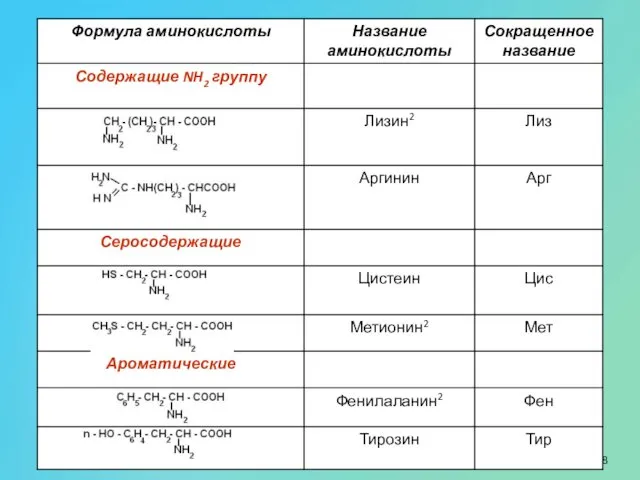
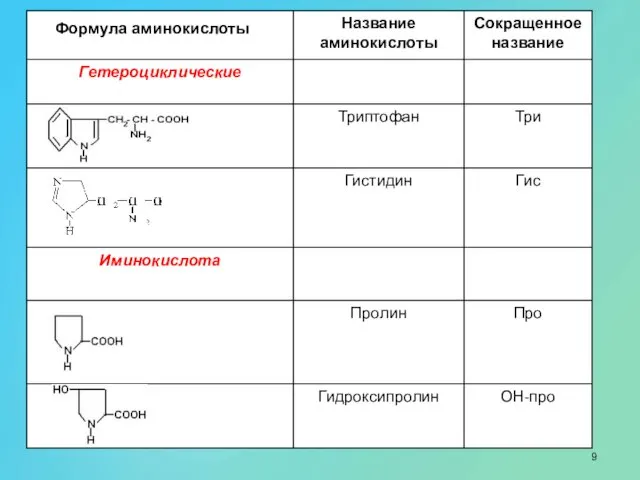
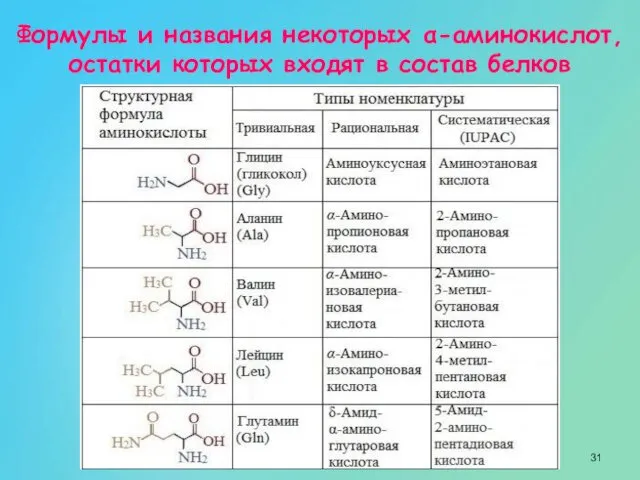
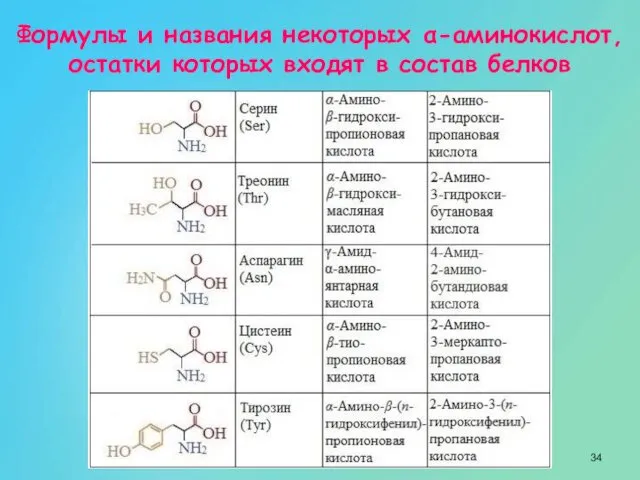
- 31. Формулы и названия некоторых α-аминокислот, остатки которых входят в состав белков
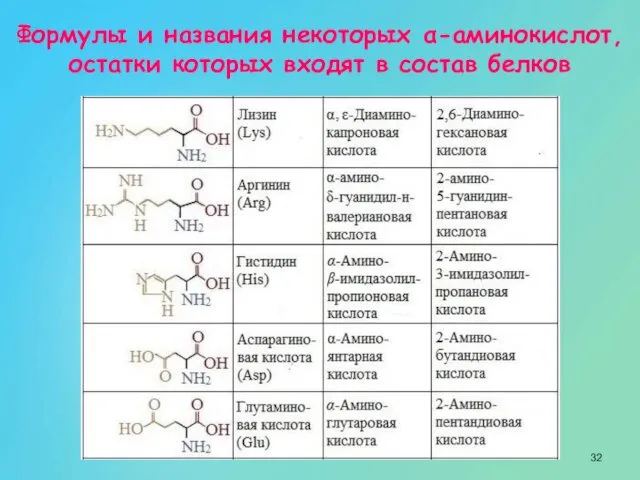
- 32. Формулы и названия некоторых α-аминокислот, остатки которых входят в состав белков
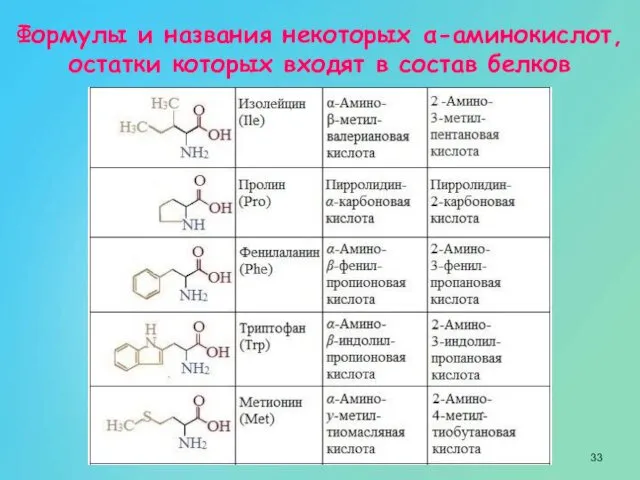
- 33. Формулы и названия некоторых α-аминокислот, остатки которых входят в состав белков
- 34. Формулы и названия некоторых α-аминокислот, остатки которых входят в состав белков
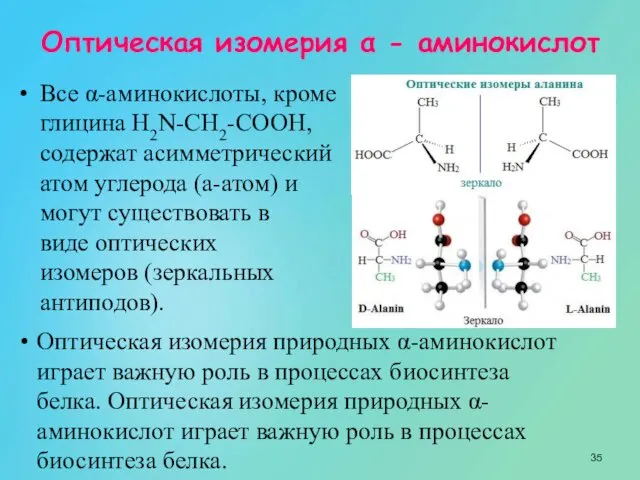
- 35. Оптическая изомерия α - аминокислот Все α-аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (a-атом) и
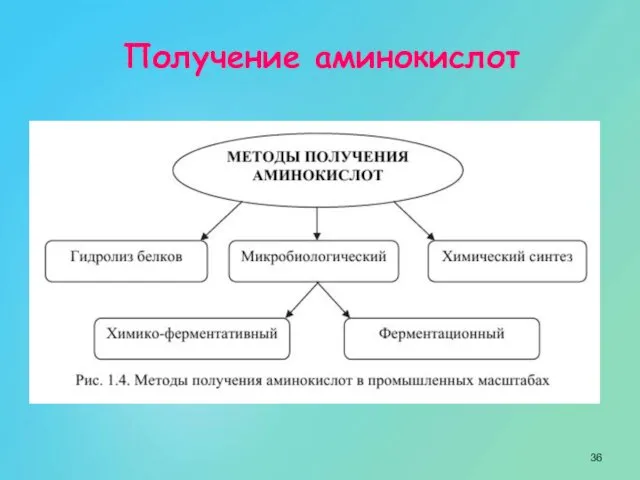
- 36. Получение аминокислот .
- 37. Получение аминокислот гидролизом белка При гидролизе белоксодержащее сырье (отходы пищевой и молочной промышленности) нагревают с растворами
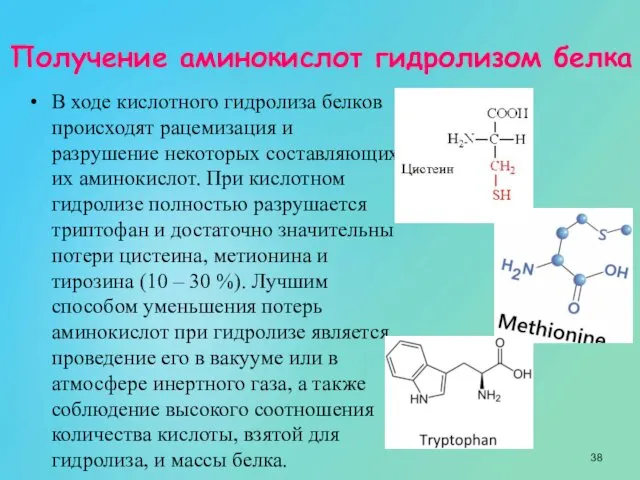
- 38. Получение аминокислот гидролизом белка В ходе кислотного гидролиза белков происходят рацемизация и разрушение некоторых составляющих их
- 39. Получение аминокислот гидролизом белка Реакцию гидролиза с образованием аминокислот в общем виде можно записать так:
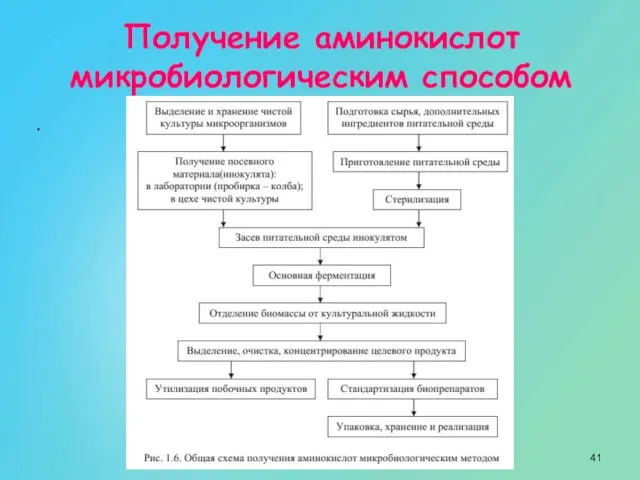
- 40. Получение аминокислот микробиологическим способом . Наиболее перспективен и экономически выгоден микробиологический синтез аминокислот. Более 60 %
- 41. Получение аминокислот микробиологическим способом .
- 42. Получение аминокислот микробиологическим способом . Процесс получения аминокислот химико-ферментативным методом заключается в химическом синтезе предшественника аминокислоты
- 43. Получение аминокислот микробиологическим способом Процесс получения аминокислот ферментационным методом основан на способности некоторых микроорганизмов синтезировать L-аминокислоты,
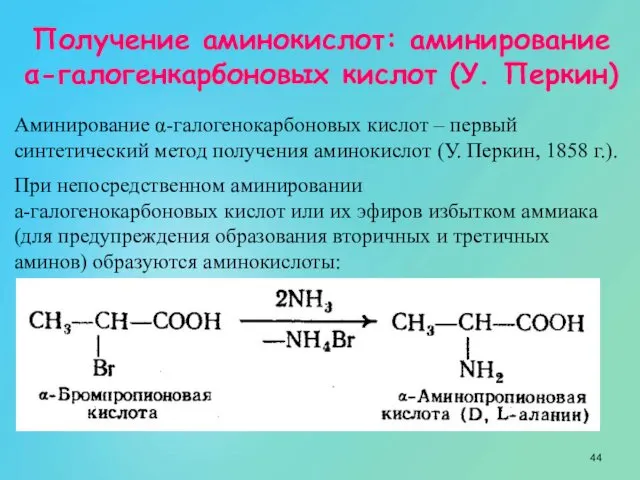
- 44. Получение аминокислот: аминирование α-галогенкарбоновых кислот (У. Перкин) Аминирование α-галогенокарбоновых кислот – первый синтетический метод получения аминокислот
- 45. Получение аминокислот: из карбонильных соединений (Штреккер, Н.Д. Зелинский) Синтез а-аминокислот по Штреккеру сводится к реакции карбонильного
- 46. Получение аминокислот: из карбонильных соединений (Штреккер, Н.Д. Зелинский) Реакции присоединения — отщепления с участием аммиака и
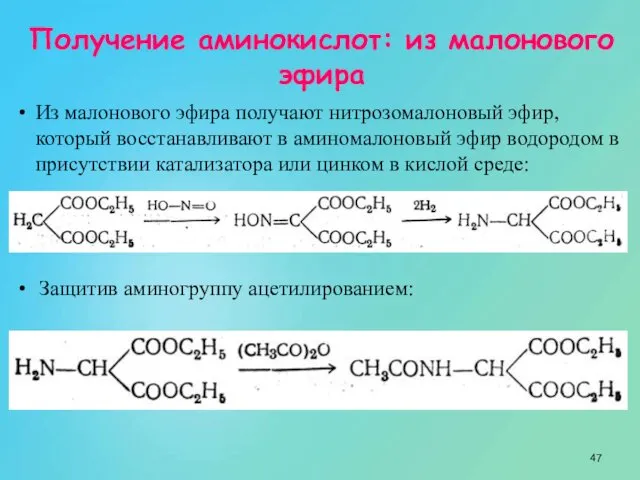
- 47. Получение аминокислот: из малонового эфира Из малонового эфира получают нитрозомалоновый эфир, который восстанавливают в аминомалоновый эфир
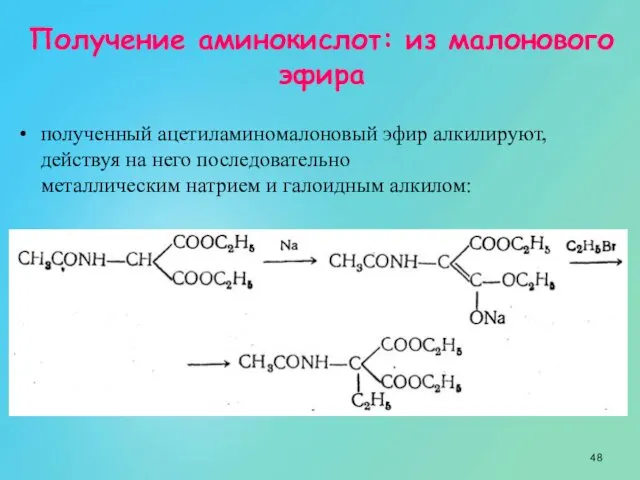
- 48. Получение аминокислот: из малонового эфира полученный ацетиламиномалоновый эфир алкилируют, действуя на него последовательно металлическим натрием и
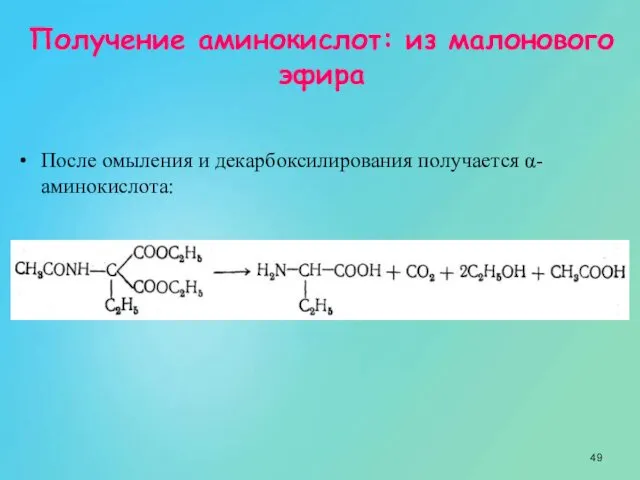
- 49. Получение аминокислот: из малонового эфира После омыления и декарбоксилирования получается α-аминокислота:
- 50. Получение аминокислот: из малонового эфира Синтез аминокислот с использованием эфиров нитроуксусной кислоты:
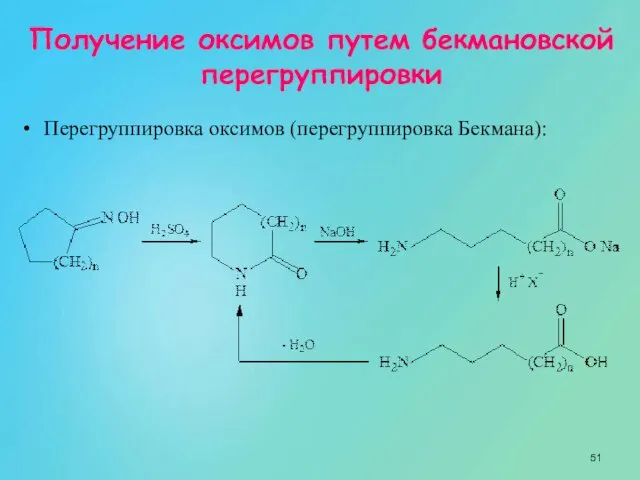
- 51. Получение оксимов путем бекмановской перегруппировки Перегруппировка оксимов (перегруппировка Бекмана):
- 52. Получение аминокислот теломеризацией этилена и четыреххлористого углерода Присоединение аммиака к продуктам теломеризации, (оборванная цепная полимеризация с
- 53. кислотно-основные свойства, то есть амфотерные свойства карбоксильной группы (образование функциональных производных – реакции SN). свойства аминогруппы
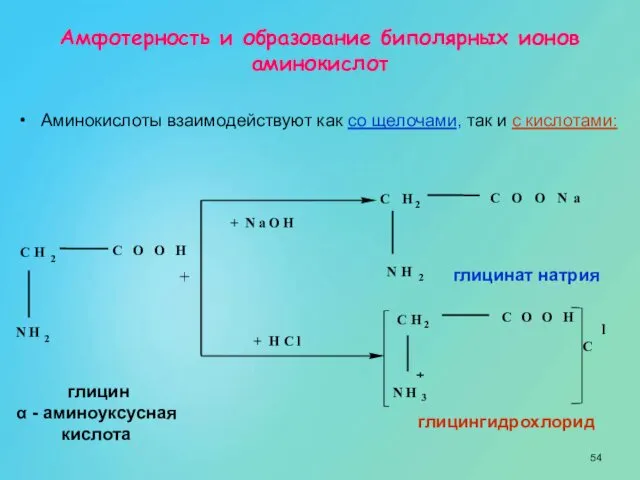
- 54. + глицингидрохлорид глицинат натрия глицин α - аминоуксусная кислота Аминокислоты взаимодействуют как со щелочами, так и
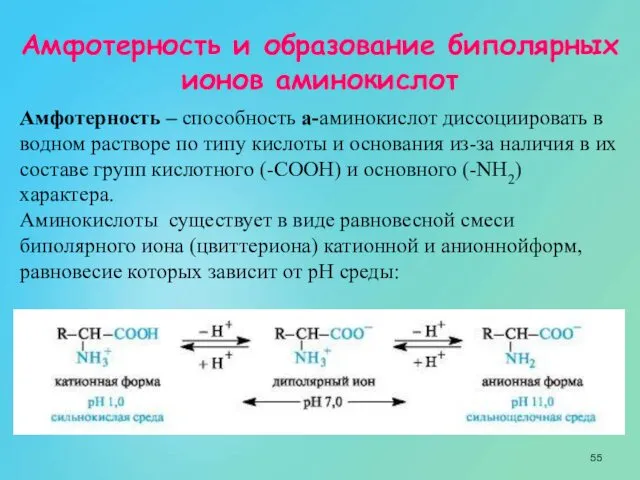
- 55. Амфотерность и образование биполярных ионов аминокислот Амфотерность – способность a-аминокислот диссоциировать в водном растворе по типу
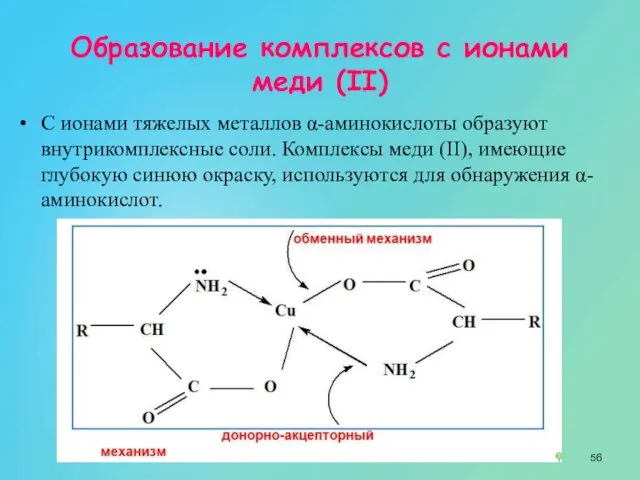
- 56. Образование комплексов с ионами меди (II) С ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди
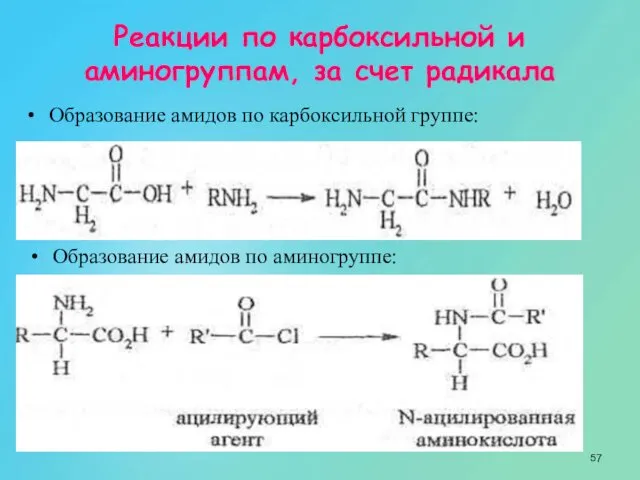
- 57. Реакции по карбоксильной и аминогруппам, за счет радикала Образование амидов по карбоксильной группе: Образование амидов по
- 58. Дезаминирование α- аминокислот Дезаминирование АК — реакция отщепления α-аминогруппы от АК, в результате чего образуется соответствующая
- 59. Дезаминирование α- аминокислот Прямое дезаминирование – это дезаминирование, которое происходит в 1 стадию с участием одного
- 60. Окислительное дезаминирование Окислительное дезаминирование – самый активный вид прямого дезаминирования АК. Глутаматдегидрогеназа (глу-ДГ) – олигомер, состоящий
- 61. Окислительное дезаминирование Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование α-иминоглутарата, затем
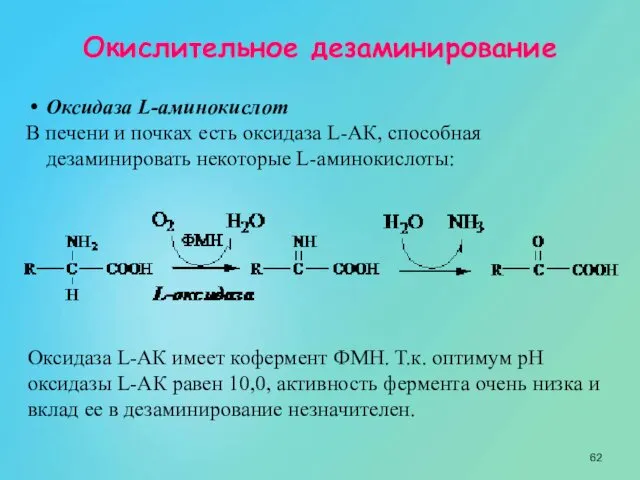
- 62. Окислительное дезаминирование Оксидаза L-аминокислот В печени и почках есть оксидаза L-АК, способная дезаминировать некоторые L-аминокислоты: Оксидаза
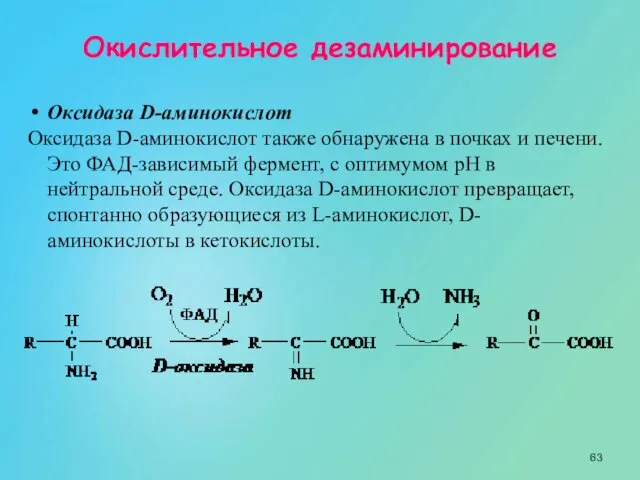
- 63. Окислительное дезаминирование Оксидаза D-аминокислот Оксидаза D-аминокислот также обнаружена в почках и печени. Это ФАД-зависимый фермент, с
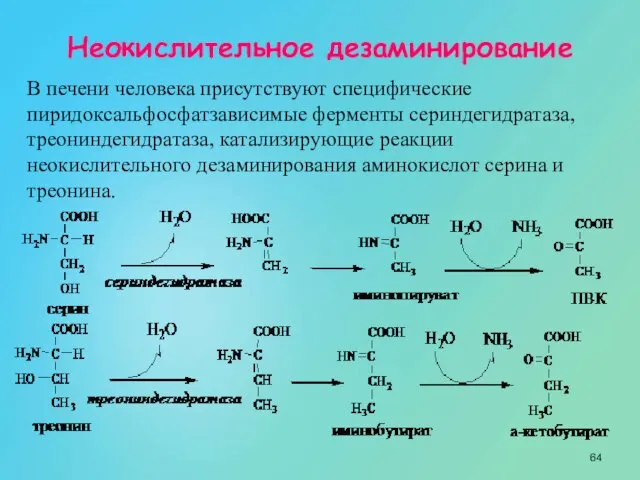
- 64. Неокислительное дезаминирование В печени человека присутствуют специфические пиридоксальфосфатзависимые ферменты сериндегидратаза, треониндегидратаза, катализирующие реакции неокислительного дезаминирования аминокислот
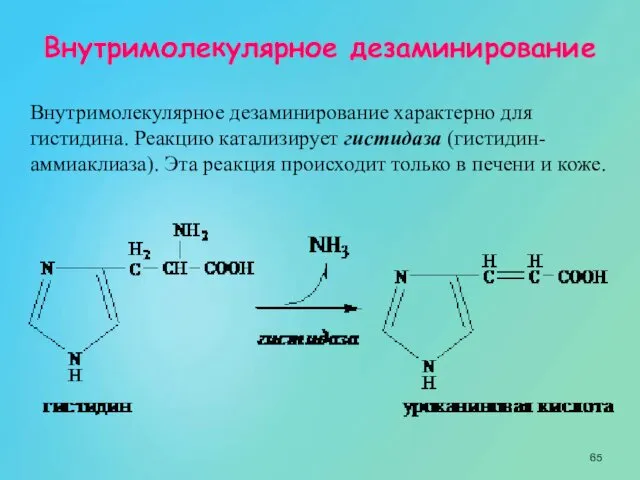
- 65. Внутримолекулярное дезаминирование Внутримолекулярное дезаминирование характерно для гистидина. Реакцию катализирует гистидаза (гистидин-аммиаклиаза). Эта реакция происходит только в
- 66. Отношение к нагреванию α-, β-, γ- аминокислот Превращения аминокислот при нагревании зависят от взаимного расположения карбоксильной
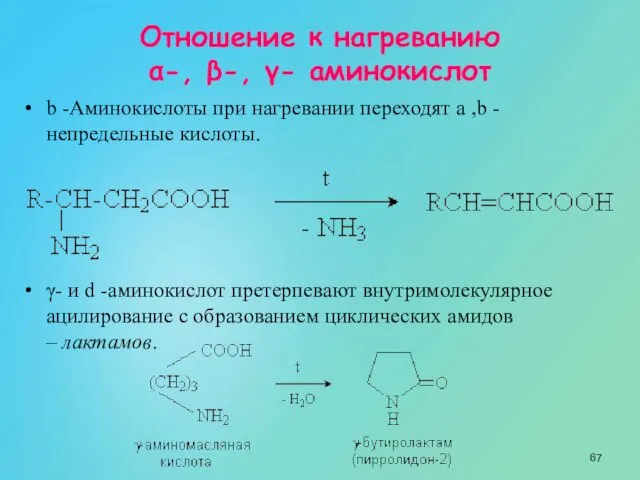
- 67. Отношение к нагреванию α-, β-, γ- аминокислот b -Аминокислоты при нагревании переходят a ,b -непредельные кислоты.
- 68. Полиамидные волокна: капрон Капрон (поли-ε-капроамид, найлон-6, полиамид 6) — синтетическое полиамидное волокно, получаемое из нефти, продукт
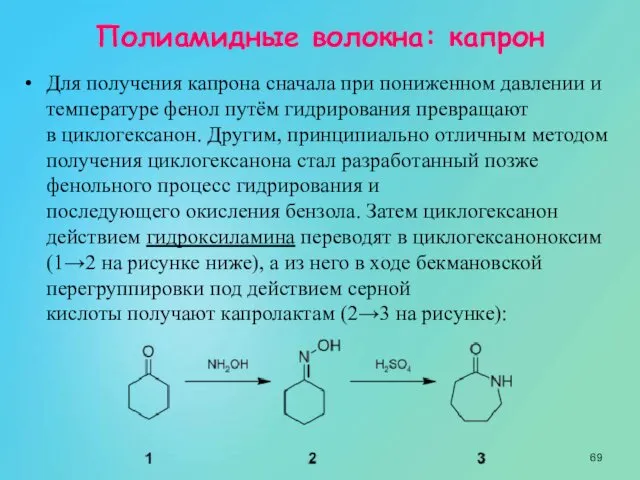
- 69. Полиамидные волокна: капрон Для получения капрона сначала при пониженном давлении и температуре фенол путём гидрирования превращают
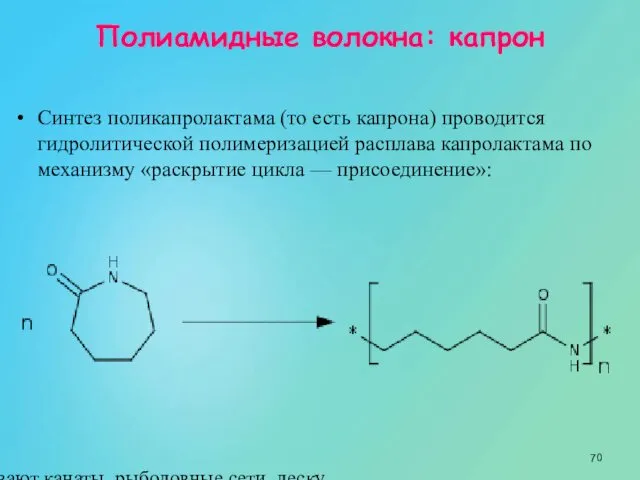
- 70. Полиамидные волокна: капрон Синтез поликапролактама (то есть капрона) проводится гидролитической полимеризацией расплава капролактама по механизму «раскрытие
- 71. Полиамидные волокна: капрон Из капрона изготавливают канаты, рыболовные сети, леску, гитарные струны, фильтровальные материалы, кордную ткань
- 72. Полиамидные волокна: капрон Широкое применение капрон получил в изготовлении парашютов. Он пришёл на смену натуральному шёлку.
- 73. Полиамидные волокна: найлон Найлон (анид, полиамид-6,6); [-СО-(СН2)4-СО-NН-(СН2)6-NН-]n. Получают поликонденсацией двух мономеров: адипиновой кислоты HOOC- (CH2)4-COOH; гексаметилендиамина
- 74. Полиамидные волокна: найлон Найлон вырабатывается в ограниченном количестве. Области применения найлона, как и других полиамидов –
- 75. Полиамидные волокна: анид Волокно анид — производное гексаметилендиамина и адипиновой кислоты. Волокно отличается высокой прочностью на
- 76. Полиамидные волокна: анид Наличие этих связей, являющихся дополнительным скреплением макромолекулярных цепей между собой, и обусловливает отмеченную
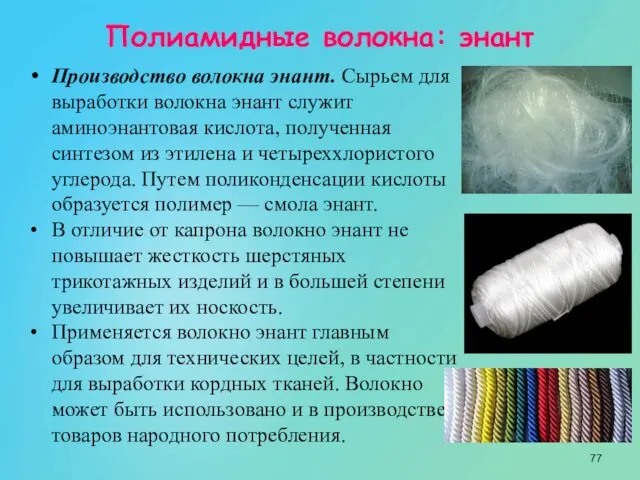
- 77. Полиамидные волокна: энант Производство волокна энант. Сырьем для выработки волокна энант служит аминоэнантовая кислота, полученная синтезом
- 78. Важнейшие аминокислоты Глицин не содержит асимметрического углеродного атома, и поэтому в растворах оптически не активен. Глицин
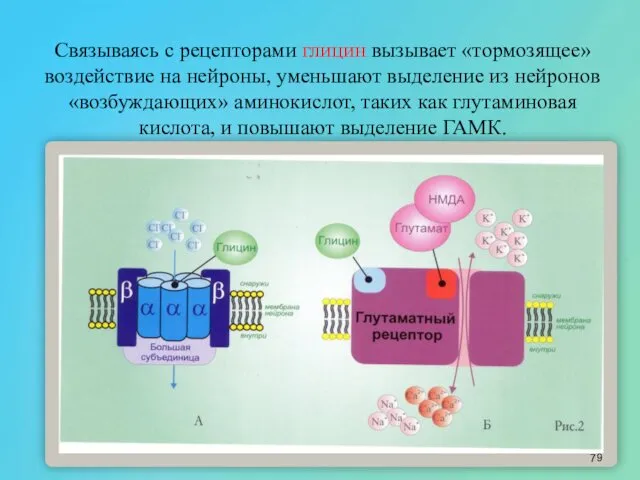
- 79. Связываясь с рецепторами глицин вызывает «тормозящее» воздействие на нейроны, уменьшают выделение из нейронов «возбуждающих» аминокислот, таких
- 80. Цистеин играет большую роль как восстановитель и как источник серы. Один из самых мощных антиоксидантов Окисляясь,
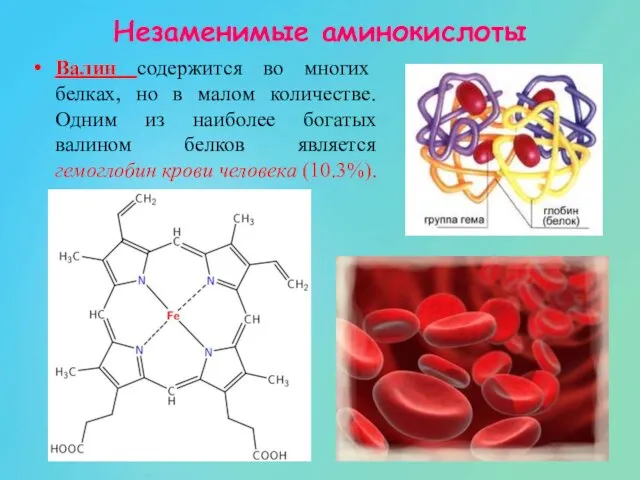
- 81. Валин содержится во многих белках, но в малом количестве. Одним из наиболее богатых валином белков является
- 82. Лейцин содержится во всех белках в значительном количестве. В заметном количестве содержится в прорастающем зерне, при
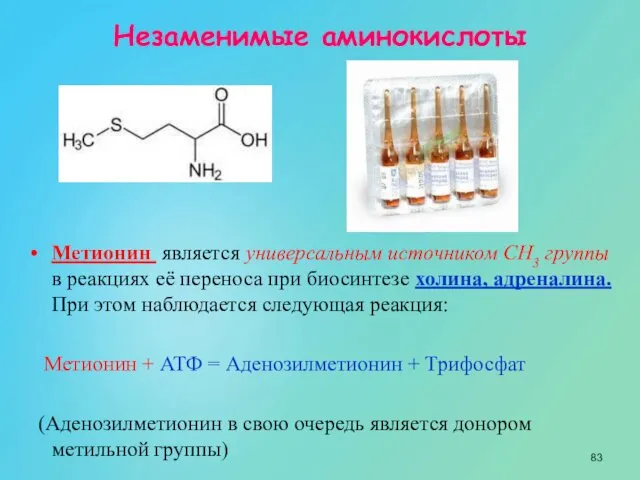
- 83. Метионин является универсальным источником СН3 группы в реакциях её переноса при биосинтезе холина, адреналина. При этом
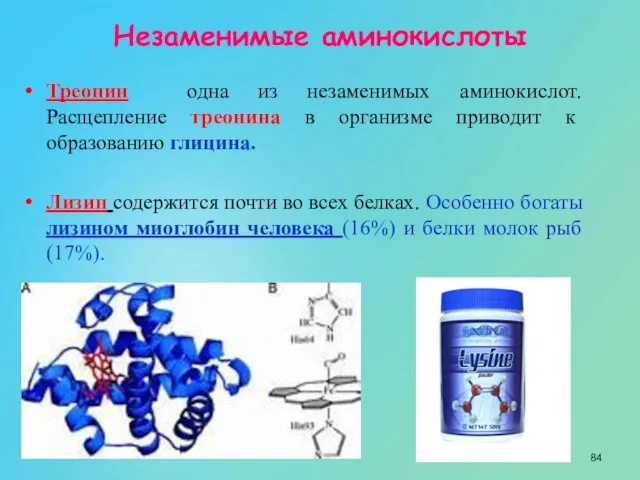
- 84. Треонин одна из незаменимых аминокислот. Расщепление треонина в организме приводит к образованию глицина. Лизин содержится почти
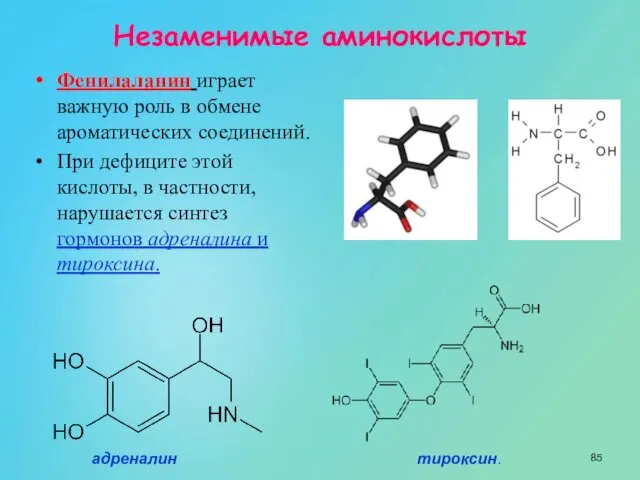
- 85. Фенилаланин играет важную роль в обмене ароматических соединений. При дефиците этой кислоты, в частности, нарушается синтез
- 86. Наряду с заменимыми и незаменимыми аминокислотами существуют так называемые частично заменимые аминокислоты. Появление этой группы связано
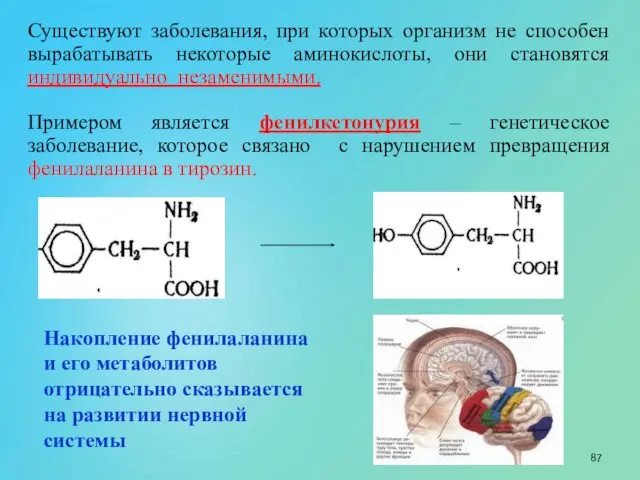
- 87. Существуют заболевания, при которых организм не способен вырабатывать некоторые аминокислоты, они становятся индивидуально незаменимыми. Примером является
- 88. Люди, страдающие этим заболеванием, нуждаются в тирозине. Лечение фенилкетонурии- диетическое ограничение белка Людям с этой болезнью
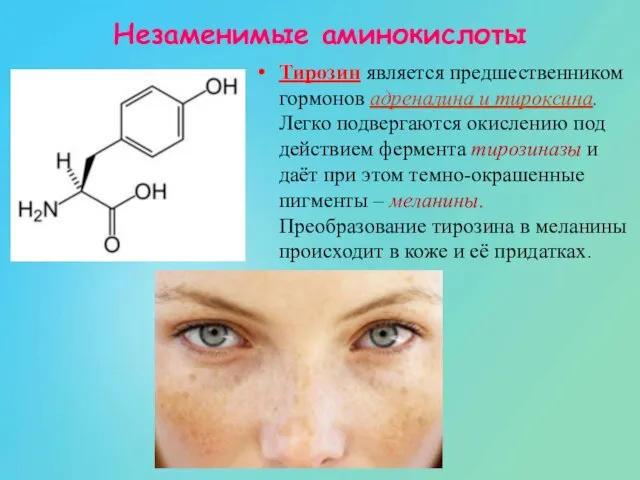
- 89. Тирозин является предшественником гормонов адреналина и тироксина. Легко подвергаются окислению под действием фермента тирозиназы и даёт
- 90. Большинство реакций превращения аминокислот протекает в печени. Для каждой аминокислоты существует индивидуальный способ обмена, но всё
- 91. Применение аминокислот в медицине Аминокислоты широко применяются в медицинской практике в качестве лекарственных средств. Аминокислоты прописываются
- 92. Применение аминокислот в сельском хозяйстве Аминокислоты в сельском хозяйстве применяются преимущественно в качестве кормовых добавок. Многие
- 93. Применение аминокислот в пищевой промышленности В пищевой промышленности аминокислоты применяются в качестве вкусовых добавок. Аминокислоты также
- 94. Применение аминокислот в пищевой промышленности В химической промышленности введение в такие аминокислоты, как глутаминовая или аспарагиновая
- 96. Скачать презентацию






























![Полиамидные волокна: найлон Найлон (анид, полиамид-6,6); [-СО-(СН2)4-СО-NН-(СН2)6-NН-]n. Получают поликонденсацией двух мономеров:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/452940/slide-72.jpg)












 Композитный материал
Композитный материал Природные соединения кремния
Природные соединения кремния Строение, особенности химического поведения алкалоидов, обладающих биологической активностью
Строение, особенности химического поведения алкалоидов, обладающих биологической активностью Чугуны и стали
Чугуны и стали Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония
Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония Дека́н (н-декан) — органическое соединение класса алканов
Дека́н (н-декан) — органическое соединение класса алканов pH and pH meter
pH and pH meter Аннелирование бензольного кольца
Аннелирование бензольного кольца Кислоты и основания. (Лекция 16)
Кислоты и основания. (Лекция 16) Промышленное получение аммиака
Промышленное получение аммиака Титан. Структура, применение, свойства (11 класс)
Титан. Структура, применение, свойства (11 класс) Кислотність твердих тіл. Основні методи дослідження. Суперкислотність
Кислотність твердих тіл. Основні методи дослідження. Суперкислотність Вода Презентацию подготовила ученица 8-б класса Гордеева Юлия
Вода Презентацию подготовила ученица 8-б класса Гордеева Юлия “Дещо про поліетилен”
“Дещо про поліетилен”  Аттестационная работа. Методическая разработка по выполнению проекта «Анализ содержания ионов железа (III) в пищевых продуктах»
Аттестационная работа. Методическая разработка по выполнению проекта «Анализ содержания ионов железа (III) в пищевых продуктах» Внесение удобрений разбрасыванием
Внесение удобрений разбрасыванием Менделеевский период
Менделеевский период Р-элементы IV А группы. Углерод и кремний
Р-элементы IV А группы. Углерод и кремний Аттестационная работа. Образовательная программа внеурочной деятельности «Химия и физика с детства». (1-4 класс)
Аттестационная работа. Образовательная программа внеурочной деятельности «Химия и физика с детства». (1-4 класс) Названия комплексов с мостиковыми лигандами
Названия комплексов с мостиковыми лигандами Комплексные соединения
Комплексные соединения Воздух. Кислород. Горение. Работа выполнена: Учителем химии ГБОУ СОШ № 118 Выборгского района Санкт - Петербурга Тихомировой
Воздух. Кислород. Горение. Работа выполнена: Учителем химии ГБОУ СОШ № 118 Выборгского района Санкт - Петербурга Тихомировой Презентация Химия в быту
Презентация Химия в быту  Щелочноземельные металлы Учитель МОУ СОШ № 130 Разнополова О.П.
Щелочноземельные металлы Учитель МОУ СОШ № 130 Разнополова О.П. Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Виды химической связи
Виды химической связи Электронное состояние атомов азота в азотсодержащих углеродных нанотрубках
Электронное состояние атомов азота в азотсодержащих углеродных нанотрубках Презентация по Химии "Форфор" - скачать смотреть
Презентация по Химии "Форфор" - скачать смотреть