Содержание
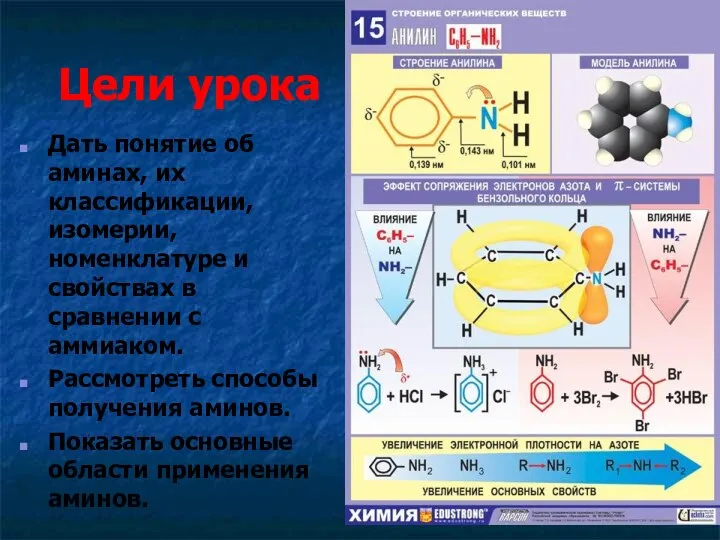
- 2. Цели урока Дать понятие об аминах, их классификации, изомерии, номенклатуре и свойствах в сравнении с аммиаком.
- 3. Решите задачу. Органическое вещество содержит 38,7% углерода, 45,15% азота и 16,15% водорода. Относительная плотность его паров
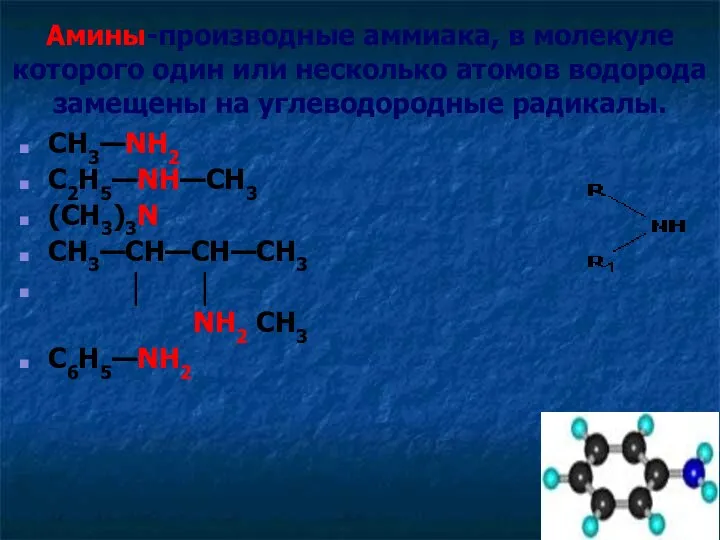
- 4. Амины-производные аммиака, в молекуле которого один или несколько атомов водорода замещены на углеводородные радикалы. CH3—NH2 C2H5—NH—CH3
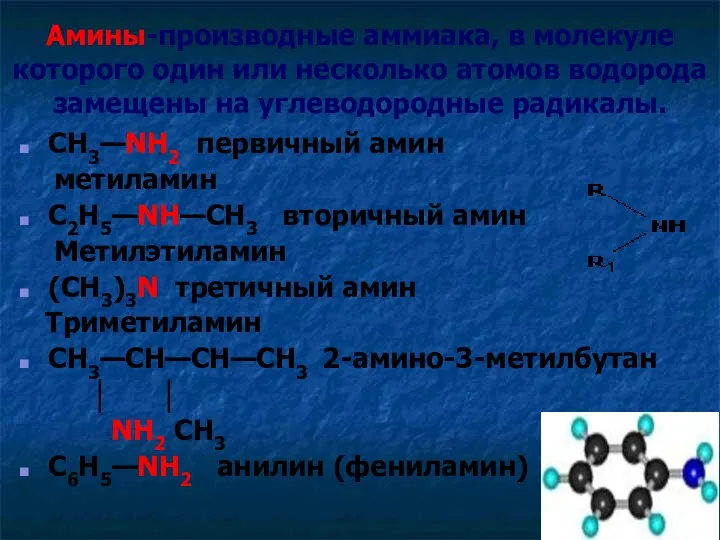
- 5. Амины-производные аммиака, в молекуле которого один или несколько атомов водорода замещены на углеводородные радикалы. CH3—NH2 первичный
- 6. Физические свойства Анилин - бесцветная маслянистая жидкость. Немного тяжелее воды, малорастворим в ней. Хорошо растворяется в
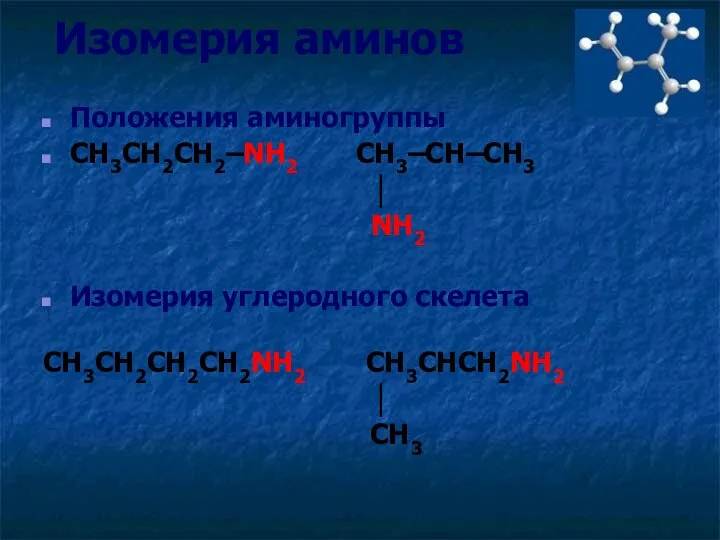
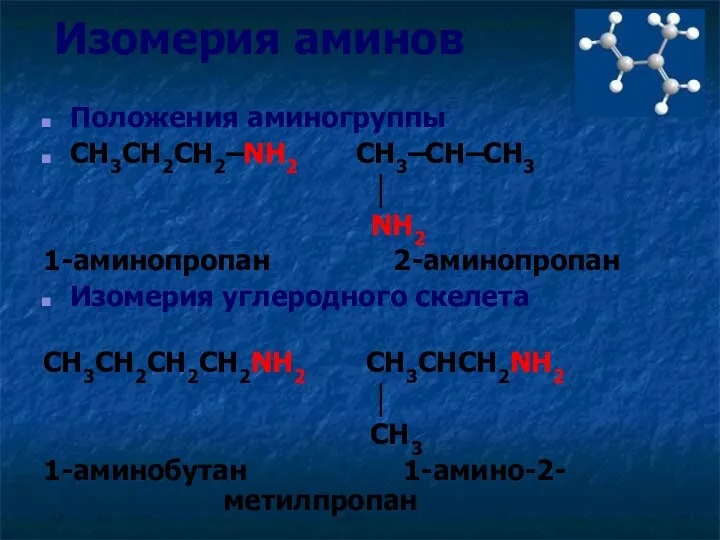
- 7. Изомерия аминов Положения аминогруппы CH3CH2CH2–NH2 CH3–CH–CH3 │ NH2 Изомерия углеродного скелета CH3CH2CH2CH2NH2 CH3CHCH2NH2 │ CH3
- 8. Изомерия аминов Положения аминогруппы CH3CH2CH2–NH2 CH3–CH–CH3 │ NH2 1-аминопропан 2-аминопропан Изомерия углеродного скелета CH3CH2CH2CH2NH2 CH3CHCH2NH2 │
- 9. Строение и свойства Аммиак NH3 Строение атома азота 1s22s22p3 Строение атома водорода 1s1 Атом азота имеет
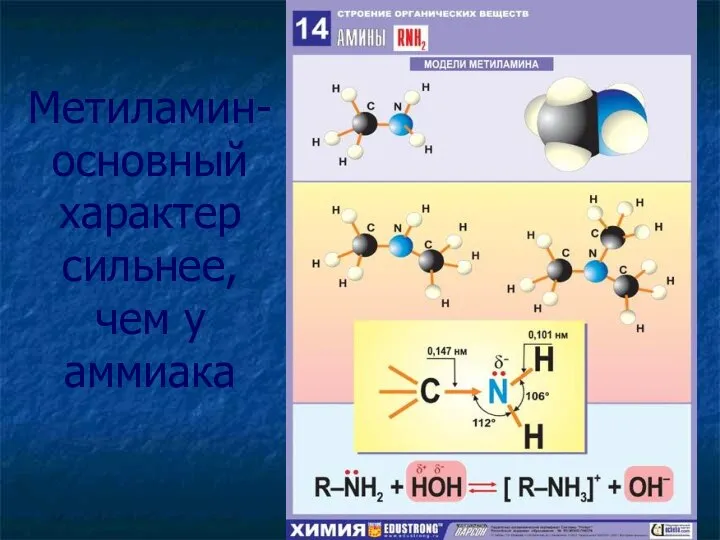
- 10. Метиламин- основный характер сильнее, чем у аммиака
- 11. Химические свойства CH3NH2+HOH→[CH3NH3]OH C6H5NH2+HOH → CH3NH2+HCl → [CH3NH3]Cl C6H5NH2+HCl → [C6H5NH3]Cl 9CH3NH2+9O2 →4CO2+2N2+10H2O
- 12. Химические свойства CH3NH2+HOH→[CH3NH3]OH Гидроксид метиламмония C6H5NH2+HOH → не взаимодействует CH3NH2+HCl → [CH3NH3]Cl Хлорид метиламмония C6H5NH2+HCl →
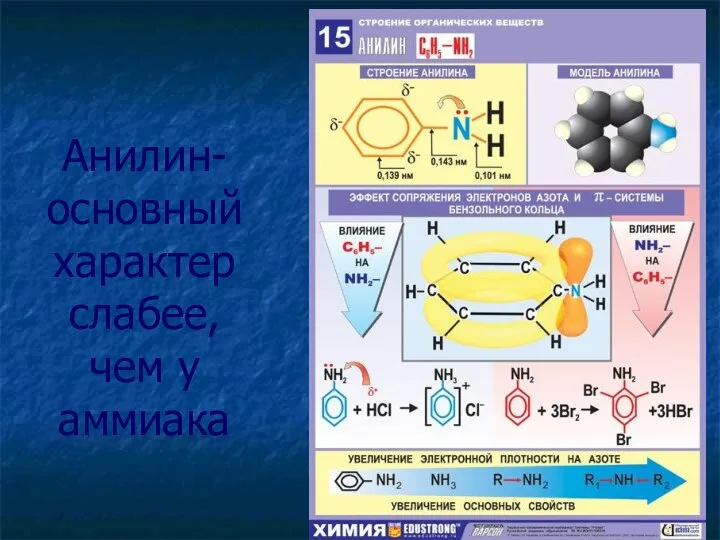
- 13. Анилин- основный характер слабее, чем у аммиака
- 14. Реакции замещения ароматических аминов Увеличивая электронную плотность в кольце, аминогруппа облегчает протекание реакций электрофильного замещения, то
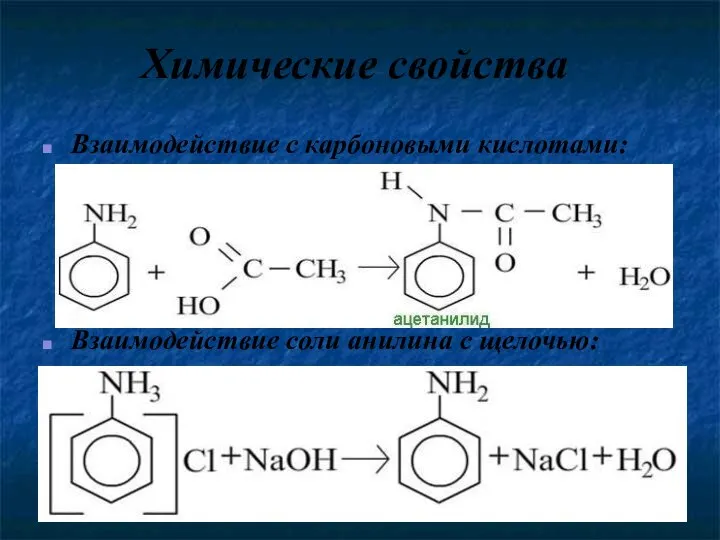
- 15. Химические свойства Взаимодействие с карбоновыми кислотами: Взаимодействие соли анилина с щелочью:
- 16. Получение аминов 1.Взаимодействие аммиака с галогенпроизводными углеводородов CH3Cl+2NH3→ 2.Восстановление нитросоединений C6H5NO2+3H2 →
- 17. Получение аминов 1.Взаимодействие аммиака с галогенпроизводными углеводородов CH3Cl+2NH3→ CH3NH2+NH4Cl 2.Восстановление нитросоединений C6H5NO2+3H2 →C6H5NH2+2H2O
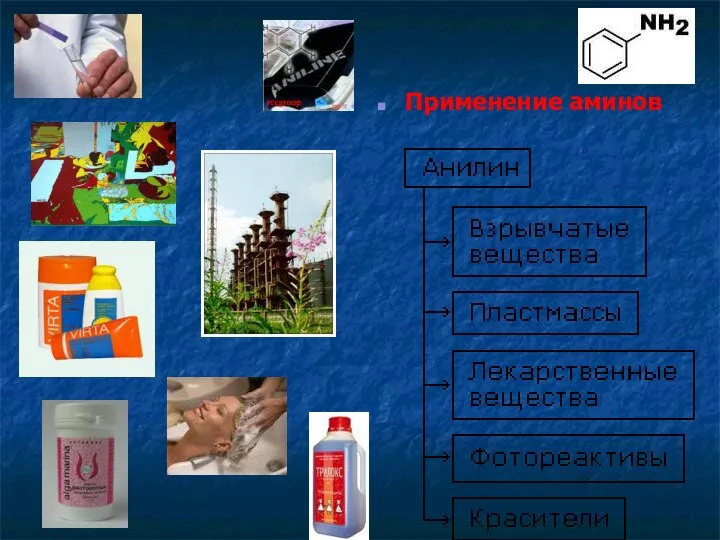
- 18. Применение аминов
- 20. Скачать презентацию



![Химические свойства CH3NH2+HOH→[CH3NH3]OH C6H5NH2+HOH → CH3NH2+HCl → [CH3NH3]Cl C6H5NH2+HCl → [C6H5NH3]Cl 9CH3NH2+9O2 →4CO2+2N2+10H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/701278/slide-10.jpg)
![Химические свойства CH3NH2+HOH→[CH3NH3]OH Гидроксид метиламмония C6H5NH2+HOH → не взаимодействует CH3NH2+HCl →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/701278/slide-11.jpg)



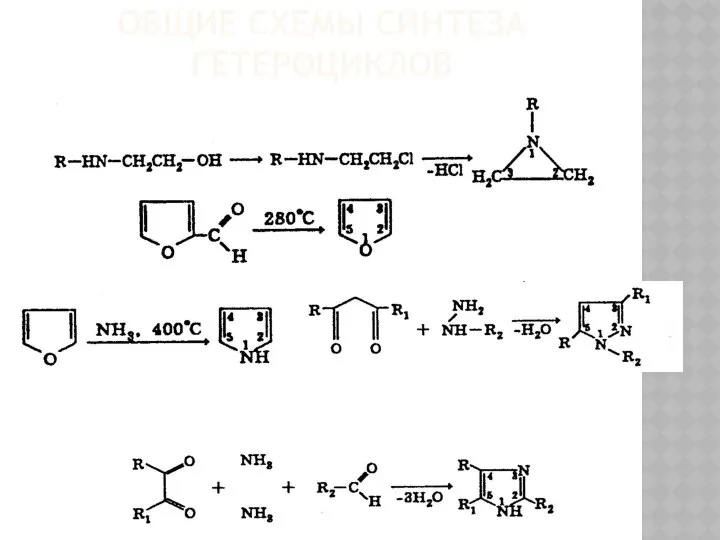 Общие схемы синтеза гетероциклов
Общие схемы синтеза гетероциклов Топливо и его свойства
Топливо и его свойства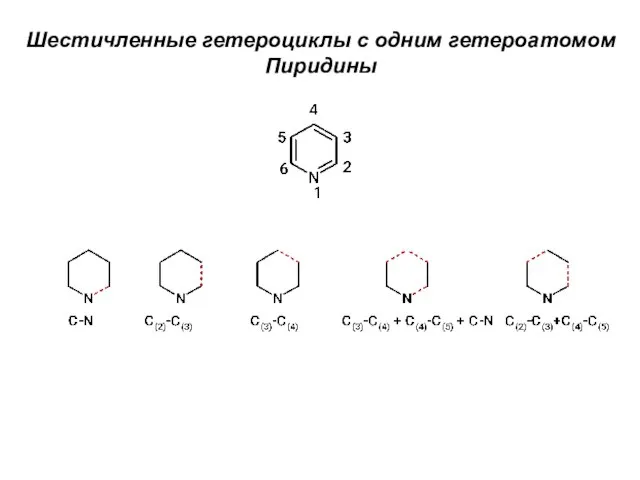 Шестичленные гетероциклы с одним гетероатомом. Пиридины
Шестичленные гетероциклы с одним гетероатомом. Пиридины Волокнистые наполнители. (Тема 5)
Волокнистые наполнители. (Тема 5)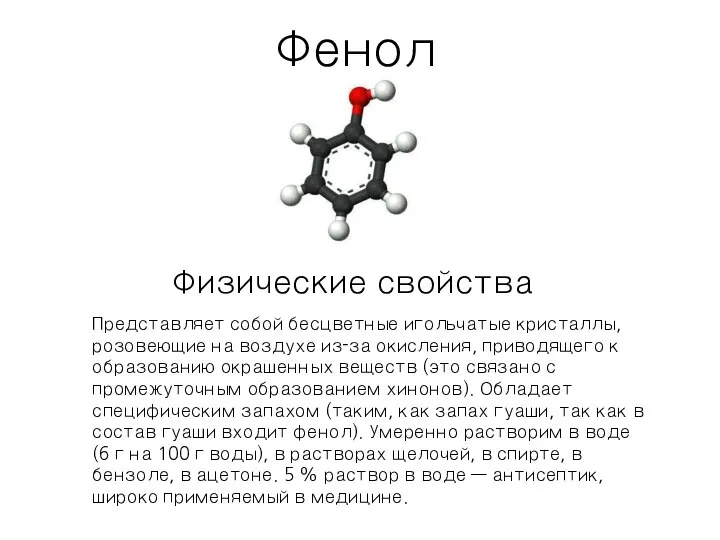 Свойства фенола
Свойства фенола Адские задания. ЕГЭ по химии
Адские задания. ЕГЭ по химии Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов
Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов Многообразие углеводородов. Обобщение
Многообразие углеводородов. Обобщение Синтетические моющие средства. Механизм моющего действия
Синтетические моющие средства. Механизм моющего действия Предельные одноосновные карбоновые кислоты
Предельные одноосновные карбоновые кислоты Ліпіди
Ліпіди Введение в коллоидную химию. Основные понятия и закономерности
Введение в коллоидную химию. Основные понятия и закономерности Гелий. История открытия
Гелий. История открытия Конструкционные функциональные волокнистые композиты. Полимерные матричные материалы
Конструкционные функциональные волокнистые композиты. Полимерные матричные материалы Интернет-семинар (вебинар). Методика подготовки к олимпиадам и интеллектуальным турнирам по химии. Часть 1
Интернет-семинар (вебинар). Методика подготовки к олимпиадам и интеллектуальным турнирам по химии. Часть 1 Полимеры. Классификация полимеров
Полимеры. Классификация полимеров Кристаллические решетки
Кристаллические решетки Buxarlanma ve kondensasiya
Buxarlanma ve kondensasiya Алифатические соединения. Тема № 6
Алифатические соединения. Тема № 6 Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Измерение потенциала при прохождении тока также называется перенапряжением
Измерение потенциала при прохождении тока также называется перенапряжением Нанотехнологияның химия өндірісінде қолданылуы
Нанотехнологияның химия өндірісінде қолданылуы Липиды. Классификация
Липиды. Классификация Термическая обработка. Превращения при непрерывном охлаждении аустенита. Превращения при отпуск
Термическая обработка. Превращения при непрерывном охлаждении аустенита. Превращения при отпуск Подходы к отбору методического материала с учётом дифференцированного обучения на уроках химии. cЛукьянова Анастасия Никола
Подходы к отбору методического материала с учётом дифференцированного обучения на уроках химии. cЛукьянова Анастасия Никола Синие камни. Сапфир
Синие камни. Сапфир Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу