Содержание
- 2. Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной
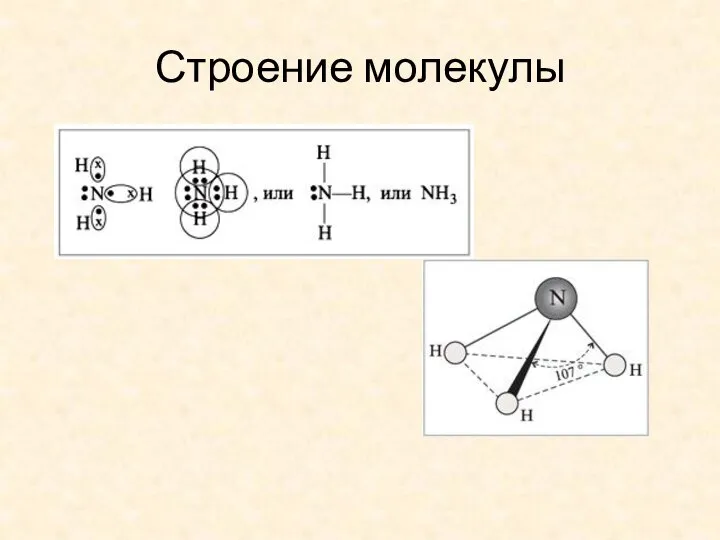
- 3. Строение молекулы
- 4. Получение промышленный способ Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) +
- 5. Производство аммиака Колонна синтеза аммиака: 1-люк для выгрузки катализатора; 2-центр, труба; 3-корпус; 4-люк для загрузки катализатора;
- 6. В лаборатории Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH4Cl +
- 7. Химические свойства 1. Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 2. Каталитическое
- 8. с оксидами металлов 2 NH3 + 3CuO = 3Cu + N2 + 3 H2O С окислителями
- 9. Образование иона аммония Влажная лакмусовая бумажка синеет
- 10. Получение 1 способ- Аммиак + кислота: NH3 + HNO3 → NH4NO3 2 способ- Аммиачная вода +
- 11. Соли аммония NH4Cl – хлорид аммония (NH4)2SO4 - сульфат аммония NH4NO3 – нитрат аммония (NH4)3PO4 –
- 13. Скачать презентацию









 Химия Для студентов I курса специальностей: 2080165 — экология, 08040165 — товароведение и экспертиза товаров, 260800 — технология, конс
Химия Для студентов I курса специальностей: 2080165 — экология, 08040165 — товароведение и экспертиза товаров, 260800 — технология, конс Водорастворимые витамины. 7 свойств водорастворимых витаминов
Водорастворимые витамины. 7 свойств водорастворимых витаминов Физический этап развития периодического закона
Физический этап развития периодического закона Анализ качества лекарственных и косметических веществ из группы алифатических кислот и аминокислот
Анализ качества лекарственных и косметических веществ из группы алифатических кислот и аминокислот Васильева Е.А. – учитель географии МОУ СОШ п. Солидарность Елецкого муниципального района Липецкой области
Васильева Е.А. – учитель географии МОУ СОШ п. Солидарность Елецкого муниципального района Липецкой области Презентация по Химии "НИТРАТЫ. ИХ ВЛИЯНИЕ НА ЗДОРОВЬЕ ЛЮДЕЙ" - скачать смотреть бесплатно
Презентация по Химии "НИТРАТЫ. ИХ ВЛИЯНИЕ НА ЗДОРОВЬЕ ЛЮДЕЙ" - скачать смотреть бесплатно Азотсодержащие соединения
Азотсодержащие соединения Скорость химических реакций
Скорость химических реакций Алмазы. Бриллианты
Алмазы. Бриллианты Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері
Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері Первоначальные химические понятия
Первоначальные химические понятия Особенности сжигания газообразного топлива и топливосжигающие устройства
Особенности сжигания газообразного топлива и топливосжигающие устройства Соединения железа
Соединения железа Железо. Строение атома железа
Железо. Строение атома железа Жири, склад жирів, їх утворення. Гідроліз та гідрування жирів. Жири в природі. Біологічна роль жирів
Жири, склад жирів, їх утворення. Гідроліз та гідрування жирів. Жири в природі. Біологічна роль жирів Основные классы неорганических соединений. Общие формулы оксидов, оснований, кислот, солей
Основные классы неорганических соединений. Общие формулы оксидов, оснований, кислот, солей 8 шагов к кристаллу
8 шагов к кристаллу МБОУ « Школа – интернат среднего (полного) общего образования с. Кепервеем» Билибинского муниципального района Чукотского АО
МБОУ « Школа – интернат среднего (полного) общего образования с. Кепервеем» Билибинского муниципального района Чукотского АО  Химическая связь
Химическая связь Обобщение и подготовка к химии 8 класс
Обобщение и подготовка к химии 8 класс Химическая связь
Химическая связь Хімічні добавки. Е-числа
Хімічні добавки. Е-числа  Химия воды
Химия воды Промышленные аварии с выбросом опасных химических веществ
Промышленные аварии с выбросом опасных химических веществ Строение и свойства циклоалканов.
Строение и свойства циклоалканов.  Состав и номенклатура аминокислот. Превращение и функции белков в организме
Состав и номенклатура аминокислот. Превращение и функции белков в организме Муниципальное общеобразовательное учреждение «Средняя общеобразовательная школа п. Соцземледельский Балашовского района Сарат
Муниципальное общеобразовательное учреждение «Средняя общеобразовательная школа п. Соцземледельский Балашовского района Сарат Нуклеиновые кислоты Выполнил : Росовский Алексей
Нуклеиновые кислоты Выполнил : Росовский Алексей