Содержание
- 2. Строение атома железа. Задание: прочитайте текст учебника стр. 76 и охарактеризуйте положение химического элемента железа в
- 3. Вспомните из урока про нахождение металлов в природе, в виде каких минералов железо находится в природе?
- 4. Нахождение в природе. Халькопирит с включениями кварца Приморский край Пирит
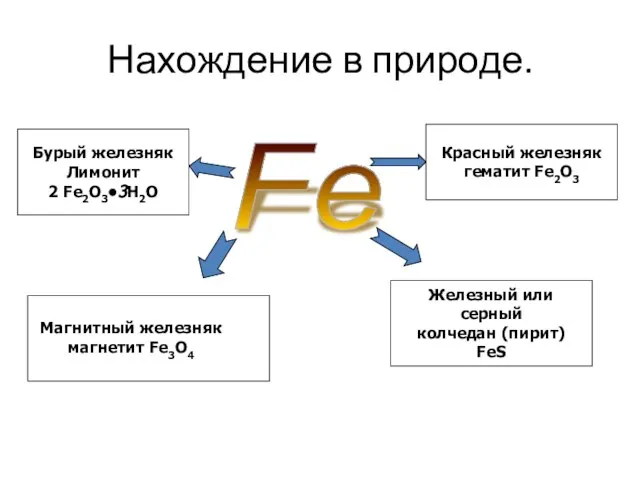
- 5. Нахождение в природе. Fe Магнитный железняк магнетит Fe3O4 Красный железняк гематит Fe2O3 Бурый железняк Лимонит 2
- 6. Физические свойства Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0С Температура кипения
- 7. Железные опилки в магнитном поле
- 8. Химические свойства железа 1. Железо реагирует с неметаллами: Fe + S = FeS При нагревании до
- 9. Химические свойства железа 2. Железо реагирует с кислотами. Fe+H2SO4=FeSO4+H2 В концентрированных азотной и серной кислотах железо
- 10. Химические свойства железа. 3. Реагирует с растворами солей металла согласно электрохимическому ряду напряжений металлов. Fe +
- 11. Химические свойства Прочитайте текст учебника, составьте уравнения реакций Fe+H2О Fe+O2 Сделайте вывод о химической активности простого
- 12. Биологическая роль железа Железо играет важную роль в жизнедеятельности живых организмов. Оно входит в состав гемоглобина
- 13. Домашнее задание: § 14, осуществить превращения: Mg → MgO → Mg(OH)2→ Mg(NO3)2 Al → Al2O3 →
- 15. Скачать презентацию











 Поверхневі явища. Адсорбція
Поверхневі явища. Адсорбція Молекулярные массы и гибкость полимеров
Молекулярные массы и гибкость полимеров Генетика клеточного цикла. Протеолиз циклина под контролем АРС. (Глава 4)
Генетика клеточного цикла. Протеолиз циклина под контролем АРС. (Глава 4) Тема: Серная кислота, свойства серной кислоты.
Тема: Серная кислота, свойства серной кислоты. Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель
Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель V група періодичної системи Менделєєва
V група періодичної системи Менделєєва Спирты. Строение. Физические и химические свойства. Спиртами (или алканолами ) называются органические вещества , молекулы которых
Спирты. Строение. Физические и химические свойства. Спиртами (или алканолами ) называются органические вещества , молекулы которых Хімічна дія світла Підготував учень 7-Б класу, Лагода Віталій
Хімічна дія світла Підготував учень 7-Б класу, Лагода Віталій  Энергетика химических реакций. Элементы химической термодинамики
Энергетика химических реакций. Элементы химической термодинамики Презентация по Химии "Алгоритм решения задач" - скачать смотреть
Презентация по Химии "Алгоритм решения задач" - скачать смотреть  Химиялық рекативтер.стандартты және нормальдық ертінділер дайындау тәртібі мен технологиясы
Химиялық рекативтер.стандартты және нормальдық ертінділер дайындау тәртібі мен технологиясы Истинная и средняя скорости реакции
Истинная и средняя скорости реакции  Амины - производные аммиака
Амины - производные аммиака Доклад по теме «Фотография» Докладчик: Самунь Виктор
Доклад по теме «Фотография» Докладчик: Самунь Виктор Сплавы на основе железа
Сплавы на основе железа Презентация по химии Электролитическая диссоциация
Презентация по химии Электролитическая диссоциация  Валентность связи и локальный баланс валентности
Валентность связи и локальный баланс валентности Галогены ("солеобразующие")
Галогены ("солеобразующие") Самоорганизация на межфазных границах, метод Ленгмюра-Блоджетт. Объекты исследования коллоидной химии
Самоорганизация на межфазных границах, метод Ленгмюра-Блоджетт. Объекты исследования коллоидной химии Строение электронных оболочек атомов
Строение электронных оболочек атомов Альдегиды. Кетоны
Альдегиды. Кетоны Аммиак. Химические свойства
Аммиак. Химические свойства Биохимия слюны
Биохимия слюны Метаболизм липидов. Метаболизм глицерофосфолипидов и холестерола. (Лекция 3)
Метаболизм липидов. Метаболизм глицерофосфолипидов и холестерола. (Лекция 3) Содержание кислорода и углекислого газа в помещениях школы
Содержание кислорода и углекислого газа в помещениях школы Битумы и материалы на основе битумов
Битумы и материалы на основе битумов Полиморфизм и метастабильные состояния в однокомпонентных системах
Полиморфизм и метастабильные состояния в однокомпонентных системах Презентация по Химии "Синтетические лекарственные средства" - скачать смотреть бесплатно
Презентация по Химии "Синтетические лекарственные средства" - скачать смотреть бесплатно