Содержание
- 2. Характеристика I аналитической группы катионов К и Na входят в I группу периодической системы химических элементов.
- 3. Частные реакции катиона K+ Белый кристаллический осадок, растворимый при нагревании с водой, в сильных щелочах и
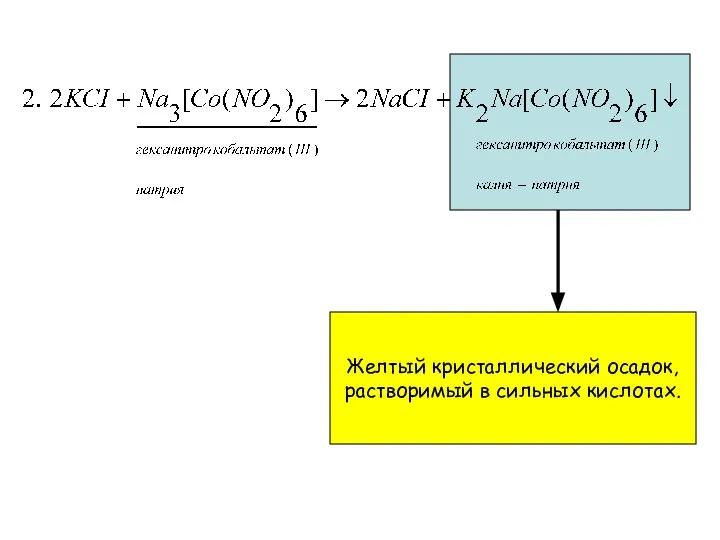
- 4. Желтый кристаллический осадок, растворимый в сильных кислотах.
- 5. Кубические кристаллы черного цвета. Микрокристаллоскопическая реакция
- 6. Объемистый мелкокристаллический осадок белого цвета, нерастворимый в разбавленных кислотах
- 7. 5. Реакция окрашивания пламени Ионы калия K+ окрашивают пламя в характерный фиолетовый цвет.
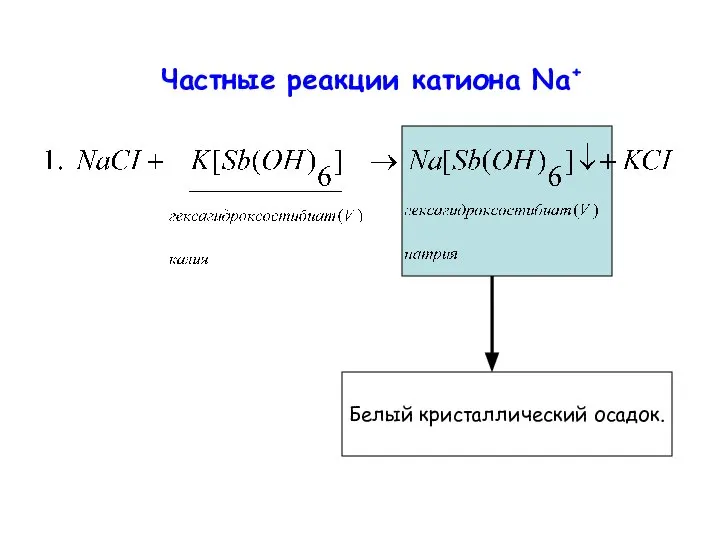
- 8. Частные реакции катиона Na+ Белый кристаллический осадок.
- 9. Микрокристаллоскопическая реакция Тетраэдрической или октаэдрической формы зеленовато-желтые кристаллы
- 10. 3. Реакция окрашивания пламени Ионы натрия Na+ окрашивают пламя в характерный желтый цвет.
- 11. Частные реакции катиона NН4+ Выделяется газообразный аммиак, который обнаруживают по характерному запаху.
- 12. Красно-бурый осадок
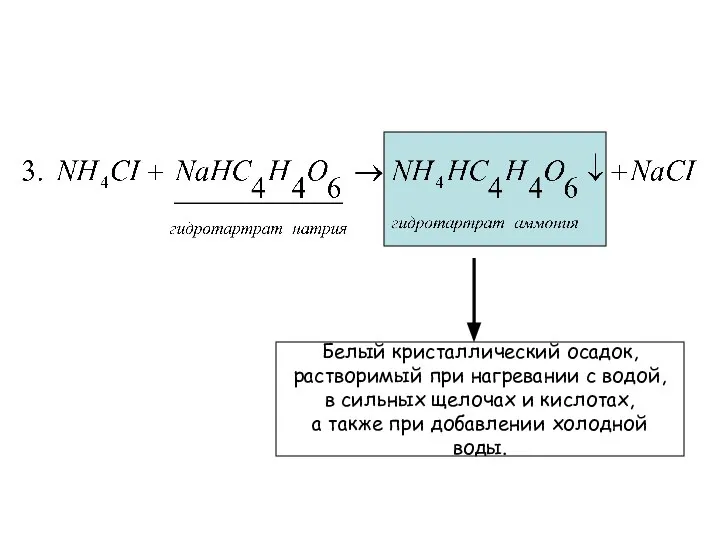
- 13. Белый кристаллический осадок, растворимый при нагревании с водой, в сильных щелочах и кислотах, а также при
- 14. Желтый кристаллический осадок, растворимый в сильных кислотах.
- 15. Белый аморфный осадок
- 16. Аналитические реакции катионов II аналитической группы Ag+, Pb2+, [Hg2]2+
- 17. Характеристика II аналитической группы катионов Эти элементы находятся в разных группах периодической системы. Они имеют либо
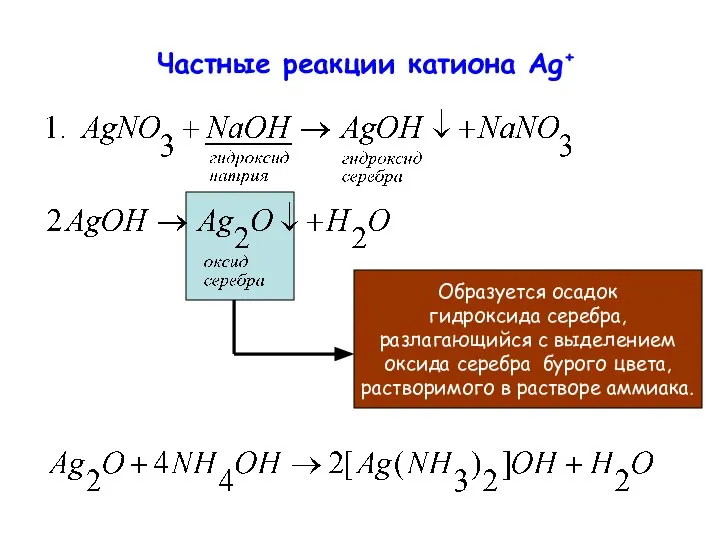
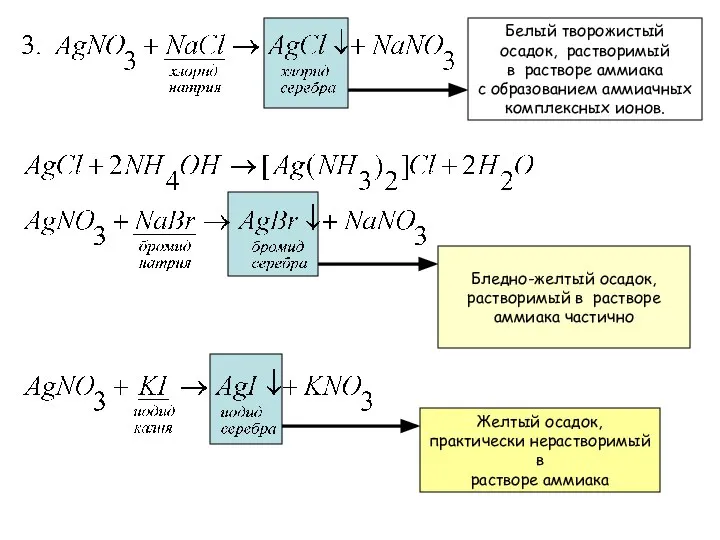
- 18. Частные реакции катиона Ag+ Образуется осадок гидроксида серебра, разлагающийся с выделением оксида серебра бурого цвета, растворимого
- 19. Кирпично-красный осадок, растворимый в азотной кислоте и растворе аммиака, но нерастворимый в уксусной кислоте.
- 20. Белый творожистый осадок, растворимый в растворе аммиака с образованием аммиачных комплексных ионов. Бледно-желтый осадок, растворимый в
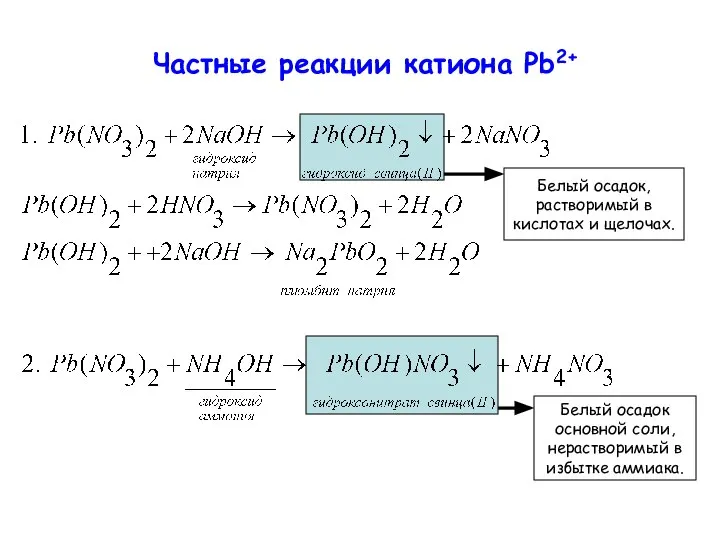
- 21. Частные реакции катиона Pb2+ Белый осадок, растворимый в кислотах и щелочах. Белый осадок основной соли, нерастворимый
- 22. Белый осадок, растворимый в едких щелочах.
- 23. Желтый осадок, растворимый в едких щелочах, нерастворимый в растворе аммиака и уксусной кислоте, трудно растворимый в
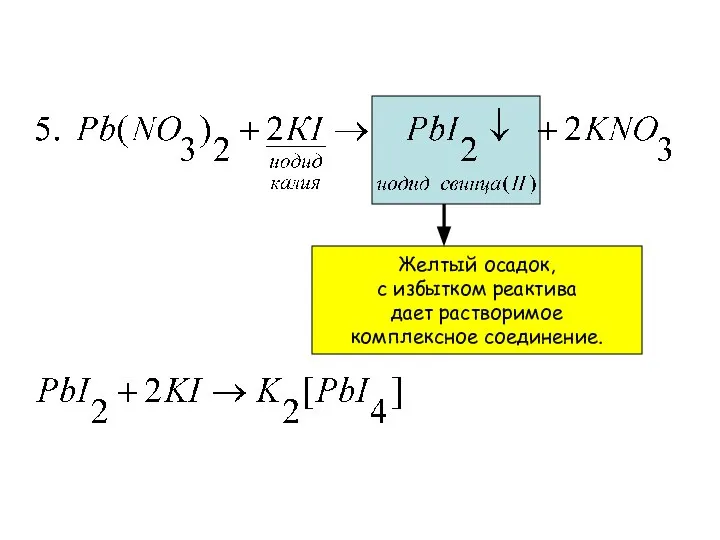
- 24. Желтый осадок, с избытком реактива дает растворимое комплексное соединение.
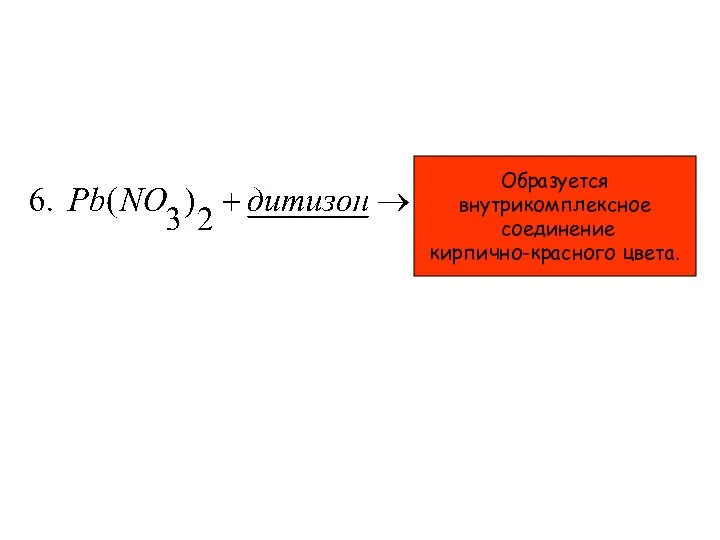
- 25. Образуется внутрикомплексное соединение кирпично-красного цвета.
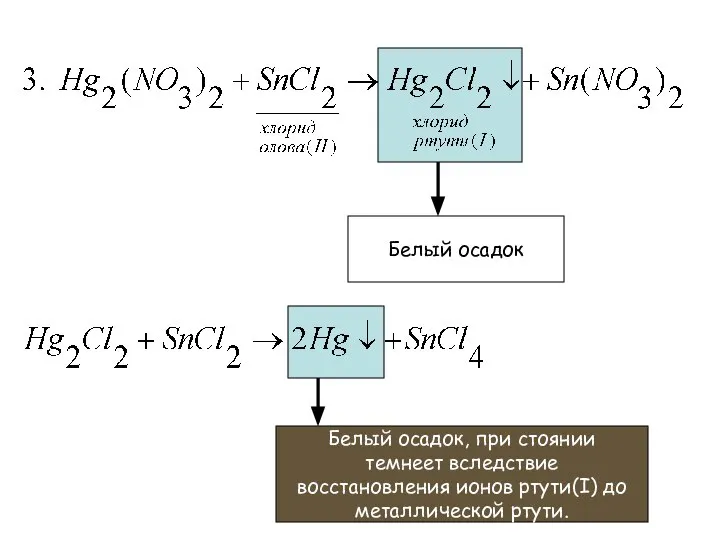
- 26. Частные реакции катиона [Hg2]2+ Черный осадок
- 27. Красный осадок, нерастворимый в гидроксидах и в разбавленной азотной кислоте.
- 28. Белый осадок Белый осадок, при стоянии темнеет вследствие восстановления ионов ртути(I) до металлической ртути.
- 29. На пластинке образуется серое пятно – металлическая ртуть. Капельная реакция
- 31. Скачать презентацию











![Аналитические реакции катионов II аналитической группы Ag+, Pb2+, [Hg2]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/732561/slide-15.jpg)




![Частные реакции катиона [Hg2]2+ Черный осадок](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/732561/slide-25.jpg)


 Структурно-механiчнi (реологiчнi) властивостi харчових мас
Структурно-механiчнi (реологiчнi) властивостi харчових мас Миметик глицина на основе производного Гераниола
Миметик глицина на основе производного Гераниола Noţiuni generale despre enzime
Noţiuni generale despre enzime Вредные вещества
Вредные вещества Алканы и алкены
Алканы и алкены Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации
Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации Периодический закон. Периодическая система элементов. (Лекция 2)
Периодический закон. Периодическая система элементов. (Лекция 2) Осмий. Нахождение в природе
Осмий. Нахождение в природе Каучук, резина и другие
Каучук, резина и другие Первые русские женщины-химики
Первые русские женщины-химики Anionic Polymerization
Anionic Polymerization Способ вызвать быструю, но контролируемую коррозию железа
Способ вызвать быструю, но контролируемую коррозию железа Алкены
Алкены Материальный баланс аппарата
Материальный баланс аппарата Азот и фосфор
Азот и фосфор Межклеточная сигнализация. Сигнальные молекулы. Гормоны. (Тема 3)
Межклеточная сигнализация. Сигнальные молекулы. Гормоны. (Тема 3) Изменения свойств химических элементов и их соединений в группах и периодах
Изменения свойств химических элементов и их соединений в группах и периодах Темір туралы
Темір туралы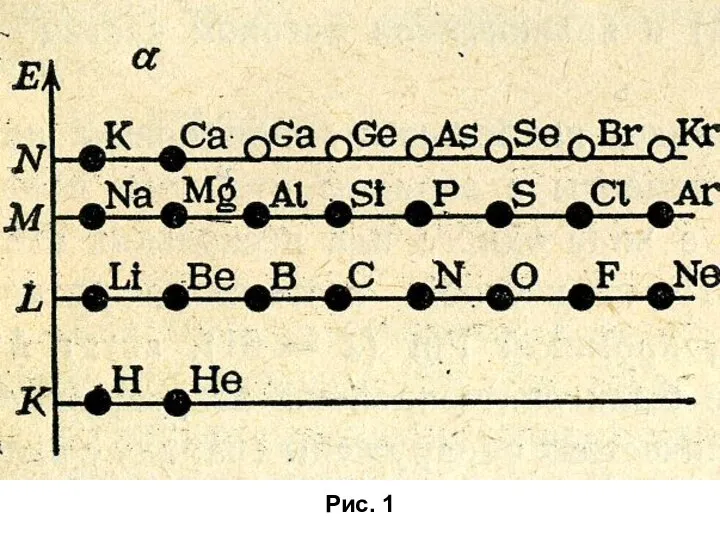 Строение атома и его электронной оболочки
Строение атома и его электронной оболочки Контроль качества эфирных масел
Контроль качества эфирных масел Орагническая химия. Теория А.М. Бутлерова
Орагническая химия. Теория А.М. Бутлерова Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) Жалпы химиялық технология
Жалпы химиялық технология Основные понятия и законы химии
Основные понятия и законы химии Оцет Яковлев Олексій 11-В
Оцет Яковлев Олексій 11-В  Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Изотермический распад переохлажденного аустенита
Изотермический распад переохлажденного аустенита