Содержание
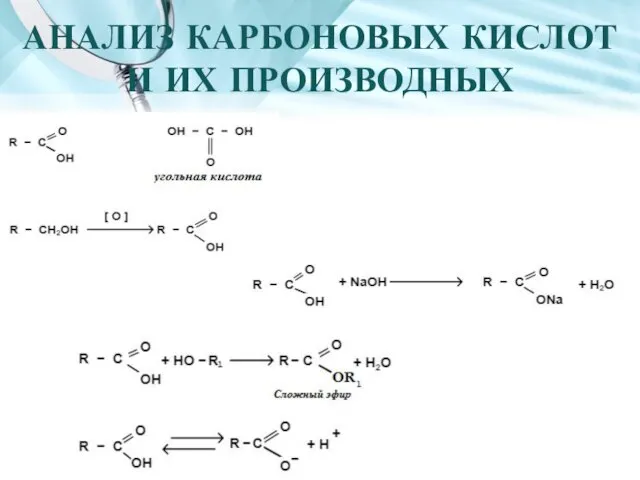
- 2. АНАЛИЗ КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ
- 3. КАЛИЯ АЦЕТАТ Получение:
- 4. С кислотой винной в среде натрия ацетата. 2. Образование сложных эфиров. 3. Комплексообразование с солями тяжелых
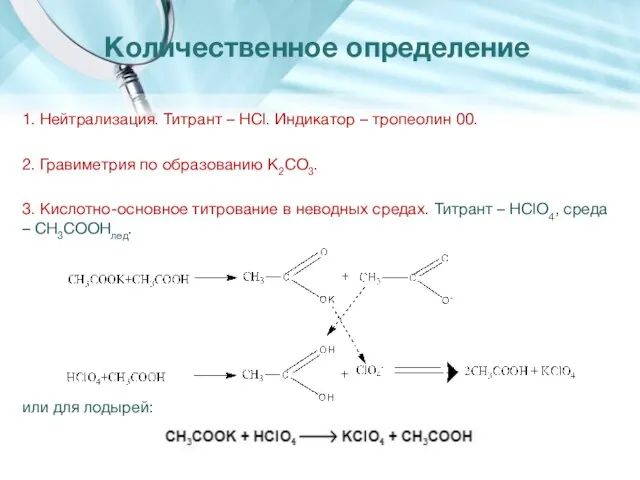
- 5. 1. Нейтрализация. Титрант – HCl. Индикатор – тропеолин 00. 2. Гравиметрия по образованию K2CO3. 3. Кислотно-основное
- 6. Получение: Из лимонной кислоты прибавлением избытка Na2CO3. Затем добавляют этанол и наблюдают выпадение белого осадка препарата.
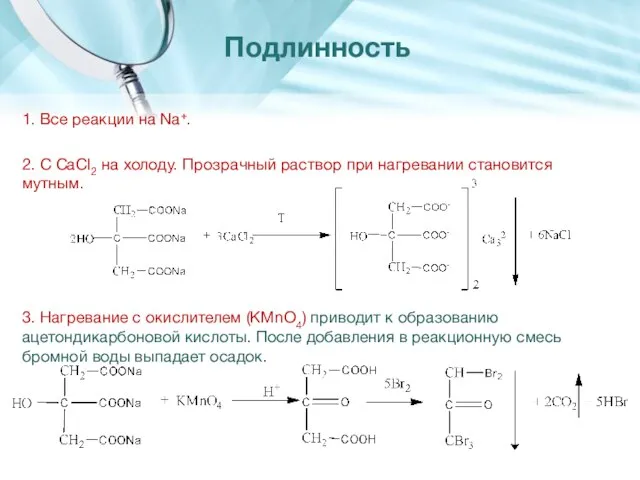
- 7. 1. Все реакции на Na+. 2. С CaCl2 на холоду. Прозрачный раствор при нагревании становится мутным.
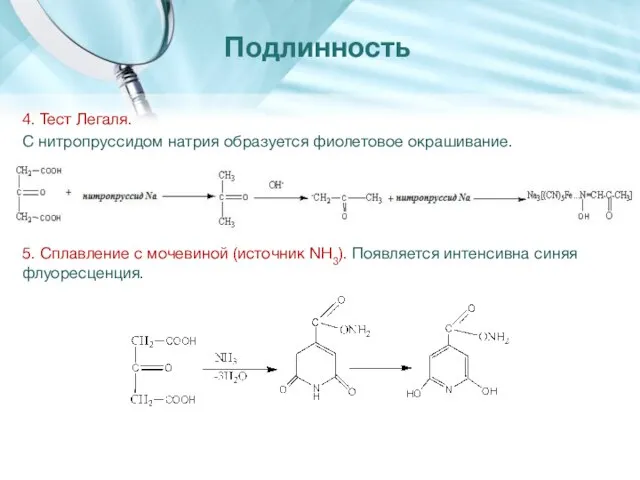
- 8. 4. Тест Легаля. С нитропруссидом натрия образуется фиолетовое окрашивание. 5. Сплавление с мочевиной (источник NH3). Появляется
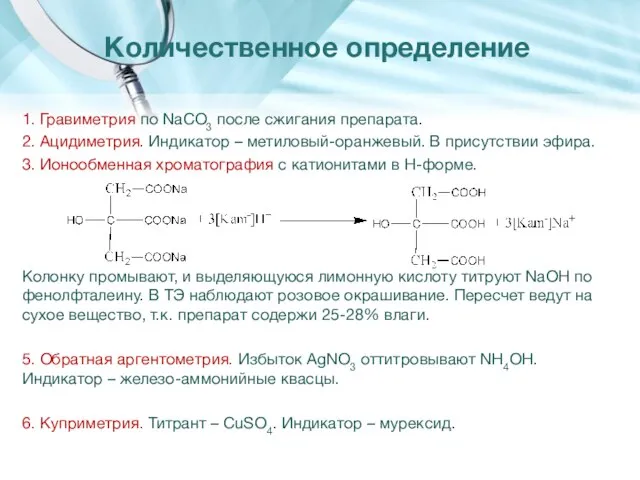
- 9. 1. Гравиметрия по NaCO3 после сжигания препарата. 2. Ацидиметрия. Индикатор – метиловый-оранжевый. В присутствии эфира. 3.
- 10. Получение: Из глюкозы и соединений кальция под влиянием молочно-кислых бактерий при T=35-40 °С. Образуется молочная кислота,
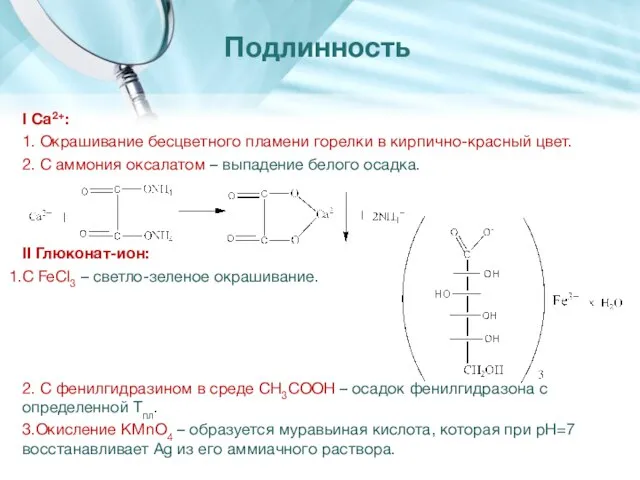
- 11. I Са2+: 1. Окрашивание бесцветного пламени горелки в кирпично-красный цвет. 2. С аммония оксалатом – выпадение
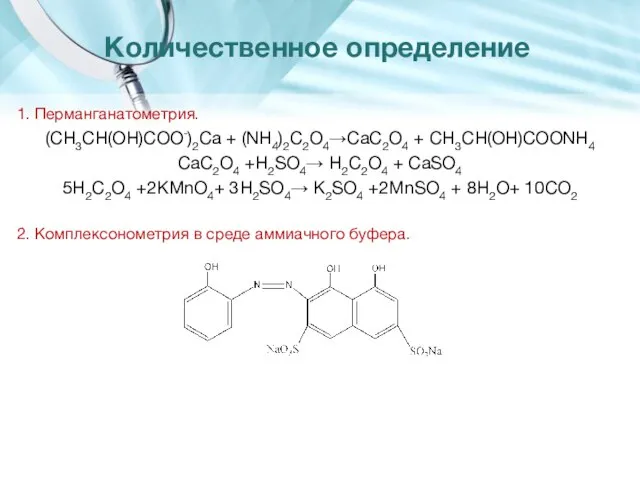
- 12. Количественное определение 1. Перманганатометрия. (CH3CH(OH)COO-)2Ca + (NH4)2C2O4→CaC2O4 + CH3CH(OH)COONH4 CaC2O4 +H2SO4→ H2C2O4 + CaSO4 5H2C2O4 +2KMnO4+
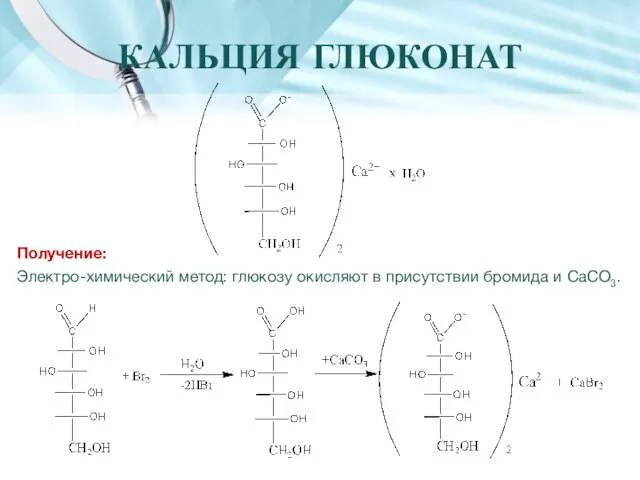
- 13. КАЛЬЦИЯ ГЛЮКОНАТ Получение: Электро-химический метод: глюкозу окисляют в присутствии бромида и CaCO3.
- 14. I Са2+: 1. Окрашивание бесцветного пламени горелки в кирпично-красный цвет. 2. С аммония оксалатом – выпадение
- 15. 4. С реактивом Толленса. Подлинность
- 16. АЦЕДИПРОЛ или НАТРИЯ ВАЛЬПРОАТ натриевая соль 2-пропилпентановой кислоты
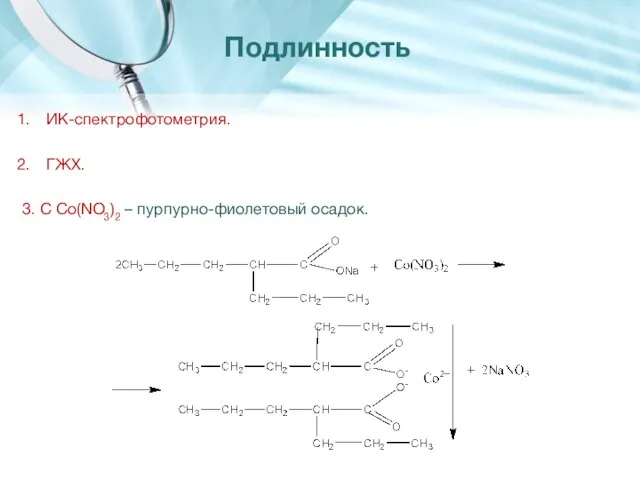
- 17. ИК-спектрофотометрия. ГЖХ. 3. С Co(NO3)2 – пурпурно-фиолетовый осадок. Подлинность
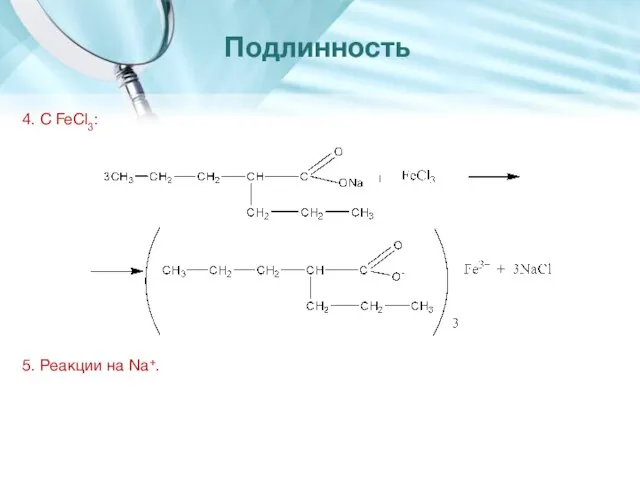
- 18. 4. С FeCl3: 5. Реакции на Na+. Подлинность
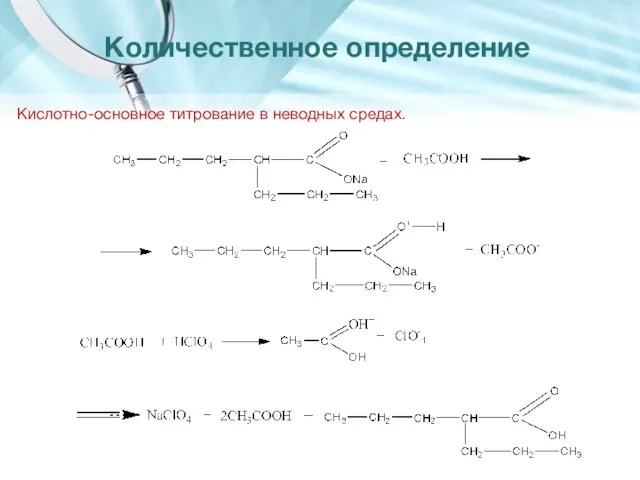
- 19. Количественное определение Кислотно-основное титрование в неводных средах.
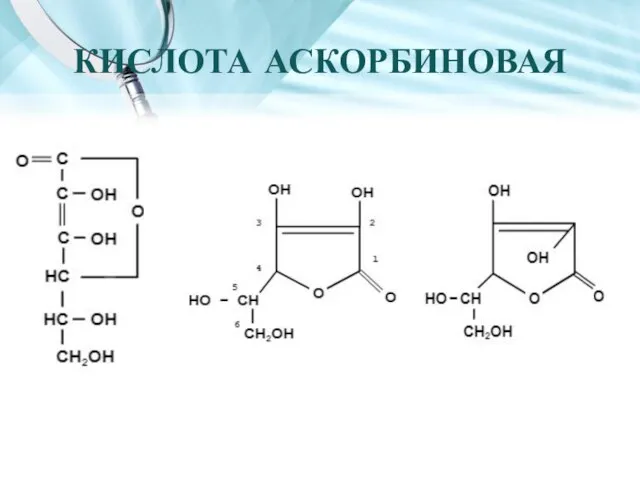
- 20. КИСЛОТА АСКОРБИНОВАЯ
- 21. белый кристаллический порошок без запаха и вкуса; имеет Tпл; удельное вращение водного раствора; хорошо растворим в
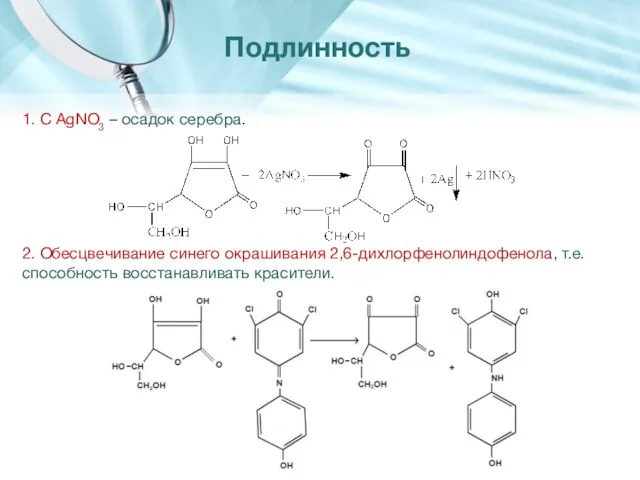
- 22. 1. С AgNO3 – осадок серебра. 2. Обесцвечивание синего окрашивания 2,6-дихлорфенолиндофенола, т.е. способность восстанавливать красители. Подлинность
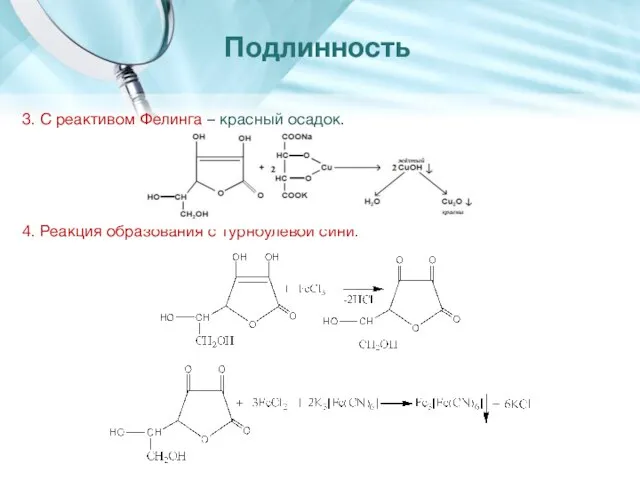
- 23. 3. С реактивом Фелинга – красный осадок. 4. Реакция образования с турнбулевой сини. Подлинность
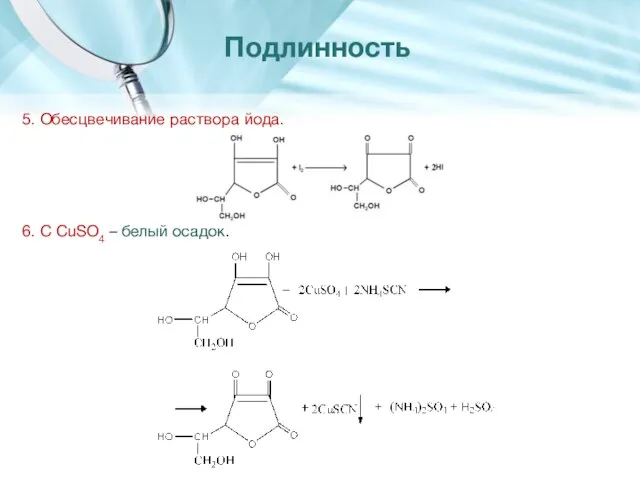
- 24. 5. Обесцвечивание раствора йода. 6. С CuSO4 – белый осадок. Подлинность
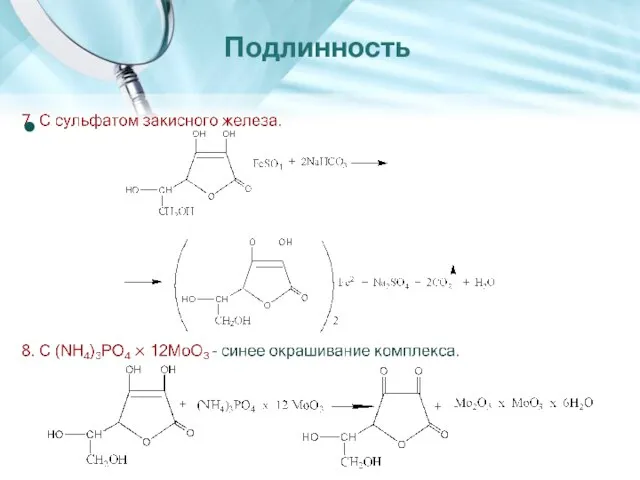
- 25. Подлинность
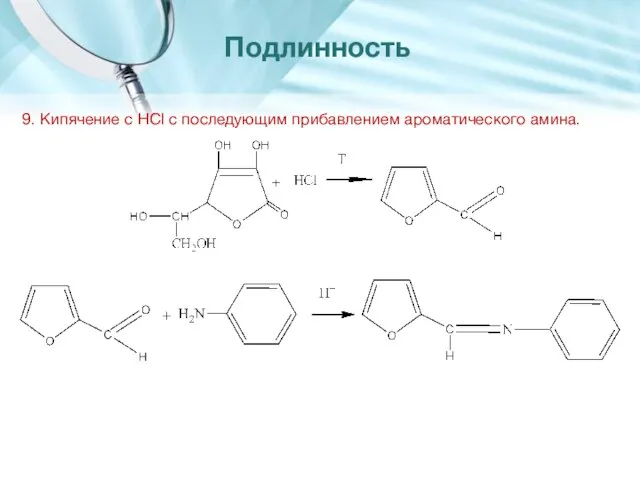
- 26. 9. Кипячение с HCl с последующим прибавлением ароматического амина. Подлинность
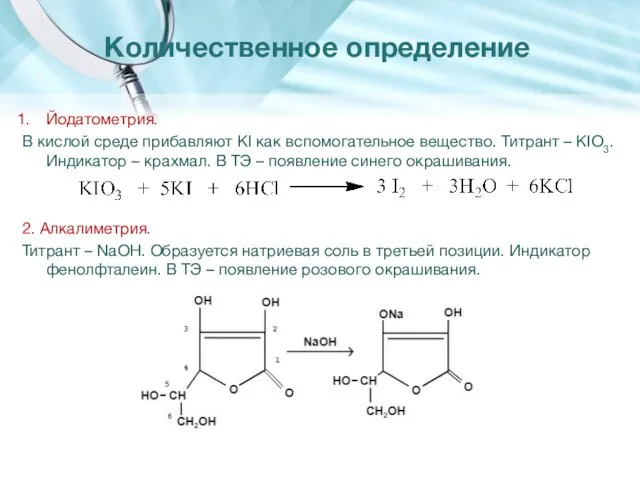
- 27. Йодатометрия. В кислой среде прибавляют KI как вспомогательное вещество. Титрант – KIO3. Индикатор – крахмал. В
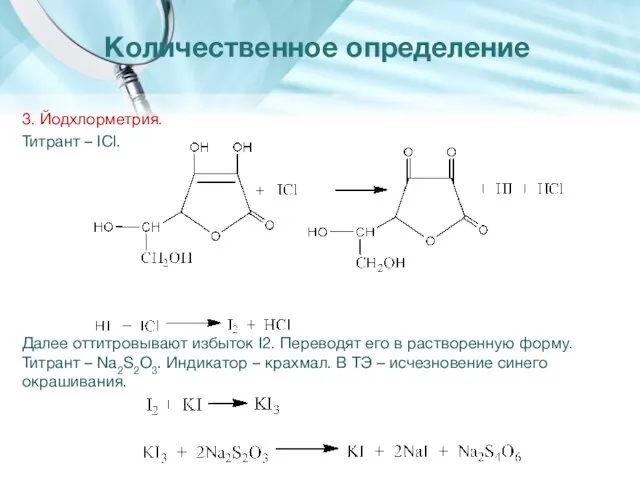
- 28. 3. Йодхлорметрия. Титрант – IСl. Далее оттитровывают избыток I2. Переводят его в растворенную форму. Титрант –
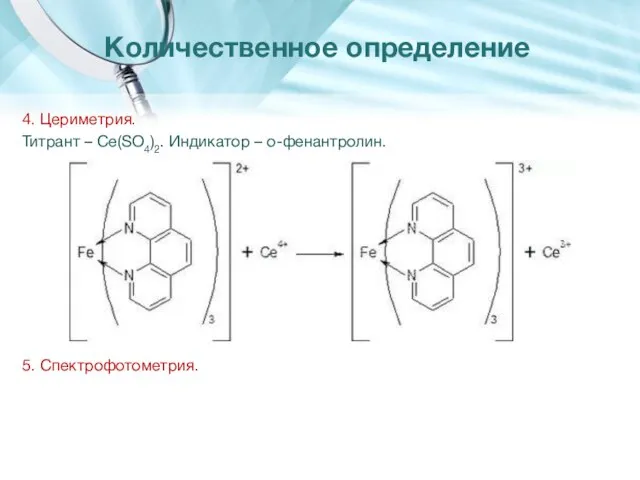
- 29. 4. Цериметрия. Титрант – Ce(SO4)2. Индикатор – о-фенантролин. 5. Спектрофотометрия. Количественное определение
- 31. Скачать презентацию








 Гетероциклические соединения
Гетероциклические соединения Химия и проблемы экологии. Кислотные дожди.
Химия и проблемы экологии. Кислотные дожди. Медь и ее сплавы
Медь и ее сплавы Органическая химия. История развития
Органическая химия. История развития Лекція № 2 Білкові системи: характеристика, використання фізико-хімічних властивостей у виробництві харчових продуктів
Лекція № 2 Білкові системи: характеристика, використання фізико-хімічних властивостей у виробництві харчових продуктів Классификация электродов. (Лекция 4)
Классификация электродов. (Лекция 4) Презентация Хлор Cl
Презентация Хлор Cl Многоатомные спирты
Многоатомные спирты Отбор проб товаров для анализа. Химико-аналитический контроль
Отбор проб товаров для анализа. Химико-аналитический контроль Методы очистки промышленных сточных вод от ионов тяжелых металлов
Методы очистки промышленных сточных вод от ионов тяжелых металлов Побочная подгруппа VI группы периодической системы
Побочная подгруппа VI группы периодической системы Вольтамперометрия
Вольтамперометрия Взаимное влияние атомов в молекулах
Взаимное влияние атомов в молекулах Керамика на основе Al2O3
Керамика на основе Al2O3 Йодированные производные арилалифатических и ароматических аминокислот
Йодированные производные арилалифатических и ароматических аминокислот Роль органической химии в жизни человека
Роль органической химии в жизни человека Минералогия и кристаллография
Минералогия и кристаллография Ненасыщенные углеводороды этиленового ряда
Ненасыщенные углеводороды этиленового ряда Термореактивные пластмассы (реактопласты)
Термореактивные пластмассы (реактопласты) Перегонка нефти
Перегонка нефти Депонирование и мобилизация жиров
Депонирование и мобилизация жиров ЭМВИ — прогрессивное направление в области криминалистических исследований
ЭМВИ — прогрессивное направление в области криминалистических исследований Презентация на тему: «Глюкоза» ученицы 11 класса Широковской ООШ Галаган Юлии Юрьевны
Презентация на тему: «Глюкоза» ученицы 11 класса Широковской ООШ Галаган Юлии Юрьевны  Виды и свойства текстильных материалов из химических волокон. 6 класс
Виды и свойства текстильных материалов из химических волокон. 6 класс Негізгі топша элементтерінің химиясы
Негізгі топша элементтерінің химиясы История развития биохимического знания и биохимии как науки
История развития биохимического знания и биохимии как науки Электролиз
Электролиз Нафта
Нафта